姜黄素对肝癌模型小鼠Keap1 / ARE 信号通路及胆汁酸肝肠循环的影响
2020-10-12牟海军陈幸幸
牟海军,金 海,陈幸幸,肖 宏,刘 黔,朱 蓉
(遵义医科大学附属医院 消化科, 贵州 遵义 563003)
肝癌是临床常见的消化系统恶性肿瘤,病情进展快、恶性程度高,易复发转移,预后差、死亡率高,我国是肝癌大国,其患者人数约占全球的半数以上,死亡率在所有恶性肿瘤中居第2 位,严重威胁居民的生命健康[1-2],因此探讨肝癌的发病机制,寻找安全有效的治疗药物具有重要的临床和社会意义,氧化应激损伤是引发肝癌的一个因素,氧化应激可导致肝细胞坏死,损害肝功能,引发胆汁酸肝肠循环障碍,造成胆汁淤积于肝内,进一步损害肝组织,因而减轻氧化应激反应是治疗肝癌的关键[3-4],胞质蛋白伴侣分子(Kelch-like ECH-associated protein-1,Keap1) / 核转录因子相关因子2 ( nuclear factor erythroid 2 related factor 2,Nrf2) / 抗氧化反应元件(antioxident responseelement,ARE)是机体主要的抗氧化信号通路,Keap1 是Nrf2 / ARE 的负调控因子,下调其表达,可激活Nrf2 / ARE 信号,增强机体抗氧化应激能力,减轻糖尿病引起的肾组织损伤,并通过减轻氧化损伤而抑制乳腺癌癌细胞增殖,发挥抗肿瘤作用,由此可知,Keap1 / ARE 信号是治疗肝癌的一个潜在作用靶点[5-6]。 姜黄素是提取自中药材姜黄的一种酚类化合物,具有抗炎、抗氧化、抗肿瘤作用等广泛的药理作用,姜黄素可促进肝癌细胞HepG2 凋亡, 抑制其增殖, 降 低 其迁移、 侵袭能力[7],并可改善肝癌兔肝功能,抑制其肿瘤血管生成,提高其生存时间[8], 但姜黄素对肝癌小鼠Keap1 / ARE 信号通路及胆汁酸肝肠循环的影响,目前还不清楚,本文通过二乙基亚硝胺诱导建立肝癌小鼠模型,对此进行研究,可为临床治疗肝癌提供新的参考。
1 材料和方法
1.1 实验动物
SPF 级C57BL/ 6 小鼠(75 只),6 周龄,体重18~22 g。 购于遵义医科大学实验动物中心[ SCXK(黔) 2018 - 0001],于本院SPF 级动物房中饲养[SYXK(黔)2018-0001],光照/ 黑暗交替照明(光照期6:00 ~18:00),自由饮水、进食,温度23℃左右,相对湿度50%左右,适应饲养一周后进行实验。 本实验已通过遵义医科大学动物伦理委员会审批批准( KLLY ( A) - 2019 - 095), 实验过程中遵循3R原则。
1.2 主要试剂与仪器
二乙基亚硝胺( N0756 - 10ML),美国sigma 公司;姜黄素(CY11354),北京凯瑞基生物科技有限公司;注射用顺铂(每支20 mg,批号:FA4A8029B),齐鲁制药有限公司; 大鼠转化生长因子- β1(transforming growth factor-β1,TGF-β1) ELISA 试剂盒(EK-0514),上海和序生物科技有限公司;大鼠白细胞介素-6 ( interleukin-6, IL-6 ) ELISA 试剂盒(ab100712)、兔源GAPDH 一抗( ab181602)、兔源Nrf2 一 抗 ( ab137550 )、 兔 源 Keap1 一 抗(ab139729)、羊抗兔二抗( ab150077),美国Abcam公 司; TRIzol ( 10296010 )、 逆 转 录 试 剂 盒(18091050 )、 荧 光 定 量 试 剂 盒( F415S ), 美 国Thermo Fisher Scientific 公司;RIPA 裂解液( P0013 K)、 BCA 试 剂 盒( P0011 )、 HE 染 色 试 剂 盒(C0105),上海碧云天公司等。 PUZS-300 全自动生化分析仪,上海帝博思生物科技有限公司;RM2035轮转切片机,德国Leica 公司;SMZ745 光学显微镜,日本尼康公司;Model 680 酶标仪、Trans-Blot SD 转膜仪、CFX96 Touch Deep Well 荧光定量PCR 仪,美国Bio-Rad 公司;3900 型高通量DNA 合成仪,美国应用生物系统公司;DYCZ-25D 型双垂直电泳仪,北京六一生物科技有限公司;2500 凝胶成像系统,上海天能公司等。
1.3 实验方法
1.3.1 动物模型的建立及分组给药
参照文献[9]制备肝癌小鼠模型:将二乙基亚硝胺溶于生理盐水,进行剂量换算后,以18 μg / g 剂量每天灌胃,持续4 周后,检测小鼠血清ALT、AST、TB、TBA 值,出现明显异常,解剖后肉眼观察肝形态,肝呈现体积增大,表面生有大小不等的结节,切面灰白,表明模型建立成功,共造模63 只,成功60只,随机分为模型组、姜黄素低剂量(10 μg / g) 组、姜黄素中剂量(20 μg / g)组、姜黄素高剂量(30 μg /g)组、顺铂(10 μg / g)组,每组12 只,另取12 只以等剂量生理盐水每天灌胃,持续4 周,设为对照组。
以生理盐水溶解姜黄素配制为1、2、3 μg / μL的姜黄素[10]溶液,姜黄素低、中、高剂量组小鼠以10 μg / g、20 μg / g、30 μg / g 灌胃,顺铂组[11]小鼠以10 μg / g 的剂量腹腔注射顺铂注射液,模型组和假手术组以等剂量的生理盐水灌胃,同时同剂量腹腔注射生理盐水,持续14 d。
1.3.2 标本采集及大鼠肝组织病理形态检测
用药结束后24 h,断头处死小鼠,腹主动脉取血3 mL,静置离心后提取血清储存在-80℃冰箱中备用,解剖后取出肝,剪取约1 g 肝组织储存于液氮中备用,其余肝组织经生理盐水漂洗、4%多聚甲醛溶液固定、低浓度到高浓度梯度乙醇脱水、二甲苯透明后,以石蜡包埋,以切片机做常规病理切片,行脱蜡、高浓度到低浓度的梯度乙醇处理后,参照HE 染色试剂盒说明书的步骤进行染色,经再次脱水、透明后封片,以光学显微镜观察肝组织病理形态,任选5 个视野拍照。
1.3.3 血清生化检测及IL-6、TGF-β1 水平测定
取1.3.2 中血清放置在4℃冰箱只解冻,取500 μL 以全自动生化分析仪检测其中ALT、AST、TB、TBA 水平,以ELISA 试剂盒检测剩余血清中IL-6、TGF-β1 水平,具体步骤参照各自的说明书进行。
1.3.4 肝组织中Keap1、Nrf2 mRNA 检测
取1.3.2 中的肝组织0.5 g 剪碎后加入TRIzol试剂,参照TRIzol 说明书的步骤提取总RNA,以逆转录试剂盒及荧光定量试剂盒将其逆转录为cDNA后进行荧光定量PCR 反应,反应体系的配制、反应条件的设定参照各自说明书进行,以GAPDH 为内参基因,采用2-ΔΔCt算法分析各组实验数据,qRTPCR 引物序列见表1。
1.3.5 肝组织中Keap1、Nrf2 蛋白检测
将1.3.2 中剩余的肝组织剪碎,加入蛋白裂解液,匀浆后离心提取总蛋白,参照BCA 试剂盒说明书的步骤测定其浓度,根据测定结果调整各组蛋白浓度至相同,取20 μL 样品液上样进行SDS-PAGE电泳后湿转,将蛋白全部转移至PVDF 膜上,经5%的脱脂奶粉封闭后依次加入兔源Keap1、 Nrf2、GADPH 一抗溶液(稀释比例为1 ∶2000),4℃孵育过夜,TBST 溶液漂洗后以羊抗兔二抗溶液(稀释比例为1 ∶1000)室温孵育2 h,TBST 再次漂洗后以ECL显色, 使用凝胶成像仪观察条带并拍照, 并以Quantity One 软件分析图像,得出各组蛋白的相对表达量。
1.4 统计学方法
采用SPSS 24.0 软件对实验数据进行统计分析。 计量数据采用平均数±标准差()表示,组间比较行单因素方差分析,进一步两两比较采用LSD-t检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 姜黄素对小鼠肝组织病理形态的影响
对照组小鼠肝组织形态正常,无病理损伤;模型组小鼠肝组织出现肝小叶结构破坏结构改变,细胞形态多变,大小不一,细胞核病理性分裂象增多,并有大量炎性细胞、成纤维细胞浸润等病理损伤,姜黄素低、中、高剂量组、顺铂组小鼠肝组织病理损伤减轻,且随姜黄素剂量升高而损伤逐渐减轻;姜黄素高剂量组与顺铂组小鼠比较,肝组织病理损伤程度无明显差异,见图1。
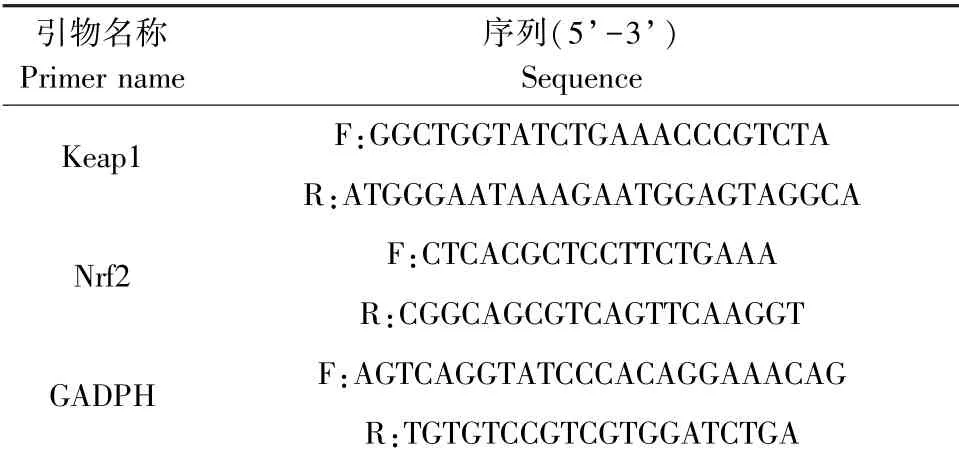
表1 qRT-PCR 引物序列Table 1 qRT-PCR primer sequences
2.2 姜黄素对小鼠血清生化指标的影响
与对照组比较,模型组小鼠血清ALT、AST、TB、TBA 水平显著升高(P<0.05);与模型组比较,姜黄素低、中、高剂量组、顺铂组小鼠血清ALT、AST、TB、TBA 水平降低(P<0.05);与姜黄素低剂量组比较,姜黄素中、高剂量组、顺铂组小鼠血清ALT、AST、TB、TBA 水平降低(P<0.05);与姜黄素中剂量组比较,姜黄素高剂量组、顺铂组小鼠血清ALT、AST、TB、TBA 水平降低(P<0.05);姜黄素高剂量组与顺铂组小鼠比较,血清ALT、AST、TB、TBA 水平差异无统计学意义(P>0.05),见表2。
2.3 姜黄素对小鼠血清IL-6、TGF-β1 水平的影响
与对照组比较,模型组小鼠血清IL-6、 TGFβ1 水平显著升高(P< 0.05);与模型组比较,姜黄素低、 中、 高剂量组、 顺铂 组 小鼠血清IL-6、TGF-β1 水平降低(P<0.05);与姜黄素低剂量组比较,姜黄素中、高剂量组、顺铂组小鼠血清IL-6、TGF-β1 水平降低(P<0.05);与姜黄素中剂量组比较,姜黄素高剂量组、顺铂组小鼠血清IL-6、TGF-β1 水平降低(P<0.05);姜黄素高剂量组与顺铂组小鼠比较,血清IL-6、TGF-β1 水平差异无统计学意义(P>0.05),见表3。
2.4 姜黄素对小鼠肝组织Keap/ ARE 通路相关蛋白mRNA 表达的影响
与对照组比较,模型组小鼠肝组织Keap mRNA水平显著升高(P<0.05),Nrf2 mRNA 水平显著降低(P<0.05);与模型组比较,姜黄素低、中、高剂量组、顺铂组小鼠肝组织Keap mRNA 水平降低(P<0.05),Nrf2 mRNA 水平升高(P<0.05);与姜黄素低剂量组比较,姜黄素中、高剂量组、顺铂组小鼠肝组织Keap mRNA 水平降低(P<0.05),Nrf2 mRNA水平升高(P<0.05);与姜黄素中剂量组比较,姜黄素高剂量组、顺铂组小鼠肝组织Keap mRNA 水平降低(P<0.05),Nrf2 mRNA 水平升高(P<0.05);姜黄素高剂量组与顺铂组小鼠比较,Keap、Nrf2 mRNA水平差异无统计学意义(P>0.05),见表4。

图1 各组小鼠肝组织损伤情况Note.A, Control group.B, Model group.C, Curcumin low dose group.D, Curcumin medium dose group.E, Curcumin high dose group.F, Cisplatin group.Figure 1 Liver tissue damage in each group
表2 各组小鼠血清ALT、AST、TB、TBA 水平(± s, n= 12)Table 2 Serum ALT, AST, TB and TBA levels of mice in each group

表2 各组小鼠血清ALT、AST、TB、TBA 水平(± s, n= 12)Table 2 Serum ALT, AST, TB and TBA levels of mice in each group
注:与对照组比较,aP<0.05;与模型组相比,bP<0.05;与姜黄素低剂量组相比,cP<0.05;与姜黄素中剂量组相比,dP<0.05。 下表同。Note.Compared with the control group, aP<0.05.Compared with the model group, bP<0.05.Compared with the low dose group of curcumin, cP<0.05.Compared with the middle dose group of curcumin, dP<0.05.The same as below.
组别Groups ALT(U/ L) AST(U/ L) TB(μmol/ L) TBA(μmol/ L)对照组Control group 42.32±10.02 119.47±18.93 6.63±0.13 61.23±12.81模型组Model group 251.57±53.24a 547.72±70.12a 42.76±8.16a 143.17±25.60a姜黄素低剂量组Curcumin low dose group 187.79±36.01b 412.57±51.23b 31.04±6.03b 116.08±20.15b姜黄素中剂量组Curcumin medium dose group 119.02±24.63bc 278.47±37.33bc 19.65±4.20bc 89.32±16.12bc姜黄素高剂量组Curcumin high dose group 46.86±10.01bcd 136.08±23.41bcd 7.89±1.02bcd 63.75±12.85bcd顺铂组Cisplatin group 44.95±8.73bcd 124.83±21.68bcd 8.02±1.07bcd 65.06±13.17bcd
表3 各组小鼠血清IL-6、TGF-β1 水平(± s ,n= 12)Table 3 Serum levels of IL-6 and TGF-β1

表3 各组小鼠血清IL-6、TGF-β1 水平(± s ,n= 12)Table 3 Serum levels of IL-6 and TGF-β1
组别Groups IL-6(ng/ L) TGF-β1(ng/ L)对照组Control group 214.56±33.18 982.63±186.72模型组Model group 389.65±40.37a 2750.82±487.53a姜黄素低剂量组Curcumin low dose group 332.53±39.02b 2092.15±276.18b姜黄素中剂量组Curcumin medium dose group 278.74±36.13bc 1507.74±201.13bc姜黄素高剂量组Curcumin high dose group 220.07±32.14bcd 997.82±120.62bcd顺铂组Cisplatin group 215.84±31.46bcd 989.76±131.70bcd
表4 各组小鼠肝组织Keap/ ARE 通路相关蛋白mRNA 相对表达(± s ,n= 12)Table 4 Relative expression of Keap/ ARE pathway related protein mRNA in liver tissue of mice in each group

表4 各组小鼠肝组织Keap/ ARE 通路相关蛋白mRNA 相对表达(± s ,n= 12)Table 4 Relative expression of Keap/ ARE pathway related protein mRNA in liver tissue of mice in each group
组别Groups Keap1 / GAPDH Nrf2 / GAPDH对照组Control group 0.99±0.11 1.03±0.17模型组Model group 2.26±0.22a 0.28±0.05a姜黄素低剂量组Curcumin low dose group 1.82±0.17b 0.51±0.08b姜黄素中剂量组Curcumin medium dose group 1.43±0.12bc 0.74±0.12bc姜黄素高剂量组Curcumin high dose group 1.01±0.12bcd 0.98±0.16bcd顺铂组Cisplatin group 1.02±0.13bcd 0.99±0.17bcd
2.5 姜黄素对小鼠肝组织Keap/ ARE 通路相关蛋白表达的影响
与对照组比较,模型组小鼠肝组织Keap 蛋白表达显著升高(P<0.05),Nrf2 蛋白表达显著降低(P<0.05);与模型组比较,姜黄素低、中、高剂量组、顺铂组小鼠肝组织Keap 蛋白表达降低(P< 0.05),Nrf2 蛋白表达升高(P<0.05);与姜黄素低剂量组比较,姜黄素中、高剂量组、顺铂组小鼠肝组织Keap蛋白表达降低(P<0.05),Nrf2 蛋白表达升高(P<0.05);与姜黄素中剂量组比较,姜黄素高剂量组、顺铂组小鼠肝组织Keap 蛋白表达降低(P<0.05),Nrf2 蛋白表达升高(P<0.05);姜黄素高剂量组与顺铂组小鼠比较,Keap、Nrf2 蛋白表达差异无统计学意义(P>0.05),见图2、表5。

图2 免疫印迹检测各组小鼠肝组织Keap/ ARE 通路相关蛋白表达Note.A, Control group.B, Model group.C, Curcumin low dose group.D, Curcumin medium dose group.E, Curcumin high dose group.F, Cisplatin group.Figure 2 Western blot to detect the expression of Keap/ ARE pathway related proteins in liver tissues of mice
表5 各组小鼠肝组织Keap/ ARE 通路相关蛋白相对表达(± s ,n= 12)Table 5 Relative expression of Keap/ ARE pathway related proteins in liver tissue of mice in each group

表5 各组小鼠肝组织Keap/ ARE 通路相关蛋白相对表达(± s ,n= 12)Table 5 Relative expression of Keap/ ARE pathway related proteins in liver tissue of mice in each group
组别Groups Keap1 / GAPDH Nrf2 / GAPDH对照组Control group 0.13±0.03 1.27±0.24模型组Model group 0.87±0.14a 0.09±0.02a姜黄素低剂量组Curcumin low dose group 0.52±0.08b 0.29±0.06b姜黄素中剂量组Curcumin medium dose group 0.33±0.06bc 0.65±0.14bc姜黄素高剂量组Curcumin high dose group 0.15±0.04bcd 1.18±0.27bcd顺铂组Cisplatin group 0.14±0.03bcd 1.16±0.26bcd
3 讨论
近年来,我国肝癌发病率呈上升趋势,对其发病机制及病理过程进行研究,找到安全有效的临床治疗方法,对保障居民生命健康具有重要的意义。肝癌动物模型是进行肝癌研究的重要材料,其中二乙基亚硝胺诱发的肝癌模型,成功率较高,对肝致癌有较好的专一性[12]。 二乙基亚硝胺具有较强的肝毒性,可促使致纤维化因子TGF-β1 和炎症因子IL-6 大量合成释放,诱导肝内炎症发生,损伤肝细胞,造成肝组织纤维化,并导致胆汁酸肝肠循环障碍,使肝内胆汁淤积,进一步加重肝损伤,继而发生肝细胞结节性增生及肝硬化,最后诱发肝癌,其病变过程与人类肝癌病程相似,因而广泛用于肝癌的临床及基础研究中[5,13-15]。 本文以二乙基亚硝胺灌胃诱导建立肝癌小鼠模型,结果显示,模型组小鼠肝组织出现肝小叶结构破坏结构改变,细胞形态多变,大小不一,细胞核病理性分裂象增多,并有大量炎性细胞、成纤维细胞浸润等病理损伤,血清ALT、AST、TB、TBA、IL-6 及TGF-β1 水平显著升高,表明二乙基亚硝胺可引发肝内炎症,造成肝纤维化,导致反映胆汁淤积型肝损伤的指标[16]ALT、AST、TB、TBA 异常升高,损坏肝功能及胆汁酸肝肠循环,并诱导肝细胞癌变,模型建立成功。
肝癌的临床治疗以手术、放化疗为主,但治疗效果不佳,且有较多副作用,中药因毒副作用小,因而在肿瘤的治疗中越来越受重视,姜黄素是中药材姜黄中含有的一种天然抗氧化物质,可调节细胞周期、增殖、清除氧自由基、抑制肿瘤生长,还具有较强的抗病毒和肝功能保护作用,可降低TNF-ɑ、IL-1β、IL-6 的表达,抑制炎症发生,诱导肝癌细胞凋亡,起到抗癌作用[17-19]。 但姜黄素对肝癌小鼠胆汁酸肝肠循环的影响,目前还未见研究,本文结果显示,肝癌小鼠经姜黄素处理后,肝组织病理损伤减轻,其血清ALT、AST、TB、TBA、IL-6 及TGF-β1 水平降低,且呈剂量依赖性,表明姜黄素能抑制肝内炎症发生,减轻肝纤维化,并缓解肝癌变,改善胆汁酸肝肠循环及肝功能。
研究发现机体主要的抗氧化通路Keap1 / ARE在乳腺癌、非小细胞肺癌的治疗中发挥着重要作用。 Keap1 作为Nrf2 的负调控因子,当其受氧化应激源刺激后,可大量降解,导致Nrf2 水平升高,并转运入核结合抗氧化反应元件ARE,启动ARE,促进抗氧化酶基因表达,减轻氧化应激,进而发挥抗肿瘤作用[6,20-21],因此Keap1 / ARE 通路可作为肝癌的一个潜在治疗靶点。 本文研究揭示姜黄素对肝癌的具有一定的治疗效果,但其作用机制目前还不清楚,以上研究提示姜黄素缓解肝癌病情进展的作用机制可能是调控二乙基亚硝胺诱导的肝癌小鼠肝组织中Keap1 / ARE 信号传导,本文对此进行了研究。 结果显示,肝癌小鼠肝组织中Keap1 mRNA 及蛋白水平显著升高,Nrf2 mRNA 及蛋白水平显著降低,以姜黄素处理后,肝组织Keap1 mRNA 及蛋白水平降低,Nrf2 mRNA 及蛋白水平升高,表明Keap1 /ARE 信号参与介导肝癌发生发展,姜黄素可下调Keap1 表达,上调Nrf2 / ARE 信号表达,减轻肝组织癌变,改善肝功能及胆汁酸肝肠循环。
综上所述,姜黄素可抑制Keap1 表达,激活下游Nrf2 / ARE 信号,减轻肝内炎症及肝组织纤维化,修复肝功能,改善胆汁酸肝肠循环,缓解肝癌变,为肝癌的临床治疗提供了新的思路,调节Keap1 / ARE 信号传导可能是其药理机制,但本文只进行了初步研究,关于其药理机制的证据不足,还需要后续使用Keap1 / ARE 信号的激动剂及抑制剂进行对照验证。
