REM睡眠剥夺对小鼠海马IL-21介导的炎症反应及Fas/FasL介导的神经元凋亡的影响
2020-10-12张娴吴伟
张娴 吴伟
睡眠是重要的生理现象,有助于大脑成熟及认知功能的建立。睡眠剥夺(sleep deprivation,SD)可导致认知功能下降,在一定程度上可促进阿尔茨海默病(Alzheimer disease,AD)的病理发展[1]。研究发现,辅助性T细胞17(Th17)浸润脑实质,并通过释放促炎因子及激活Fas/Fas配体(FasL)介导的凋亡途径参与AD的神经炎性反应及神经凋亡[2]。睡眠不足可激活免疫系统而加重炎性反应[3],且通过相关机制破坏血-脑屏障造成大脑功能障碍[4]。研究结果显示快速眼运动(rapid eye movement,REM)SD后大鼠海马凋亡标记物表达增多[5-6]。此外,炎性因子对细胞凋亡尤其Fas/FasL介导的死亡受体途径具有一定调控作用[7]。SD通过什么途径诱导神经元凋亡进而参与AD的发病过程,目前尚未见确切报道。本研究通过观察REM-SD对小鼠海马白细胞介素-21(IL-21)、Fas/FasL表达及神经元细胞凋亡的影响,旨在初步探讨其可能机制。
1 材料和方法
1.1 实验动物C57BL/6J雄性小鼠54只,6~8周龄,体重20~22 g,购自北京华阜康生物科技股份有限公司〔动物许可证号:SCXK(京)2014-0004〕。实验前于天津市神经病学研究所动物房内同笼适应性饲养3 d,正常光照及明暗交替,给予充分的水和食物,自由进食,适时更换垫料,环境安静无明显噪声。
1.2 主要试剂信号转导和转录激活因子-3(signal transducer and activator of transcription-3,STAT-3)抑制剂STA-21、荧光素(红、绿)、兔抗鼠IL-21抗体、兔抗鼠Fas抗体、兔抗鼠FasL抗体、兔抗鼠Caspase-8抗体、兔抗鼠Bcl-2抗体、兔抗鼠NeuN抗体、FITC标记山羊抗兔二抗(英国Abcam 公司)、凋亡试剂盒(瑞士Roche公司)。
1.3 方法
1.3.1动物分组及处理:将小鼠随机分为对照组、SD模型组、STA-21干预组,每组18只。应用改良多平台水环境法(MMPM)建立小鼠REM-SD模型[8],SD 3 d后灌注处死小鼠。STA-21干预组于造模前按体重0.5 mg/kg腹腔注射STA-21,1次/d,共14 d[9],随后给予SD 3 d,然后灌注处死小鼠;对照组分笼饲养3 d后灌注处死小鼠。
1.3.2海马神经元凋亡检测:采用免疫荧光法及TUNEL染色法测定海马CA1区及DG区神经元及凋亡。取对照组和SD模型组各6只小鼠脑组织固定过夜、梯度脱水,加入OCT包埋,连续切片,厚8 μm,冰冻保存。取部分冷冻切片室温下复温、破膜后,于37 ℃温箱封闭,滴加稀释后的一抗,置4 ℃冰箱过夜孵育,滴加二抗室温避光孵育,加入DAPI封片,镜下观察荧光染色情况,二抗标记的神经元细胞呈红色。余冷冻切片按上述步骤复温、破膜、封闭、孵育一抗、二抗后,滴加TUNEL反应液,置37 ℃温箱避光孵育,加入DAPI封片,镜下观察染色情况,二抗标记的凋亡神经元细胞呈绿色。阴性对照滴加50 μL标记液,阳性对照滴加50 μL反应液(酶缓冲液和标记液按1∶9比例混合)。
1.3.3Western blot法测定:每组取12只小鼠,断头取海马组织,提取总蛋白,BCA法测定蛋白浓度,经电泳、转膜、封闭后,加入一抗:兔抗鼠IL-21抗体(1∶1000)、兔抗鼠Fas抗体(1∶1000)、兔抗鼠FasL抗体(1∶1000)、兔抗鼠Bcl-2抗体(1∶1000)、兔抗鼠Caspase-8抗体(1∶1000)孵育过夜,以β-actin(1∶2000)为内参照;加入二抗:羊抗兔IgG H&L(HRP)(1∶5000),羊抗鼠IgG H&L(HRP)(1∶10000)室温孵育,加入ECL显色液显影,采用Quantity One 4.6.2图像分析系统分析条带灰度值,目标蛋白水平以目标蛋白条带灰度值/β-actin条带灰度值表示,计算海马组织IL-21、Fas/FasL、Bcl-2、Caspase-8蛋白水平。
1.4 统计学处理应用SPSS17.0软件进行统计学分析,对数据进行正态性和方差齐性检验,符合正态分布的计量资料用均数±标准差表示,多组均数采用单因素方差分析,两两比较采用LSD-t检验。取α=0.05。
2 结果
2.1 海马CA1区及DG区神经元变化与对照组比较,SD模型组小鼠海马CA1及DG区神经元数量未见明显减少,且未见神经元凋亡(图1、2)。
2.2 海马IL-21、Fas/FasL、Bcl-2、Caspase-8蛋白水平与对照组比较,SD模型组小鼠海马IL-21、Fas、FasL、Caspase-8蛋白水平升高(P<0.01),Bcl-2蛋白水平降低(P<0.01),STA-21干预组小鼠海马Fas、FasL、Bcl-2蛋白水平降低(P<0.01),而IL-21、Caspase-8蛋白水平与对照组比较差异无统计学意义(P>0.05)。与SD模型组比较,STA-21干预组小鼠海马IL-21、Fas、FasL、Caspase-8蛋白水平降低(P<0.01),Bcl-2蛋白水平升高(P<0.01)。结果见表1和图3。

注:SD:睡眠剥夺,图2~3、表1同 图1 免疫荧光法测定各组小鼠海马CA1及DG区神经元数量变化(×400) 图2 TUNEL法测定各组小鼠海马CA1区神经元凋亡(×400)
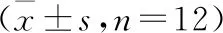
表1 各组小鼠海马IL-21、Fas、FasL、Bcl-2、Caspase-8蛋白水平比较
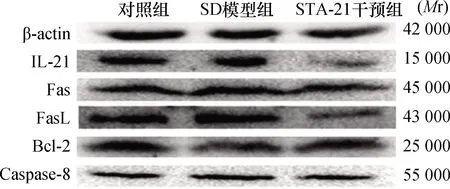
注:STA-21:信号转导和转录激活因子-3抑制剂,IL-21:白细胞介素-21,FasL:Fas配体,Bcl-2:B淋巴细胞瘤2基因,Caspase-8:半胱氨酸天冬氨酸蛋白酶8;表1同 图3 各组小鼠海马IL-21、Fas、FasL、Bcl-2、Caspase-8蛋白表达电泳图(Western blot)
3 讨论
SD通过各种机制影响大脑的认知功能,并在痴呆发病过程中起重要作用。海马神经炎症与神经元凋亡在SD对认知功能损伤机制中的作用尚不明确。临床研究提示长期的睡眠不足可导致认知功能下降或痴呆[10-11],可促进炎性因子的分泌,导致慢性炎症的发展,促炎因子的过度表达对海马神经发生具有炎性损伤作用[12]。SD可激活IL-17的过度表达,而Th17细胞及其分泌的IL-17、IL-21及IL-22等炎性因子在痴呆模型中发挥重要作用[2]。近来研究提示,慢性睡眠不足可促进大脑炎症反应,加重小鼠β淀粉样蛋白(Aβ)诱发的记忆损害[13]。神经炎症的发生可增加Aβ的沉积继而导致大脑功能的中断,这可能是SD参与认知功能损伤甚至痴呆发生的重要机制。
本研究结果显示SD模型组小鼠海马中炎性因子IL-21表达上调。IL-21可诱导CD4+T细胞向Th17细胞的分化[14],而Th17细胞穿过血-脑屏障进入中枢神经系统后,可通过直接和间接作用引起神经免疫炎症损伤。因此,REM-SD可能通过激活IL-21介导的炎症反应促进中枢炎性损伤而参与AD的发生发展。IL-21与IL-21R结合后可通过不同的信号传导通路发挥作用,其中JAKs-STATs为主要传导通路[15]。研究表明,STA-21可通过下调IL-21表达在多种疾病中发挥治疗作用[9,16-17]。本研究对小鼠进行STA-21持续腹腔注射14 d后发现,SD模型小鼠海马中上调的IL-21表达受到抑制。因此,通过控制IL-21分泌减轻SD海马炎性损伤可能成为治疗SD致中枢损伤的一个新的靶点。
研究证明REM-SD尤其是慢性SD后大脑可出现不同程度的细胞损伤及细胞凋亡[5]。本研究结果显示,小鼠经SD 3 d后其海马CA1和DG区的神经元数量均未见明显减少,其形态也未见改变,且未检测到凋亡神经元。这与Hipolide等[18]研究结论一致。亦有研究对小鼠进行2个月慢性SD,结果发现小鼠海马和皮质区凋亡神经元数量显著增加,并出现学习能力下降[19]。刘彤等[20]对大鼠进行4~6 d的持续SD,观察到大鼠出现学习能力下降。作者推测导致上述研究结论不一致的原因可能与SD时间长短有关,短期SD尚未造成神经元凋亡形态学上改变。而短期的SD可引起动物学习记忆等能力下降,可能是海马区凋亡调控因子发生不同程度改变,进而参与调控海马神经元的凋亡,造成认知功能受损。
本研究发现,小鼠海马中凋亡调控因子Fas/FasL及其下游因子Caspase-8表达上调,提示3 d的SD可能激活了小鼠海马区Fas/FasL介导的死亡受体通路。由此推测,尽管SD 3 d后尚未直接检测到小鼠大脑存在凋亡细胞,但海马中神经细胞凋亡的调控机制已经开启。Bcl-2则是与Fas作用相反的凋亡抑制因子,SD 3 d后小鼠海马区Bcl-2表达下调,进一步提示SD对于海马神经元凋亡分子水平具有调控作用。因此,SD可导致海马凋亡调控因子发生不同程度的变化,并可能通过激活Fas/FasL介导的死亡受体通路而进一步诱导海马神经元的凋亡,最终使海马功能受损而导致学习记忆能力下降等认知障碍的出现。
有研究显示,炎性因子可不同程度地影响凋亡调控因子的表达,进而调控细胞凋亡[2,7,21]。本研究结果显示,SD 3 d后小鼠海马炎性因子IL-21表达上调,海马中凋亡诱导因子Fas/FasL及其下游因子Caspase-8表达也随之增加,凋亡抑制因子Bcl-2表达受到抑制;当小鼠海马IL-21通路被阻断后,海马中Fas/FasL、Caspase-8表达随之减少,而Bcl-2表达增加,提示SD 3 d小鼠海马炎性因子IL-21的改变影响了Fas/FasL介导的死亡受体通路为主的凋亡调控因子的表达。
也有研究认为Fas/FasL对炎症反应同样具有一定的调控作用。抑制Fas/FasL的表达可减轻小肠细胞的炎症反应[22],缺乏Fas/FasL的小鼠肺部可出现局部感染[23]。注射异丙酚后新生大鼠丘脑和皮质中Fas/FasL、Caspase-8表达增加,并通过促进炎性因子的表达激活了小胶质细胞,在大脑神经炎症反应中发挥作用[23]。本研究中Fas/FasL通路是否对炎性因子IL-21的表达具有调控作用尚不清楚。
有关肾脏缺血再灌注损伤的研究[25]指出,通过抑制促炎因子诱导的肾小管上皮细胞Fas/FasL途径的细胞凋亡,对该损伤起到一定的缓解作用。近来关于大脑缺血再灌注损伤的研究[26]提示,抑制小胶质细胞分泌IL-1β、肿瘤坏死因子α(TNF-α)等促炎性因子后,对梗死灶周围脑组织神经细胞的凋亡亦起到抑制作用,从而发挥对大脑缺血再灌注损伤的保护作用。同样通过抑制痴呆模型中TNF-α、IL-1β、干扰素γ、IL-2、IL-17和IL-22等促炎性因子的表达,可减轻神经细胞凋亡等神经退化表现,对痴呆具有保护作用[27]。由此可见,炎性因子对细胞凋亡的调控作用与其发病机制相关症状的缓解及疾病的治疗至关重要。本研究结果显示,抑制IL-21的表达、下调海马Fas/FasL、Caspase-8的表达对神经元凋亡产生抑制,从而可保护海马神经组织免受损伤,可能对SD后导致的学习记忆能力下降等认知功能障碍具有缓解和改善作用。
综上所述,本研究结果显示,短期SD尚不能导致海马神经元发生形态学上的凋亡改变,但能使凋亡调控因子的表达发生改变,包括凋亡诱导因子Fas/FasL、Caspase-8表达增加,凋亡抑制因子Bcl-2表达减少。SD可促进小鼠海马IL-21介导的炎症反应,继而影响Fas/FasL介导的死亡受体通路为主的凋亡调控因子的表达。
