HDST技术应用于卵巢癌新辅助化疗中的效果分析
2020-10-12饶群仙林少丹彭永排林荣春何远桥林仲秋陈青松
饶群仙 ,韦 苑,林少丹,彭永排,林荣春,何远桥,林仲秋,陈青松
(1.中山大学孙逸仙纪念医院妇科肿瘤专科,广东广州 510120;2.广东药科大学公共卫生学院,广东广州 510310;3.南昌大学实验动物科学中心//南昌乐悠生物科技有限公司,江西南昌 330000)
卵巢癌作为女性最常见恶性肿瘤之一,其发病率呈逐年上升趋势[1]。因其缺乏典型症状及有效的筛查方法,难以实现早期诊断且具有种植和远处转移的特点[2]。超过70.0%的卵巢癌直到发展到晚期才被诊断[3]。研究表明卵巢癌的5 年存活率仅为47.4%[4],死亡率居妇科肿瘤第二位[5],历来被称为“沉默的杀手”[6]。近年来研究报道晚期卵巢癌患者的最佳治疗方法是以肿瘤细胞减灭术联合紫杉醇+铂类(卡铂及顺铂为主)的一线新辅助化疗(NACT)方案,肿瘤组织的异质性与原发性或继发耐药是影响肿瘤疗效的关键因素[7]。Vaughan 等[8]研究表明卵巢癌组织的化疗敏感性、反应预测因子和治疗耐药机制上存在的个体异质性导致患者间的化疗效果存在差异。近年来研究发现卵巢癌的原发性耐药的发生率约为15.0%~25.0%[9],大多数卵巢癌治疗后复发,并最终发展成耐药[10]。因此,可以认为卵巢癌的预后取决于是否及时诊断和系统的治疗[11],而指南推荐的化疗方案无法解决患者个体异质性以及耐药性的难题。通过评估化疗敏感性,可促进个体化治疗方案的优化[12],以克服和限制耐药性的发展[13],改善预后。目前国内外积极开展肿瘤培养药敏检测,体内药敏检测受技术复杂、价格昂贵、实验周期长等因素影响,药敏检测主要以细胞生物学实验等体外检测为主。水凝胶包被的肿瘤组织培养药敏检测法(hydrogel embedded histoculture drug sensitivity test,HDST),简称HDST 技术,是借鉴国外先进技术,研究探索出来一种新型肿瘤组织体外药敏快速检测方法,相对于四氮唑盐比色法(methyl thiazolyl tetrazolium,MTT)、组织块培养法(histoculture drug response assay,HDRA)、三磷酸腺苷生物发光法(ATP tumor chemosensitivity assay,ATP-TCA)、基因分型、耐药基因分析法等检测方法,其在筛选肿瘤化疗药物上具有快速方便、经济实惠、可行性高等显著特点。近年来,HDST 技术在我国开始临床试验,研究发现HDST 与咽喉肿瘤临床化疗方案的疗效具有较好的相关性[14],但该技术在国内外卵巢癌的研究中仍处于空白阶段。本研究应用HDST 在卵巢癌个体化化疗中的作用,探究HDST 在卵巢癌个体化新辅助化疗方案选择中的意义,以改善晚期卵巢癌患者的预后。
1 材料与方法
1.1 研究对象
本研究回顾性分析2019 年10 月至2020 年1月于广州市中山大学孙逸仙纪念医院妇科肿瘤专科收治的11 例按照NCCN 指南推荐行新辅助化疗的Ⅲ~Ⅳ期卵巢癌患者,收集患者的社会人口学资料、病理学及手术记录、影像学、肿瘤标记物等临床资料。本研究经患者知情同意,并报送我院伦理委员会审批通过。研究对象按新辅助化疗中HDST 药敏有效率进行分组,其中A 组(有效率<30.0%)、B 组(有效率30.0%~60.0%)、C 组(有效率≥60.0%)。分析不同组别的CA125、HE4、Fagotti评分指标变化的差异,探讨HDST 有效率与化疗疗效的关系。
1.2 纳入与排除标准
纳入标准:①患者初次手术行腹腔镜或剖腹探查术或穿刺活检,组织学诊断符合2014 年FIGO分期Ⅲ~Ⅳ期;②患者术后行3 次新辅助化疗后再行间歇性肿瘤细胞减灭术;③术中切除肿瘤组织行HDST 技术检测;④治疗前已完善胸片、腹部彩超、阴道超声、CT、肿瘤标记物等检查;⑤所有患者心肝肾功能无明显异常,无化疗禁忌症。排除标准:①患者除化疗外接受其他类型的辅助治疗,如靶向治疗、放疗、内分泌治疗等;②未完成3 次规范化新辅助化疗疗程。
1.3 HDST 技术
将肿瘤患者术中切除的肿瘤组织切割成微小组织块,经肿瘤标本采集,肿瘤样本处理,组织块接种,药物处理,敏感性检测和结果分析,分析时根据吸光度值换算公式将孔板各孔的吸光度值进行换算,进而计算出每种药物对肿瘤组织块活性的影响。依据MTS 比色法药物敏感性检测判断标准定义抑制率≥30.0%为有效药物,抑制率<30.0%则判定为无效药物。
1.4 实验方法
1.4.1 样本的采集及处理 ①样本的采集:手术切除下来的新鲜卵巢癌肿瘤样本离体后尽快取材(15 min 以内)。标本离体后用预冷生理盐水清洗,然后放入装有预冷的组织保存液的离心管中。低温2℃~8℃条件下4 h 内运输至实验室(切勿冷冻),存于细胞实验室生物安全柜。②肿瘤组织处理:在细胞实验室生物安全柜内将肿瘤组织进行活性鉴定、修整、消毒和清洗后分割成2 × 2× 2 mm 的组织块,96 孔细胞培养板每1 个孔内放1 块分割好的组织块,细胞培养板放在冰板上预冷。
1.4.2 组织的体外培养 ①组织块接种:将一定量的水凝胶溶液(80 μL,96 孔细胞培养板)加入到在含有组织块的细胞培养孔中,淹没全部组织块,盖上盖子后放入37 ℃,体积分数5%二氧化碳含量的细胞培养箱中孵育1 h,待水凝胶凝固后,将培养板取出在生物安全柜里加入适量的组织培养基(100 μL/孔),再放入细胞培养箱中培养。②药物处理:组织块培养24 h 候后吸弃原来的组织培养基,加入含有测试药物的新鲜组织培养基,每24 h 更换一次含有测试药物的完全培养基。
1.4.3 药物敏感性检测 给药3 d 后吸弃含药培养基,用PBS 洗涤3 次,然后加入MTS 溶液孵育6 h,从装有组织块的细胞培养板中的每个板孔中吸取100 μL 溶液,把吸取的溶液加入新的细胞培养板的孔板中,使用酶标仪检测每孔的吸光度值。
1.4.4 药敏检测结果判定 根据算式A=abc,将各孔吸光度值进行换算,计算每种药物对肿瘤组织块活性的影响。其中a 为吸光系数[单位为L/(g·cm)],b 为光在样本中经过的距离(通常为比色皿的厚度,单位为cm),c 为溶液浓度(单位为g/L)。酶标仪检测490 nm 波长处的OD 值。药物抑制率=(1-D药物组/D对照组)×100%。实验重复3 次,取平均值[14]。
1.5 统计学分析
采用SPSS 25.0 软件进行统计分析,计量资料用均数±标准差()进行描述,非正态分布的计量资料采用中位数和四分位数[M(P25~P75)]描述,计数资料用例数n进行描述。采用kappa检验一致性,采用Spearman′s 秩相关分析。所有检验均为双侧,检验水准α=0.05。
2 结果
2.1 基本情况
本研究共收集11 例晚期卵巢癌患者。研究对象年龄位于55~69 岁之间,临床分期以ⅢC 期为主。经评估所有患者均可耐受化疗,所有患者进行剖腹/腹腔镜探查/活检,共10 例进行了探查手术,以评估是否能进行初次满意肿瘤细胞减灭术,其中腹腔镜探查6 例,开腹探查4 例,余1 例行腹水穿刺活检后确诊;病理类型以高级别浆液性癌为主,占9 例,低级别浆液性癌和低分化腺癌各1 例。随着新辅助化疗次数的增长,肿瘤标志物CA125 与HE4 均呈现明显的逐次下降趋势。完成3 次新辅助化疗后,患者CA125(U/mL)从化疗前的1 181.2(564.3~2 750.0)降至25.5(14.9~63.6),HE4(pmol/L)从1 317.0(212.4~1 488.0)降至108.8(65.7~376.8),而化疗后Fagotti评分从8.0(4.0~8.0)分降至2.0(0.0~2.0)分(表1)。
2.2 患者HDST 药敏结果
11 例患者均严格按照NCCN 指南的推荐制定的以紫杉醇-铂类联合化疗的新辅助化疗方案。根据HDST 药敏结果,11 例患者中有8 例在化疗过程中使用HDST 结果中敏感性最高的推荐首选化疗药;6 例患者对选用的铂类药(顺铂或卡铂)不敏感,1 例对紫杉醇不敏感。采用的化疗药中至少一半以上的药物是有效的患者共6 人,其中仅3 例患者选用全部敏感的化疗药(表2)。
2.3 HDST 结果与临床疗效的一致分析
HDST 技术判定化疗药物是否有效的结果与患者实际的临床疗效结果的一致性较好(Kappa=1.000,P<0.05;表3)。HDST 技术在预测卵巢癌患者临床疗效方面的灵敏度、特异度和正确指数为100.0%。基于HDST的结果,对于化疗过程中使用了HDST 提示不敏感(有效率<30.0%)的药物的患者,预测临床疗效为无效的准确率达100.0%。
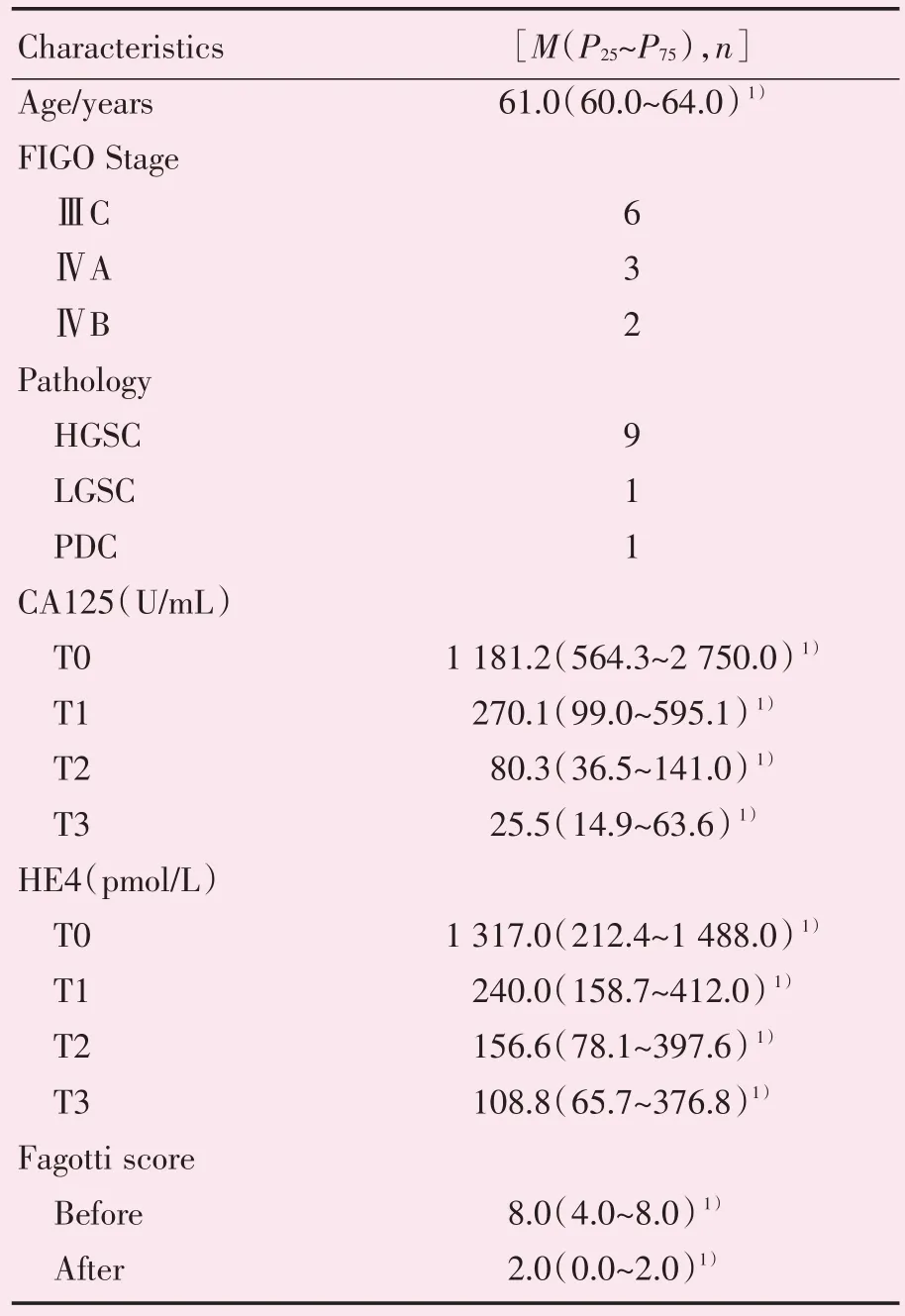
表1 患者基本情况及临床特征Table 1 Basic information and clinical characteristics of patients
2.4 HDST有效率与患者肿瘤指标变化的相关分析
随着新辅助化疗次数的增长,A 组患者HE4、CA125 水平出现不降反升现象,其他组患者的肿瘤标志物CA125 及HE4 的累积下降率均呈现逐次升高(图1),8 例B、C 组(有效率≥30.0%)患者在完成3 次新辅助化疗后肿瘤标志物水平恢复正常,B、C 组患者肿瘤标志物总下降率比A 组患者高1~2倍,且Fagotti 评分下降率超过70.0%(表4)。经Spearman′s 秩相关分析,患者Fagotti 评分变化和HDST 有效率间存在显著正相关(rs=0.678,P<0.05),而CA125、HE4 总下降率和HDST 有效率间无相关(P>0.05)。
3 讨论
卵巢癌由于早期发病并无明显典型临床特征,难以实现早期诊断,不利于卵巢癌患者的治疗。卵巢癌相关的高死亡率在很大程度上归因于晚期诊断和耐药性[15]。目前认为晚期卵巢癌患者的最佳治疗方法是以肿瘤细胞减灭术联合以紫杉醇+铂类(卡铂及顺铂为主)为基础的一线新辅助化疗(NACT)方案[16],以达到降低肿瘤负荷,提高手术效果,改善预后的目的。我们的研究发现晚期卵巢癌患者在按NCCN 指南推荐选择一线“最佳”方案进行的新辅助化疗过程中出现耐药的情况,6 例患者选用指南推荐却自身不敏感的铂类药(顺铂或卡铂),1 例患者对紫杉醇不敏感。这与前人研究报道的15.0%~25.0%的卵巢癌原发性耐药率[9],其中初治患者25.0%的原发性铂类耐药率[17]相比,本研究中一线铂类药的耐药比例更高,这可能是与本研究样本量较少相关。但无可否认的是,由于耐药性的存在,完全根据指南推荐制定的化疗方案并不是患者最优的“治疗配方”。基于卵巢癌尚缺有效的早期筛查手段,有效的药敏检测技术以指导制定患者个体化化疗方案,将明显改善患者预后。

表2 患者HDST 结果及临床用药方案Table 2 Patients′HDST results and clinical medication regimen
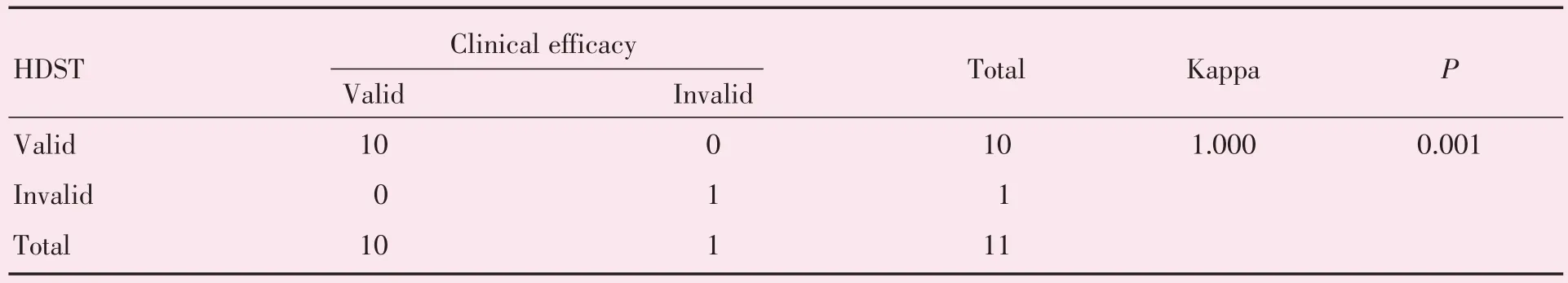
表3 HDST 结果与临床疗效的一致性分析Table 3 Analysis of consistency between HDST results and clinical efficacy
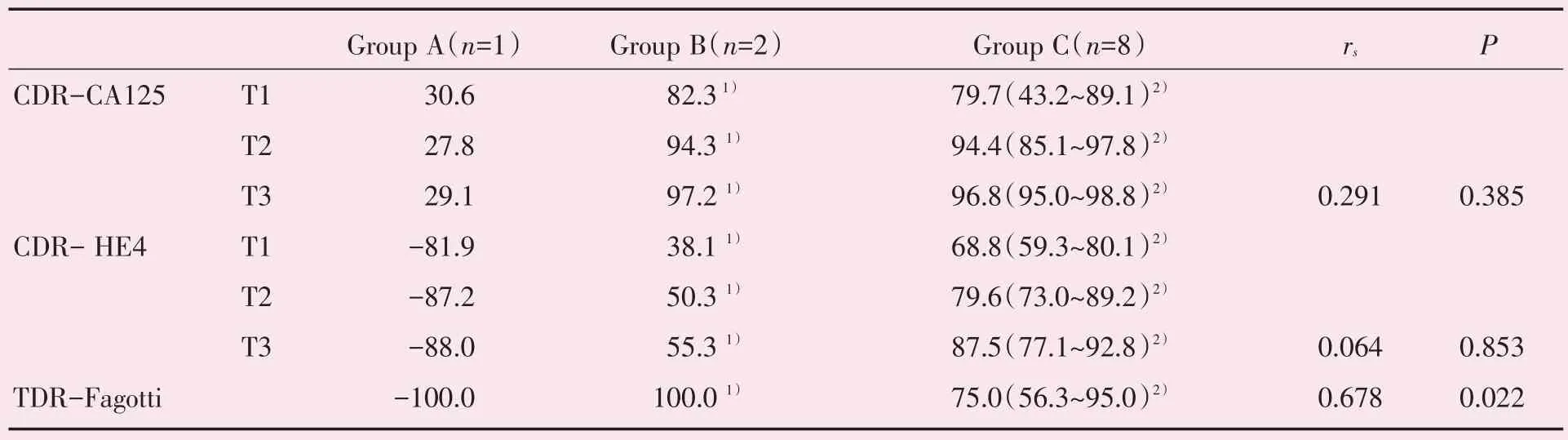
表4 三组患者肿瘤标记物及Fagotti 评分下降率变化情况Table 4 Changes of tumor markers and Fagotti scores in patients of the three groups(%)

图1 三组患者CA125、HE4 及Fagotti 评分下降趋势Fig.1 Declining trend of CA125,HE4 and Fagotti scores in patients of the three groups
本研究研究对象选择11 例晚期(Ⅲ/Ⅳ期)行3 疗程新辅助化疗的卵巢上皮性肿瘤患者,新辅助化疗临床疗效评估提示10 例有效,1 例无效。如上文所述,由于肿瘤异质性和肿瘤微环境的影响,若不能恰当地筛选敏感度高的药物治疗及时控制病情进展,不但会耽误患者病情,延长病程,细胞毒性化疗药的不当使用还可能导致不必要的毒副作用,诱导耐药等不良预后。
为了探究HDST 技术在新辅助化疗中应用的可靠性,我们对基于患者HDST 药敏情况判定的疗效结果与临床疗效的一致性分析发现,HDST 药敏是否有效与临床疗效判定结果之间一致性较好(Kappa=1.000,P<0.05),HDST 技术在预测卵巢癌患者临床疗效方面的灵敏度、特异度高。此外,比较3 组患者肿瘤观察指标变化情况(图1),可能受样本量的限制及Spearman′s 秩相关较低的检验功效的影响,本研究中尚未能证明肿瘤标志物下降率与HDST 药敏有效率间的相关性,但我们发现了有效率与Fagotti 评分指标存在正相关(rs=0.678,P<0.05)。进一步分析发现,无效组中有一例患者采用NCCN 指南推荐的多西他赛联合顺铂或卡铂化疗方案进行新辅助化疗过程中出现肿瘤进展。HDST 结果显示该患者对一线药顺铂和卡铂几乎无效,而对紫杉醇和洛铂敏感。因此,调整该患者化疗方案为紫杉醇联合洛铂化疗2 次后,肿瘤标记物均降至正常,且随访半年无复发。从按指南推荐的方案化疗后无效的化疗疗效,到基于HDST 结果调整方案化疗后的病情改善,提示即使存在个体差异和肿瘤异质性,根据HDST技术确实可为患者精准治疗提供依据,有助于临床医生在众多一线化疗药物中筛选出病患的个体化精准方案,改善患者预后。
值得一提的是,本研究也意外发现一例继发耐药的患者,其活检时首次HDST 结果显示对紫杉醇、卡铂及顺铂等一线药敏感度高于60.0%,3 次新辅助化疗后,IDS 术中再次取病理组织进行二次HDST 检测发现一线化疗药的敏感度均降低,甚至已发展为对卡铂及顺铂耐药,而对洛铂的敏感度也不佳(仅33.0%)。短短间隔3 个月的两次HDST 检测结果的变化提示晚期患者的耐药性处于持续进展,这与其他研究的结果一致。即大多数患初始治疗良好,治疗后会出现复发或最终发展成耐药的情况[10]。基于患者动态进展的药敏情况,仅一次HDST 检测尚不能满足临床医生全程掌控病情进展的需求。因此,HDST 技术应用于晚期卵巢癌患者新辅助化疗中若能实现多次检测,效果更佳。
HDST 技术的优势得益于其利用水凝包被的微组织培养技术提供的三维空间结构,保持了组织的活性和肿瘤的微环境[18-19],且在筛选肿瘤化疗药物上3~7 d 即可及时提供检测结果,而建立人源肿瘤异种移植(patient-derived xenografts,PDX)模型就需要2~4 个月[19]。这不但弥补了目前PDX 等检测耗时长、费用高[7]缺点,同时其结果判读方法借鉴成熟的MTT 法,药敏结果与临床化疗方案疗效相关性高[20],检测的结果符合临床应用的指南推荐化疗方案,具有快速方便、经济实惠、可行性高等显著特点。
基于HDST 的优势,在癌症化疗方案的筛选上可快速有效地提供一定的帮助。然而,HDST 也具有一定的局限性。作为一种体外化疗药物筛选方法,对于环磷酰胺这类需经肝脏活化后发挥抗肿瘤作用的前体药物的抗癌效果无法直接评估[14]。另外,PARP 抑制剂等靶向口服药已用于卵巢癌维持治疗[21],而HDST 对于靶向口服药物的检测数据还在持续积累中。本研究还存在样本少的缺陷,我们正在开展更大样本的研究,同时对卵巢癌患者进行长期随访及统计分析,以了解根据HDST 结果选择化疗方案的患者的生存优势,为今后卵巢癌患者尤其是原发性耐药的卵巢癌患者依据药筛结果进行个体化精准化疗提供理论依据。
HDST 药敏检测法在卵巢癌的新辅助化疗方案筛选上具有快速方便、经济实惠,结果与临床疗效一致的优势,有望为卵巢癌患者提供精准的个体化化疗方案。
