MRI在阿尔茨海默病与血管性痴呆中的鉴别价值
2020-10-12郭浩明郑伊能张丽娟龚贝贝郑婉琳吕发金
郭浩明,郑伊能,张丽娟,龚贝贝,蔡 焰,郑婉琳,吕发金
(重庆医科大学附属第一医院放射科,重庆 400016)
痴呆是一种以认知障碍为核心并引起日常活动能力减退的临床综合征,它不仅会严重影响患者的生活质量,还为社会带来沉重的负担[1]。根据世界卫生组织发布的《2015 年世界阿尔茨海默病报告》,预计到2020 年将有7 400 万病例。而很多研究[2-3]表明,我国痴呆的总人数和发病率都逐年递增。痴呆的分类多样,其中阿尔茨海默病(Alzheimer′s disease,AD)与血管性痴呆(vascular dementia,VaD)是最常见的两种痴呆类型[4],由于两者的治疗手段有所差异,故将VaD 与AD 的准确鉴别诊断具有重要的临床意义。MRI 可以清晰显示脑组织结构,且目前在临床和科研已广泛应用。而在MRI 常可观察到脑白质高信号(white matter hyperintensity,WMH)又称脑白质病变(leu⁃koaraiosis),其在CT 上表现为低密度影,在MRI 上表现为T2 加权成像(T2WI)或T2 液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)高信号,T1 加权成像(T1WI)等信号或低信号[5]。随着研究的不断深入,目前WMH 被认为是脑小血管病的一种表现[6],它成为脑研究中一个重要的影像学征象[7],不同疾病的WMH 差异巨大,且目前研究显示WMH 与痴呆的发生或发展密切相关[8-11]。故本研究利用MRI 量化比较AD 与VaD的脑区体积异同,并结合WMH 的差异,探讨MRI对二者鉴别诊断的临床价值,为临床准确诊断及后续治疗提供重要的参考依据。
1 材料与方法
1.1 研究对象
回顾性分析2014年1月1日至2019年11月1日在我院神经内科或老年科住院并经临床确诊为AD和VaD患者的临床资料及MRI图像。AD或VaD患者入组严格按相关标准进行。纳入标椎:①所有患者均符合美国精神病学会精神障碍诊断和统计手册第4 版(Diagnostic and statistical manual of mental disorders,forth edition,DSM-Ⅳ)对痴呆的诊断标准[12],临床痴呆评定量表评分≥1 分,并由经过培训的医师按简易精神状态检查(Mini-Mental State Examination,MMSE)进行评分,所有入组患者得分<24 分[13];②年龄50~90 岁之间;③AD 患者均符合美国国立神经疾病、语言交流障碍和卒中研究所-阿尔茨海默病及相关疾病学会(NINCDS-ADRDA)可能或很可能AD 的诊断标准[15],Hachinski 缺血评分≤4 分;④VaD 患者均符合美国国立神经系统疾病与卒中研究所和瑞士神经科学研究国际协会(NINDS-AIREN)很可能VaD 的诊断标准[15],Hachinski 缺血评分≥7 分;⑤所有患者具有完整的临床资料,并均于住院前后一周内行MRI 检查(T1WI、T2 FLAIR),且可从PACS系统获得清晰完整的MRI图像。排除标准:①颅内存在其他病变者,如肿瘤、感染、外伤等;②无法判断病因的痴呆、混合型痴呆、路易体痴呆、额颞叶痴呆、帕金森病痴呆及中枢神经系统其他疾患所致痴呆;③脑MRI 图像模糊,质量差或序列不完整。④基本信息或相关临床量表不完整。本研究获得本院伦理委员会批准,所有患者均对本研究知情同意。
1.2 仪器与方法
采用3.0T Signa HDxt(GE Healthcare,美国)和1.5T MAGNETOM ESSENZA(Siemens Health⁃ineers,德国)MRI 成像系统,采用头颅8 通道标准线圈。MRI 扫描参数:T1WI:TR 1 700~1 800 ms,TE 15~22 ms,视野(FOV)240 mm×240 mm,层厚5 mm,间隔1.5 mm,T2 FLAIR:TR 7 500~8 000 ms,TE 110~130 ms,FOV 240 mm×240 mm,层厚5 mm,间隔1.5 mm。患者扫描时均取仰卧位,扫面范围均为头顶至颅底。
1.3 脑区和WMH 体积分析
脑区体积及WMH 体积计算采用AccuBrainTM分析系统(深圳博脑医疗科技有限公司,中国香港)。AccuBrainTM是一种新型全自动定量测量大脑结构的工具,在之前的研究已验证其有较好的图像分割和分析能力[16]。将所有患者的T1WI 及T2 FLAIR 的DICOM 格式数据压缩成Zip 格式文件,并同时上传至AccuBrainTM云端系统进行图像分析。该系统是基于多模版的分割方式自动分割的。为了将不同MRI 设备和参数下图像的标准化,它首先将图像进行了预处理(包括噪声抑制、偏置场校正和强度归一化)。再从众多模版中选择与目标图像的最为相似的一些图像,并将他们融合形成一个新的自组模版。然后将该模版和该病人图像进行非刚性图像配准。配准后,将该图谱中的预定义标签进行转化融合,生成该患者的分割标签,并记录各标签区域的体积。一个患者处理约25 min 后自动生成一份包含患者信息、各脑区体积和WMH 体积信息的PDF 格式报告。本研究评估PDF 报告中所有的脑参数信息,如颅内总体积、脑实质、WMH 60 余种脑区的绝对体积以及WMH 的相对体积(即WMH 绝对体积占颅内总体积的百分比;图1、2)。
1.4 WMH 评分
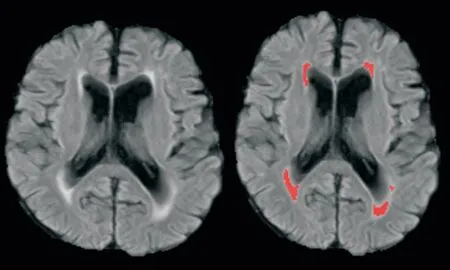
图1 AccuBrainTM的WMH 分割示图Fig.1 Representative images of segmentation for WMH by AccuBrainTM
采用Fazekas 视觉评分量表[17]进行WMH 严重程度评估(0~6 分),将脑室旁和深部白质病变分开评分。两部分的分数相加计算总分。脑室旁WMH(periventricular WMH,PVWMH)评分:①0分:无病变;②1 分:帽状或者铅笔样薄层病变;③2 分:病变呈光滑的晕圈;④3 分:不规则的脑室旁高信号,延伸到深部白质。深部WMH(deep WMH,DWMH):①0 分:无病变;②1 分:点状病变;③2 分:病变开始融合;④3 分:病变大面积融合(图3)。文献报道检验此评分法的评分者间一致性好[18]。图像由2名经验丰富的放射科(神经组)医师在接受1 周Fazekas 量表培训后在PACS工作站上对WMH 评分,并屏蔽入组人员年龄、性别和其他危险因素等信息,若两名医师评分不统一时经讨论后达成一致。
1.5 临床资料收集
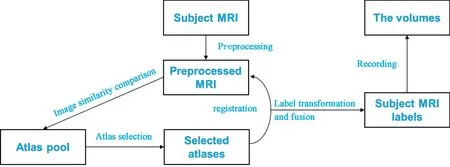
图2 AccuBrainTM工作流程Fig.2 AccuBrainTM pipeline
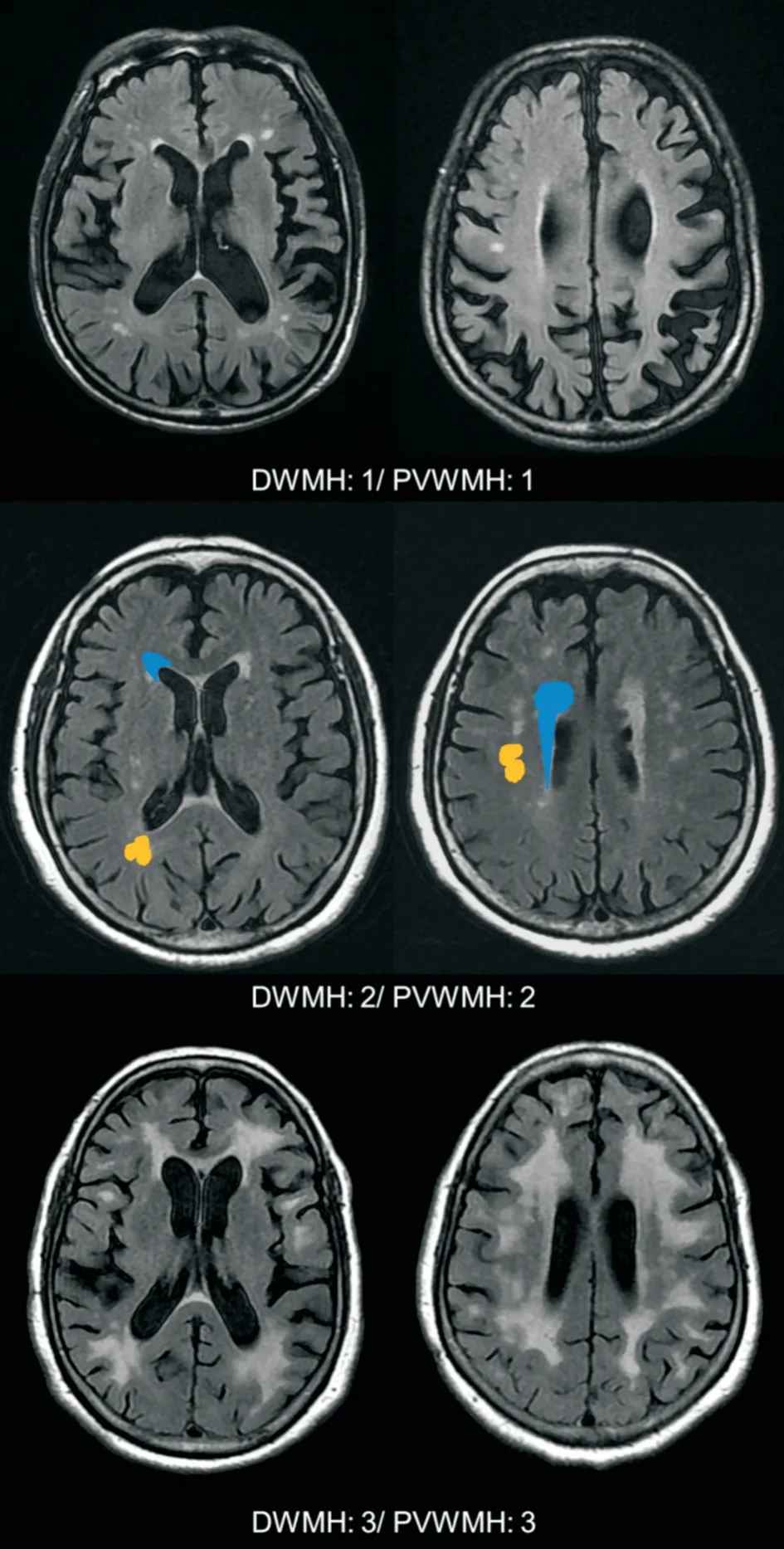
图3 Fazekas 评分示图Fig.3 Representative images of application of The Fazekas Scale
所有入组研究对象都在我院由经过培训且经验丰富的医生进行身体和神经系统检查。并记录包括年龄、性别、身高、体质量,并计算体质量指数(body mass index,BMI)、危险因素(吸烟史、饮酒史、高血压、糖尿病)、MMSE 评分。
1.6 统计学方法
采用SPSS 22.0 软件。AD 组和VaD 组的男性、吸烟史、饮酒史、高血压病史、糖尿病病史、DWMH 评分(2~3)、PVWMH 评分(2~3)、WMH 总体评分(3~6)的人数为计数资料,故采用χ2检验进行组间比较。AD 组和VaD 组的年龄、BMI 和部分脑区体积为符合正态分布的计量资料,故用以表示,并采用t检验进行组间比较;两组的MMSE 评分、大部分的脑区体积以及WMH 体积为非正态分布的计量资料,故以M(P25~P75)表示,并采用Mann-WhitneyU检验进行组间比较;对AccuBrainTM自动生成的定量参数采用主成分分析(principal component analysis,PCA)和建模分析,①挑选差异有统计学意义的指标并删除高相关性(|r|>0.90)的指标后,选择累积贡献率>80%主要成分,再在其中找到影响较大的指标,②建模方法:AccuBrainTM自动生成的所有数据进行单因素分析,然后进行相关性检验去冗余,后采用二元logistic 回归建立模型。最后将PCA 找到的影响较大指标和建模后的新参数绘制受试者工作特性(receiver operating characteristic,ROC)曲线,并记录临界值、相应的敏感度、特异度及曲线下面积(area under curve,AUC),计算约登指数,在约登指数最大时评价阈值。P<0.05 认为差异有统计学意义。
2 结果
2.1 AD 与VaD 患者一般情况比较
最终共纳入AD 及VaD 共109 例,其中AD 组74 例,男31 例,女43 例,年龄56~87(73.51±7.98)岁;VaD 组35 例,男20 例,女15 例,年龄54~88(70.74±9.83)岁。统计患者基本情况,两组患者性别、年龄、MMSE 评分、BMI、吸烟史、饮酒史、高血压病史、糖尿病病史比较,差异均无统计学意义(P>0.05;表1)。
2.2 AD 与VaD 患者基于AccuBrainTM 的脑区体积比较
与VaD 组相比,AD 组颅内总体积、脑实质、脑灰质、脑白质、海马、杏仁核、下丘脑、额叶(左、右)、枕叶(左、右)、颞叶(左、右)、顶叶(左、右)、海马(左、右)、杏仁核(左、右)、下丘脑(左、右)体积均减小,且差异具有统计学意义(P<0.05;表2)。
2.3 AD 与VaD 的WMH 比较
根据Fazekas 量表评分结果,AD 与VaD 患者的PVWMH 2~3 分及总WMH 3~6 评分人数比例无明显统计学差异(P>0.05);对比VaD 组,AD 组DWMH 2~3 分人数较少,差异具有统计学意义(P=0.015);基于AccuBrainTM得到WMH 绝对体积与相对体积,AD 与VaD 比较差异均具有统计学意义(P<0.05;表3)。
表1 患者一般资料Table 1 General information of patients[()or n(%)or M(P25~P75)]
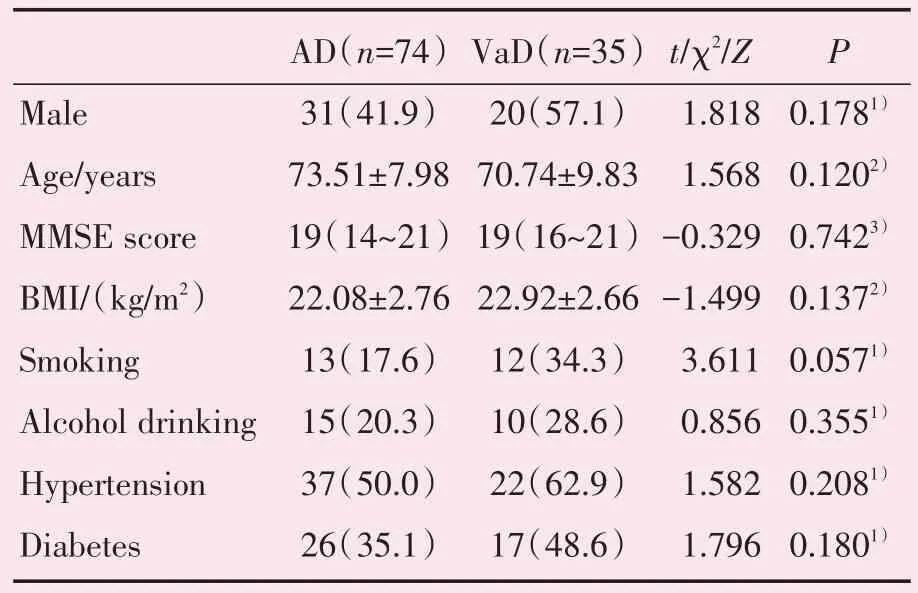
表1 患者一般资料Table 1 General information of patients[()or n(%)or M(P25~P75)]
AD:Alzheimer′s Disease;VaD:Vascular Dementia;1):χ2-test;2):t-test;3):Mann-Whitney U test
2.4 PCA 和模型建立及鉴别效能比较
AD 组和VaD 组间差异有统计学意义的Accu⁃BrainTM的定量参数(包括21 个脑区体积、WMH 绝对体积及相对体积)进行相关分析,发现脑实质与颅内总体积、脑白质、脑灰质之间、海马与海马(左、右)、杏仁核与杏仁核(左、右)、下丘脑与下丘脑(左、右)、额叶(左)与额叶(右)、枕叶(左)与枕叶(右)、颞叶(左)与颞叶(右)、顶叶(左)与顶叶(右)及WMH 绝对体积与WMH 相对体积之间具有很好的相关(r>0.90),故删除颅内总体积、脑白质、脑灰质、海马(左、右)、杏仁核(左、右)、下丘脑(左、右)、额叶(右)、枕叶(右)、颞叶(右)、顶(右)、WMH(相对体积)。然后对剩余的9 个定量参数的PCA 统计分析,发现重要的参数有8 个,分别为脑实质、海马、杏仁核、下丘脑、额叶(左)、枕叶(左)、颞叶(左)、顶叶(左)(表4、图4)。
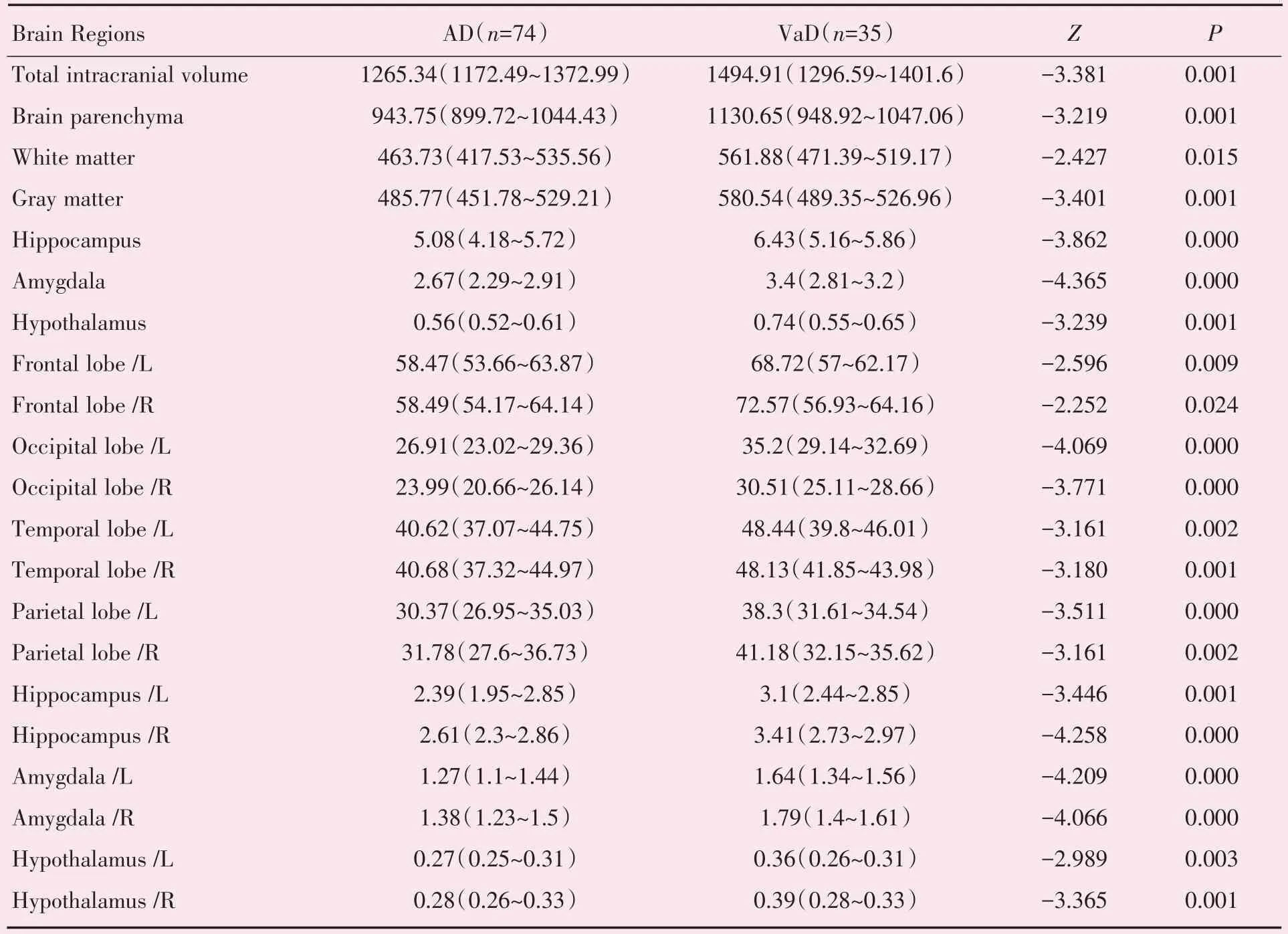
表2 AD 与VaD 患者基于AccuBrainTM的脑区体积定量比较Table 2 The quantitative volume comparison of brain regions based on AccuBrainTM between AD and VaD patients[M(P25~P75),mL]

表3 AD 与VaD 患者WMH 比较Table 3 The comparison of WMH between AD and VaD patients[n(%)or M(P25~P75)]
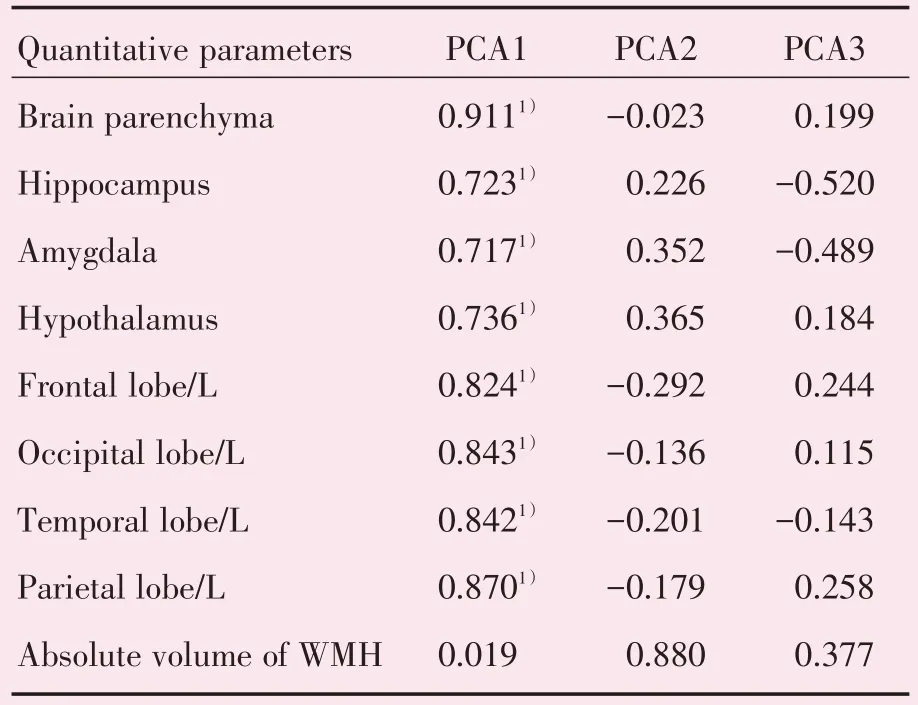
表4 基于AccuBrainTM的定量参数的PCA 筛选后结果Table 4 The result of quantitative parameters based on AccuBrainTM after PCA

图4 PCA 分析后特征值碎石图Fig.4 Scree plot of eigenvalues after PCA
对AccuBrainTM自动生成的所有参数进行单因素分析,然后进行相关性检验去冗余,再采用二元logistic 回归建模,形成杏仁核、WMH 绝对体积和枕叶(左)组成的鉴别模型。
最后将PCA 选取得8 个参数、新建立的鉴别模型与DWMH 2~3 分一同绘制ROC 曲线,具体结果其中鉴别模型效能最佳(AUC=0.809),95%可信区间0.720~0.898。当阈值为0.310 时,约登指数最大,鉴别AD 与VaD 的敏感度为81.1%,特异度为74.3%(表5、图5)。
3 讨论
AD 与VaD 是临床上最常见的痴呆类型,但由于两者的发病机制有明显差异,针对两者的治疗手段和研究方向具有显著差异[4],故准确的鉴别不但会为患者带来更佳的预后,还会提高相关科学研究可信度。目前鉴别两者比较好的手段是脑组织病理检查、基于PET 的分子影像学或脑脊液检查,但由于创伤或经济等原因,我国在临床上更多是依赖Hachinski 缺血评分量表,它虽然也具有较高的准确性[19],但它是一种主观量表,受医生自身医疗水平和患者配合程度的影响,存在一定的局限性。故本研究利用MRI对比AD与VaD的WMH及脑区体积,希望临床准确诊断提供更多的参考依据。
近年来,随着软硬件的技术进步,脑MRI 研究得到了快速的发展,涌现了多种成熟的图像分析软件,诸如FSL、freesurfer、SPM 等软件。但是这些软件都存在着掌握难度较高、操作步骤复杂等问题,不便于放射科或神经科医生在临床上使用,于是全自动分析软件开始出现,AccuBrainTM就是一种可以全自动执行大脑结构的组织分割和定量测量的工具,在之前的研究已验证其有较好的图像分割和分析能力[16]。它操作简单,方便快捷,便于在临床大规模使用,未来前景巨大。本研究利用该软件分析AD 与VaD 的脑部MRI 图像,结果提示AD 患者的颅内总体积、脑实质、脑灰质、脑白质、海马、杏仁核、下丘脑、双侧额叶、枕叶、颞叶、顶叶体积较VaD 患者均缩小,这与既往很多研究成果是一致的[20-22]。AD 是一种以大脑萎缩为主要特征的变性疾病,病变主要发生在与记忆密切相关的结构,诸如内侧颞叶、海马、杏仁核、丘脑等区域;还有研究发现,AD 患者的深部核团不仅出现了体积上的萎缩,同时其在病理学上也发生了改变[23]。大脑结构改变,势必会影响传入冲动与传出冲动支配器的正常运转,导致相应脑区的神经功能下降,进而发生记忆力下降、性格改变、日常生活能力丧失等AD 常见表现[24]。而VaD本质上是一种非变性疾病,其是由一系列脑血管因素导致脑组织损害所引起。脑部发生了血管病变,导致脑组织血流动力学发生改变,继而引起脑部神经传导乃至分子水平的反应,而导致快速的不同程度脑功能下降[25],其痴呆发生机制与AD有显著差异,故不存在明显大脑萎缩。

表5 AD 与VaD 各鉴别指标效能比较Table 5 The comparison of efficiency of identification indexes between AD and VaD

图5 杏仁核、鉴别模型与DWMH Fazekas 评分(2~3)的ROC 曲线Fig.5 ROC curves of amygdala,identification model and DWMH Fazekas score(2~3)
WMH 是脑小血管病一种发生率较高的影像学征象[5],本研究显示,在Fazekas 评分中,AD 与VaD在PVWMH 2~3分和总分3~6分人数比例上无明显差异,但VaD 组发生中重度DWMH(2~3 分)较多,这反映了VaD 组DWMH 较AD 组更严重,与以前国外研究结果是一致的[26]。根据病理和影像研究,Kim 等[27]提出了不同区域WMH 发病机制可能不同,PVWMH 与脑脊液的渗漏密切相关,而DWMH 则由慢性血流动力学(低灌注)引起,而VaD 患者通常存在脑血流动力学的问题,故DWMH 更加严重,除此之外,DWMH 可能还与VaD 患者认知功能下降有关,大量的DWMH 可能导致不同程度的脑神经网络的破坏,进而引起了痴呆症状[26],这也说明涉及到WMH 的研究最好要将DWMH 与PVWMH 分开研究。同时本研究还采用了定量的方式研究WMH,结果发现不管是WMH 绝对体积还是相对体积,VaD 组的体积都明显较大,这与以前国外的研究是一致的[28-29]。虽然本研究中相应Fazekas 评分WMH 总分并没有明显的统计学差异,但总体趋势仍是VaD 患者WMH 较严重,软件定量分析结果与视觉评分量表的结果也较为一致。
研究结果表明MRI 所提供的多项指标都对AD 与VaD 具有一定的鉴别能力。同时我们建立了一个新的预测模型,使得鉴别能力进一步提高(AUC=0.809),但这个模型还有待验证,期待以后的研究可以联合更多地区的更多医院,成为多中心、大样本的研究,提高模型鉴别能力并加以验证,相信未来鉴别模型可以为临床的诊治带来更大更可信的帮助。
本研究局限性:①本研究为回顾性研究,MRI设备缺乏一致性,且MRI 序列采用常规序列,未能采用功能MRI 及3D 扫描技术;②本研究采用的全自动分析软件尚不能将WMH 进行区域划分;③纳入样本量较小。④本研究的AD 或VaD 为临床诊断,缺乏病理金标准。
总之,AD 与VaD 患者在脑区体积和WMH 存在着显著差异,基于这些差异,MRI 的多项指标都展示出了对AD 和VaD 优秀的鉴别能力,相信MRI将会为二者的临床准确诊断提供更多的参考依据。
