基于网络药理学探讨玉屏风散治疗特应性皮炎的作用机制
2020-10-10张丽杨志波
张丽,杨志波
(1.湖南中医药大学研究生院,湖南 长沙 410208;2.湖南中医药大学第二附属医院皮肤科,湖南 长沙 410005)
特应性皮炎(Atopic Dermatitis,AD)是临床上常见的一种皮肤屏障破坏,免疫功能失调的疾病[1],据研究表明AD在发达国家儿童的发病率达到15%~30%[2],发展中国家的患病率也在逐年上升,常好发于婴幼儿时期。目前有许多治疗特应性皮炎的方法,包括支持性护理、外用皮质激素、口服具有镇静止痒作用的抗组胺药物、光疗、系统治疗等,但缺少一种理想的治疗方法。中医药因其简、便、廉、效的优点,逐渐被临床医生广泛应用。其中出自《丹溪心法》的玉屏风散,虽仅由黄芪、白术、防风三味药组成,但在临床上治疗荨麻疹、湿疹、带状疱疹等皮肤疾病疗效佳。周光泽等[3]研究表明玉屏风颗粒联合盐酸西替利嗪治疗AD较单一使用抗组胺药的有效率更高,治疗4周后患者皮损SCORED评分、瘙痒程度评分以及影响睡眠程度积分明显降低。李雪娇[4]应用皮下注射尘螨浸液联合维生素E外用保湿、口服氯雷他定以及玉屏风散颗粒进行临床试验研究,发现特异性免疫治疗联合玉屏风颗粒可显著降低AD的复发率。研究发现玉屏风散之所以对过敏性疾病疗效较好,可能与其具有调节免疫的功能相关。刘文杰等[5]发现玉屏风散治疗脾虚湿蕴的AD患者可有效提高患者的细胞免疫功能,治疗后测得患者血清CD4+、CD4+/CD8+比例较治疗前降低,CD8+数值显著增加。而特应性皮炎与免疫失衡及遗传易感性关系密切,因此我们推测玉屏风散有可治疗特应性皮炎的潜在作用靶点与机制。本文拟通过网络药理学的方式,探讨玉屏风散治疗特应性皮炎的作用机制,为实验及临床提供一定的依据。
1 方法
1.1 筛选玉屏风散的化学成分及靶点
在中药系统药理学数据库分析平台[6](Traditional Chinese Medicine Pharmacology,TCMSP)中筛选玉屏风散(黄芪、白术、防风)的化学成分和相关靶点,筛选条件为生物利用度(Oral bioavailability,OB)>30和类药性(Drug likeness,DL)>0.18筛选出符合以上条件的有效化学成分以及相关靶点。利用Uniprot数据库和美国国家技术信息中心数据库(NCBI)限定物种为“Homo Sapiens”,将之前检索的相关靶点转换成相对应的基因,得到靶点基因名称。
1.2 获取AD的相关靶点
在GeneCards数据库(http://www.genecards.org/)中以“atopic dermatitis”为检索词搜索相关靶点。
1.3 构建PPI网络
在STRING数据库(http://string-db.org/)中输入筛选出的中药作用于AD的靶点名,限定物种为“Homo Sapiens”,设置最低相互作用评分为中等置信度(“high confidence(0.700)”),得到玉屏风散作用于AD的PPI网络(靶蛋白相互作用网络)。
1.4 筛选关键靶点
将STRING数据库中得到的PPI网络导入Cytoscape 3.7.1,使用“Network Analyzer”对PPI网络进行拓扑分析,选取自由度(Degree)、介数(Betweenness)、中心性(Closeness)大于平均值的靶点为关键靶点,进一步分析其药理作用。
1.5 GO功能分析
在cytoscaope软件中使用插件cluego,选择Functional Analysis,限定物种为“Homo Sapiens”,选择Celluar component、Biological process、Molecular function,设定仅显示P-Value值<0.05。
1.6 KEGG通路富集分析
在DAVID 6.8数据库(https://david.ncifcrf.gov/)导入玉屏风散与AD的交集基因,输入靶基因名称,限定物种为“Homo Sapiens”,将靶基因名修正为官方名称,进行KEGG通路富集分析,在统计计算R项目运行clusterProfiler代码[7],得到KEGG富集结果。
2 结果
2.1 玉屏风散化合物和靶点的筛选
在TCMSP中分别输入黄芪、白术、防风,限定OB>30,DL>0.18的条件后,得到化合物共46个,具体见表1,逐一在uniprot对应后得到305个靶点。
2.2 AD的相关靶点
从GeneCards数据库中检索到1 210个相关靶点基因。
2.3 网络构建及分析结果
将305个化合物靶点与1 210个AD相关靶点基因进行映射,得到47个共同靶点基因,对应玉屏风散中24个候选化合物。其中黄芪对应12个,防风11个,白术1个,见表1。
2.4 PPI网络构建
将映射的得到的47个交集靶点导入STRING数据库进行PPI网络分析(图1)。网络中发生蛋白相互作用的靶点有47个(2个靶点未发生蛋白相互作用),见图1。在cytoscape上进行拓扑后,得出PPI网络中各节点的平均自由度为15.617,平均介数为0.016,平均中心度数0.589,自由度、介数、中心度超过平均值的有16个,具体见表2。推测这些靶点是玉屏风散治疗AD的关键靶点。
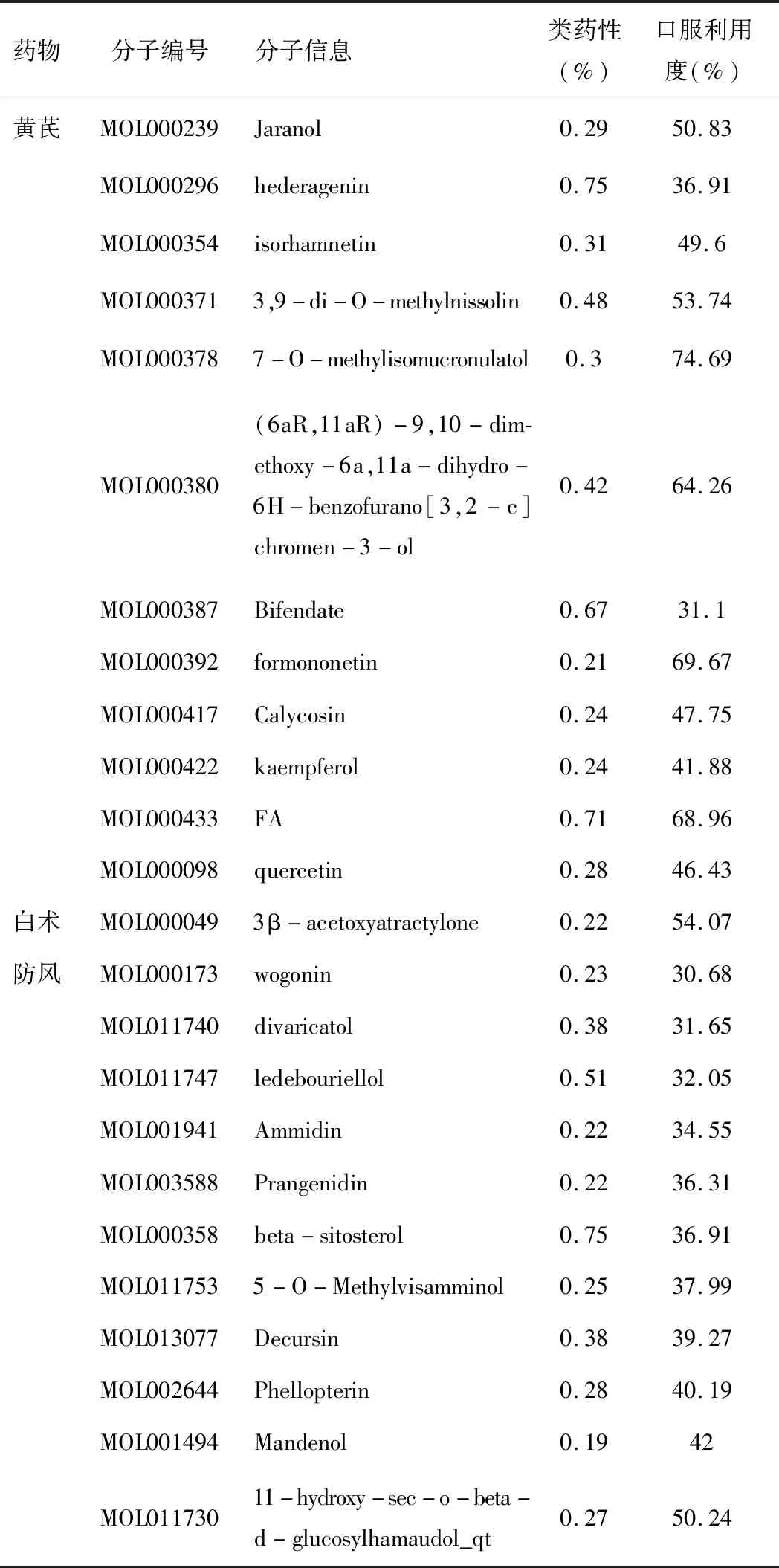
表1 玉屏风散中筛选后化合物成分
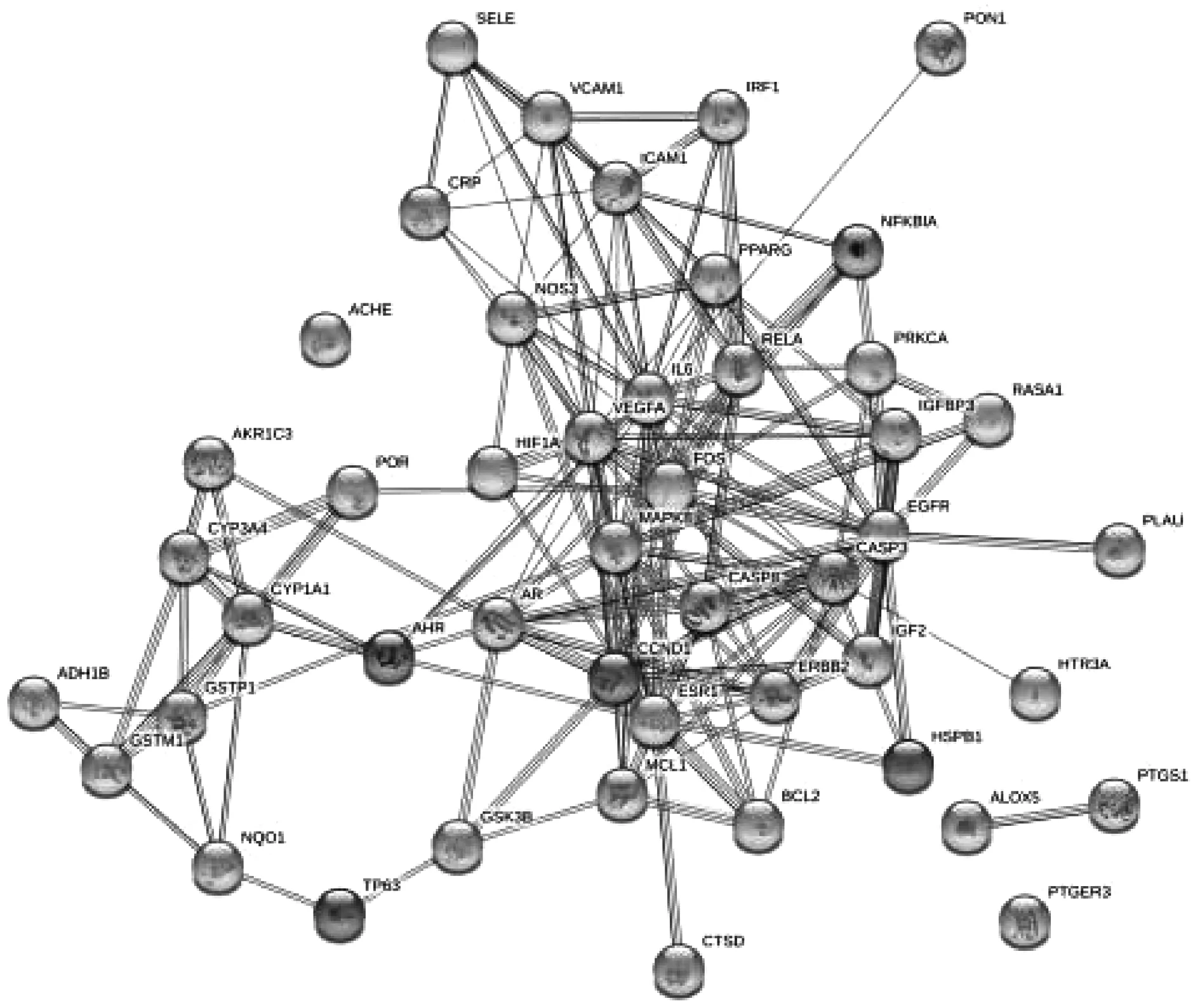
图1 玉屏风散治疗AD靶蛋白PPI网络图
2.5 GO功能分析
47个药物-疾病交集基因影响了240个生物学过程(P<0.01),选取P值排名前20的功能信息,见表3。结果显示玉屏风散活性成分主要富集在氧化还原过程,信号转导,RNA聚合酶II启动子的转录,细胞对乙醇、营养、脂多糖的反应,细胞增殖,细胞对氨基酸、雌二醇、药物、寒冷的反应等。在分子功能方面,牵涉到蛋白质结合、酶结合、转录因子结合、泛素蛋白连接酶结合、蛋白质异二聚化活性、蛋白激酶结合、氧化还原酶核心、DNA结合、氧结合等。在细胞组成方面,主要存在细胞质、细胞膜、质膜、线粒体、细胞外空间、核质、细胞外外泌体、细胞质的核周区域等。

表2 玉屏风散关键靶点的基本信息
2.6 KEGG富集通路分析结果
通过David数据库中的KEGG通路富集分析发现,该47个靶点显著富集在113调通路上(P<0.05),其中前20条主要通路包括,AGE-RAGE信号通路、流体剪切应力和动脉粥样硬化、TNF信号通路、前列腺癌、卡波西肉瘤相关疱疹病毒感染、麻疹、HIF-1信号通路、人巨细胞病毒感染、IL-17信号通路、Toll样受体、细胞凋亡、催乳素信号通路、癌症中的蛋白多糖、乙型肝炎、EGFR酪氨酸激酶抑制剂耐药、PI3K-Akt信号通路、结直肠癌、MAPK信号通路、松弛素信号通路、内分泌抵抗、EB病毒感染。具体见表4。
3 讨论
AD是一种的慢性炎症性皮肤病。本病主要以长期的皮肤瘙痒、红斑伴有苔癣样变为特征。由于长期的瘙痒严重影响患者的生活及睡眠质量,Kaaz K等评估了10名AD及银屑病患者后发现AD患者的PSQI总分为(8.3±4.2)分,银屑病患者的PSQI总分(8.1±4.8)分,AD患者的瘙痒程度较银屑病患者更重[8]。目前对AD并无可取得满意疗效特殊治疗的方法。而中药具有多成分、多靶点的特点,其作用机制也更为复杂。本研究中主要借助网络药理学方法以及各大数据库,探讨了玉屏风散对AD的作用机制的预测研究。结果表明,玉屏风散和AD的交集基因共47个。差异基因富集的生物学功能、途径以及细胞定位主要涉及蛋白质结合、酶结合、转录因子结合、蛋白质异二聚化活性、氧化还原酶活性、蛋白复合物的集合、蛋白磷酸酶结合等分子功能。主要参与的生物过程有氧化还原过程、Fc-epsilon受体信号穿袄途径、信号转导、异生素代谢过程、对脂多糖、氨基酸以及雌二醇和药物的反应、细胞增殖、凋亡过程的负调节、脂质代谢过程等。
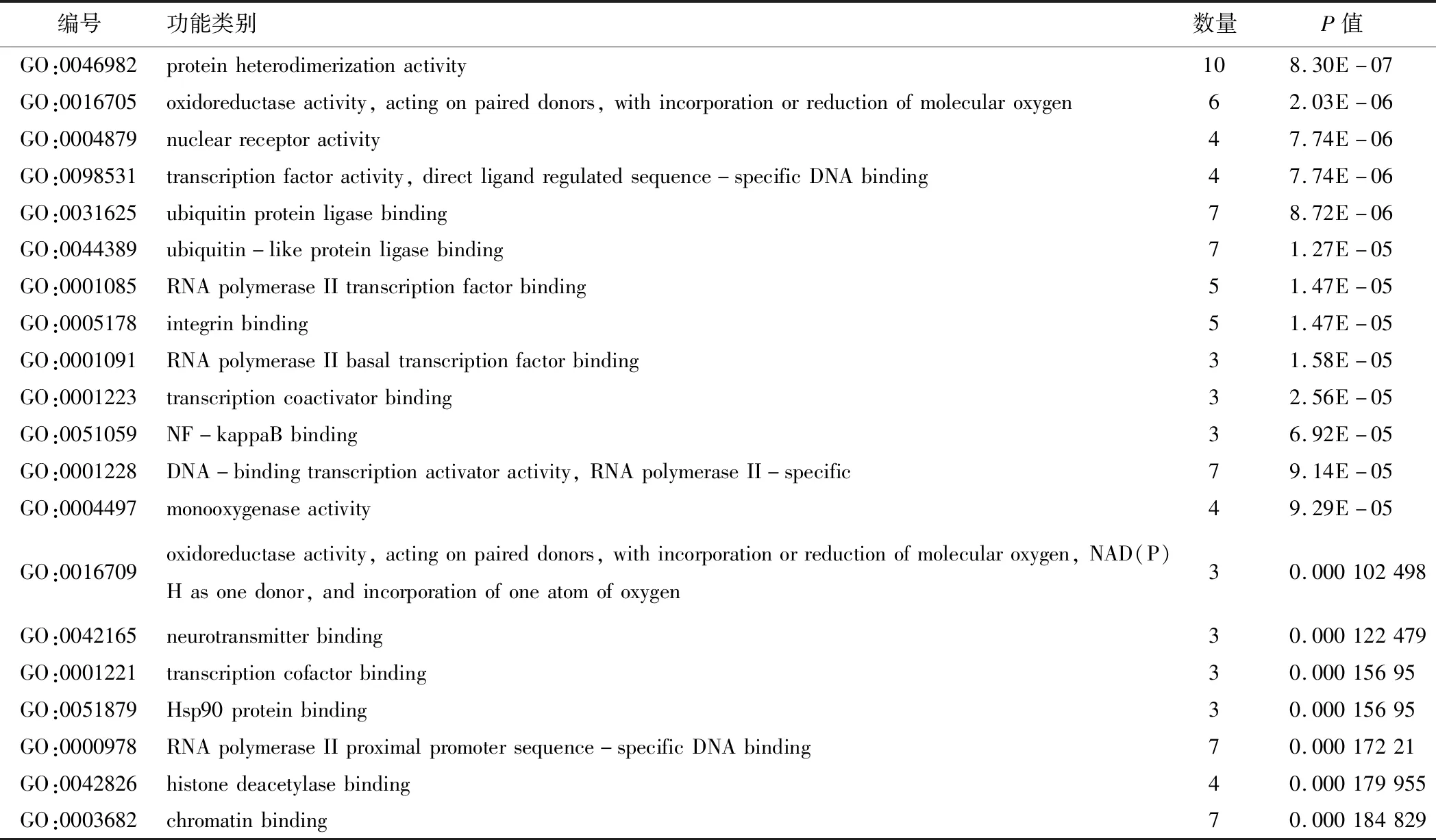
表3 药物-疾病交集基因的GO富集功能信息

表4 药物-疾病交集基因的KEGG富集功能信息
KEGG富集通路分析表明20条通路与AD发病显著相关,目前研究较为丰富的主要是肿瘤坏死因子(TNF)信号通路、IL-17信号通路、磷酸肌醇3激酶(PI3k-Akt)信号通路以及TH17细胞的分化、Toll样受体(Toll like receptors,TLRs)信号通路。近期研究表明,AD的发病与遗传、皮肤屏障功能受损、免疫的失衡以及微生物的定植关系密切,其中免疫反应失常有至关重要的作用。Th17细胞作为CD4+T细胞亚群可以分泌白介素-17、IL-17F、IL-21等细胞因子[9],IL-17F、IL-21被证明在自身免疫和组织炎症中具有关键作用。这些细胞因子可以促进细胞存活和增殖,从而促进包括皮肤组织再生[10]。IL-17,是在AD患者发炎部位常见的高水平细胞因子,在皮肤疾病当中可以诱导黏附分子和趋化因子的表达,支持细胞渗透到皮肤,从而加重炎症反应和组织破坏[11]。任小丽等[12]运用ELISA测定轻中度AD患者外周血TH17细胞比例、IL-17以及IL-17F时发现病情重的患者外周血TH17细胞比例较轻中度患者水平高,提示IL-17与TH17细胞在AD的发病中有重要影响。TNF-α是关键的促炎因子,参与细胞运动、细胞周期以及细胞凋亡等各个阶段,与角质形成细胞分泌的因子构成促进炎症的细胞因子网络,调控以AD为代表的炎症性皮肤病的发生[13]。PI3k/Akt信号通路是由膜受体酪氨酸酶激活启动的,参与多种生物学过程,调控细胞凋亡、免疫T细胞的增殖与活化,常在不同癌症中异常激活[14],魏明等[15]对38例AD患者进行T细胞PI3k和Akt活性的监测,试验组新鲜分离出的外周T细胞PI3k和Akt的活性明显高于对照组,提示AD患者外周血T细胞存在PI3k/Akt活化异常,患者的外周血中存在激活该通路的细胞因子。TLRs信号通路是人类模式识别受体家族中最具特征性的成员,可识别检测多种病原体相关的分子模式[16],可激活相关信号通路,激发免疫细胞发生免疫反应,诱导皮肤炎症,树突状细胞的成熟,以及通过激活Th1或Th17细胞来发展抗菌防御。TLR-2和TLR-4信号中的缺陷可能促进Th2反应,从而导致AD发展。Antiga E等[17]研究发现经过他克莫司或氢化可的松治疗的AD患者,TLR-1高表达,TLR-2低表达。AD患者外周血可发生TLRs的表达异常。TLRs基因多态性与AD的发病与病情的发展存在相关关系[18]。
玉屏风散是传统医学中的经典方剂,由黄芪、防风、白术、甘草四味药物组成,是补气固表的代表方剂。现代研究表明玉屏风散中以芒柄花素[19]、升麻素苷、毛蕊异黄酮苷、升麻素、补骨脂素等成分为主[20],有抗菌、调节免疫以及抗感染的作用,现广泛运用于治疗过敏性疾病以及呼吸系统疾病。刘文杰[21]研究发现玉屏风散治疗婴儿期AD患者效果显著。姚露等[22]通过研究玉屏风散的主要有效成分对小鼠AD模型中的炎症小体的表达,发现芒柄花素可有效抑制MC903诱导的AD小鼠模型中NLRP3和IL-33的表达,从而对玉屏风散对治疗AD的细胞分子学以及信号通路进行了初步的实验探讨。本研究则通过网络药理学的研究方式,对中医经典方剂玉屏风散治疗AD进行了作用机制的预测,以及从细胞分子层面初步分析了玉屏风散治疗AD的依据。接下来会依据此研究行进一步临床及细胞实验研究,研究玉屏风散治疗AD的多通路以及多靶点的机制,争取对临床使用玉屏风散治疗AD提供明确的科学依据。
