具有抗细菌黏附和杀菌双重功能的(HA/CHI-Van)5涂层的制备
2020-10-10廖鑫黄义星
廖鑫,黄义星
(温州医科大学附属第二医院育英儿童医院 骨科,浙江 温州 325027)
内植入物感染是骨科的严重并发症之一,给患者和社会带来了严重的负担。据报道,在美国每年因植入物感染导致死亡的人数高达5.5万,用于治疗植入物感染的费用超过一千万美元[1]。传统的临床治疗方法为全身应用抗生素。全身用药时,可能会因病灶处血液循环障碍和瘢痕组织的影响导致患处的抗生素浓度无法达到有效水平,从而影响抗感染效果,还会带来严重的全身不良反应。而且,细菌会产生表型改变和代谢,从而对抗生素产生抵抗。本研究采用层层自组装的技术制备(HA/CHIVan)5多层膜结构,用于预防骨科内植入物感染的发生。
1 材料和方法
1.1 材料
1.1.1 实验材料和试剂:透明质酸(hyaluronic acid,HA)购自济南福瑞达生物化工有限公司;壳聚糖(chitosan,CHI)购自上海阿拉丁工业公司;万古霉素(Vancomycin,Van)、LB肉汤购自大连美伦生物技术有限公司;苏木素伊红染色液、PBS缓冲液、硅片、无水乙醇、聚乙烯亚胺(polyethyleneimine,PEI)购自上海碧云天生物技术有限公司;血平板购自广州环凯微生物科技有限公司;24孔板细胞爬片购自上海联硕生物科技有限公司;金黄色葡萄球菌、大肠杆菌购自上海艾研生物科技有限公司;Live/Dead试剂盒购自美国Thermo公司;SD大鼠购自温州医科大学实验动物中心,动物许可证号:SYXK(浙)2019-0009;克氏针购自上海开为医药科技有限公司;EDTA脱钙液购自北京索莱宝生物科技有限公司。
1.1.2 实验仪器:zeta电位仪购自英国马尔文仪器有限公司;SW-CJ医用型超净工作台、孵箱、倒置荧光显微镜购自上海跃进医疗器械公司;扫描电镜(SEM)购自天美(中国)科学仪器有限公司;医用诊断X光机购自北京普朗新技术有限公司;小动物活体microCT影像系统购自上海珀金埃尔默企业管理有限公司;硬组织切片机购自西安蓝茗医疗科技有限公司。
1.2 方法
1.2.1 多层膜的制备:将PEI溶解在去离子水中,并搅拌过夜至2 mg/mL的浓度。制备浓度为0.005 mol/L 的醋酸溶液,并且将HA溶解于上述溶液中至终浓度为1 mg/mL。用相同的方法制备相同浓度的CHI溶液。然后,将Van溶解在上述CHI溶液中,搅拌过夜至终浓度为1 mg/mL(CHI-Van)。将基材(硅片、24孔板玻璃片、克氏针)放入250 mL烧杯中并加入100 mL无水乙醇,超声处理10 min后,用去离子水清洗,以此为一个循环,反复清洗3遍后用高纯氮将洗净的基材吹干。将洗净的基材放入提前配制的2 mg/mL 聚乙烯亚胺溶液中浸泡2 h后取出,用高纯氮吹干,使基材的表面带有稳定的正电荷。然后将它们浸入HA溶液中15 min,随后用乙酸缓冲液漂洗,漂洗后氮气吹干。然后根据不同的组装目的,将上述材料浸泡在CHI或CHI-Van溶液中15 min,然后进行相同的漂洗和干燥程序,以此为一个双层。重复该组装过程,最后获得(HA/CHI)n和(HA/CHI-Van)n(n代表组成的双层数)多层膜结构。
1.2.2 zeta电位的测定:取ps悬浊液1 mL置于 1.5 mL离心管中,离心机8 000 r/min下离心5 min,去除上清液,加入1 mL PEI,常温下反应15 min,吹打混匀,吸取100 μL加入1 mL PBS中测量zeta电位,将离心管内剩余悬浊液离心机8 000 r/min下离心5 min,去除上清液,加入1 mL HA,常温下反应15 min,吹打混匀,吸取100 μL加入1 mL PBS中测量zeta电位,标记为(HA/CHI-Van)0.5。将离心管内剩余悬浊液离心机8 000 r/min下离心5 min,去除上清液,加入1 mL CHI-Van,常温下反应15 min,吹打混匀,吸取100 μL加入1 mL PBS中测量zeta电位,记为(HA/CHI-Van)1。以此类推,连续测量5双层,记录数据。
1.2.3 活细菌染色实验:实验中使用LIVE/DEAD BacLight细菌活力试剂盒测定细菌活力。其中SYTO9能对具有完整细胞膜的活细菌进行染色,形成绿色荧光。该实验分成空白组和(HA/CHI)5组,取无菌24孔板细胞培养板,空白组放入未修饰空白玻璃片,(HA/CHI)5组放入经(HA/CHI)5多层膜修饰的玻璃片,每组设置5个平行样本,并做好标记。每孔中加入1 mL金黄色葡萄球菌(102CFU/mL,LB肉汤稀释),将24孔板放入37 ℃恒温孵箱中培养5 h。取出配制好的混合染料在室温下解冻并打开荧光显微镜预热30 min。取出24孔板,将细菌液吸出,加入500 μL超纯水,轻轻摇晃,反复清洗3次。加入200 μL配制的混合染料,避光培养15 min后,吸出染料,再用超纯水清洗3遍,最后在避光条件下在荧光显微镜下观察。将金黄色葡萄球菌换成大肠杆菌,实验条件不变,重复上述实验步骤。
1.2.4 越狱实验:将24 孔板玻璃片分成空白组、(HA/CHI)5组和(HA/CHI-Van)5组。空白组放入未修饰空白玻璃片,(HA/CHI)5组放入经(HA/CHI)5多层膜修饰的玻璃片,(HA/CHI-Van)5组放入经(HA/CHIVan)5多层膜修饰的玻璃片。收集对数生长阶段的新鲜金黄色葡萄球菌(浓度108CFU/mL)。将各组玻璃片分别置于琼脂平板中间,吸取20 μL上述浓度菌液滴于玻璃片中间,37 ℃培养48 h,观察细菌生长状况。实验条件不变,用大肠杆菌重复上述实 验。
1.2.5 金黄色葡萄球菌的场发射扫描电子显微镜(FE-SEM):准备未修饰空白硅片、(HA/CHI)5和 (HA/CHI-Van)5多层膜修饰的硅片各3片,分组如上。分别浸入1 mL金黄色葡萄球菌(102CFU/mL,LB肉汤稀释)悬浮液中,并在37 ℃下孵育8 h以使细菌生长,将样品用无菌0.9%氯化钠溶液洗涤3次以除去未附着的细菌,然后用2.5%戊二醛固定12 h,通过一系列分级乙醇溶液(50%、70%、90%、100%)脱水,时间分别为2、1、1、2 h。将所有样品烘干后,使用FE-SEM观察。
1.2.6 动物造模:本实验所用SD大鼠是由温州医科大学实验动物中心提供,均为雄鼠,健康状况良好,2月龄,体质量(200±20)g。适应性饲养结束后,选择精神状态好,体质量接近的大鼠,随机分成3组,每组8只,水合氯醛麻醉后,用剃须刀剃毛,碘伏消毒,手术暴露胫骨平台,在此过程中尽可能保留重要神经、血管、韧带组织。用0.8 mm克氏钻头垂直钻入髓腔,钻孔与胫骨平台垂直,用无菌注射器吸出少量骨髓。将克氏针放入钻孔内,分为空白组、(HA/CHI-Van)5组、假手术组,前2组从钻孔中注射10 μL金黄色葡萄球菌,假手术组不注射细菌,空白组和假手术组都采用没有涂层的克氏针, (HA/CHI-Van)5组采用表面有(HA/CHI-Van)5多层膜修饰的克氏针。然后用骨蜡封闭钻孔,逐层缝合,手术全过程注意无菌操作。待大鼠苏醒后,隔离饲养,给予充足饲料和水,保持饲养环境干燥,每天观察。
1.2.7 大鼠伤口观察和骨髓腔细菌检查:手术6周后处死所有大鼠,剪开伤口皮肤,详细检查创口情况,然后打开左下肢胫骨骨髓腔,用无菌注射器吸取少量骨髓液混合物,用LB肉汤进行培养,培养 24 h后在血平板培养基上涂板培养。
1.2.8 X线检查和评分:处死后马上取大鼠大腿进行X光片检查,设置条件:电压45 kV,电流250 mA, 曝光时间0.2 s。主要观察大鼠大腿骨质破坏,溶骨和周围组织情况。接着我们邀请了3位骨科副主任医师对X线检查结果进行评估。根据胫骨感染的X射影像学检查,评估了胫骨感染的严重程度[2]。评价区域:胫骨平台和胫骨干。
1.2.9 CT检查:X光片检查结束后,剔除骨上附着的软组织,立刻进行CT检查。我们将距离克氏针表面半径为0.1 mm的环作为感兴趣区(VOL)。分析左胫骨干髓端骨块骨密度(bone mineral density,BMD)、骨小梁数量(Tb.N)、骨体积分数(BV/TV),并根据内置软件作出3D图和柱状图。
1.2.10 骨组织HE染色:处死大鼠后,取其左胫骨干髓端病变骨块,用4%多聚甲醛溶液固定48 h,随后用EDTA脱钙液进行脱钙,脱钙完成后,进行乙醇梯度脱水,二甲苯透明,软蜡浸泡1.5 h,硬蜡浸泡1.5 h,包埋机包埋,完成石蜡块。将蜡块进行组织切片并用HE染色。
1.3 统计学处理方法 采用SPSS24.0软件进行数据处理。计量资料以±s表示,多组比较用单采因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 PBS中各组装过程的zeta电位变化 当组装第一层HA后,测得的电位为(-3.12±0.56)mV。继续进行CHI-Van组装后,电位变为(40.67±0.69)mV。观察可见,随着组装过程的进行,每次组装单层溶液后,测得的电位发生正负交替变化。见图1。
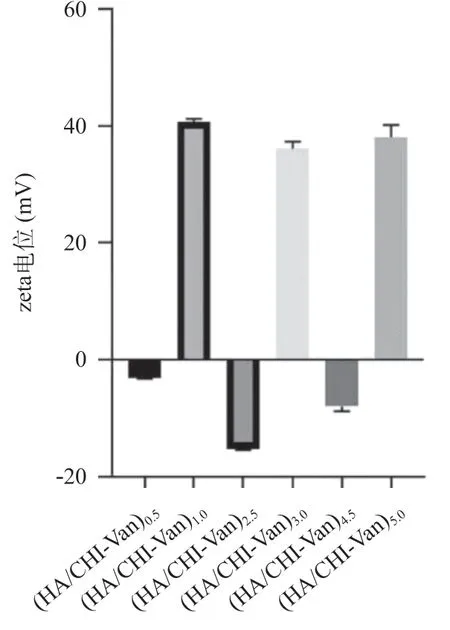
图1 在PBS溶液中不同组装层数时的zeta电位
2.2 活细菌染色结果 结果显示分别与金黄色葡萄球菌和大肠杆菌菌液接触培养5 h后,空白组玻璃片表面均可以观察到大量带有绿色荧光的活细菌,但是(HA/CHI)5组玻璃片表面显示绿色荧光的活细菌很少。见图2。
2.3 金黄色葡萄球菌的越狱实验和扫描电镜结果 培养4 d后,越狱实验显示空白组玻璃片上的金黄色葡萄球菌大部分突破到环外,形成较大面积的菌落。(HA/CHI)5组的金黄色葡萄球菌也有部分突破到环外,形成较大面积的菌落,而由于万古霉素对革兰氏阳性菌具有强烈的杀菌作用,(HA/CHI-Van)5组的细菌在玻璃片中间被杀死,不能突破到环外。扫描电镜结果显示分别与金黄色葡萄球菌接触培养8 h后,在空白组硅片表面和(HA/CHI)5组硅片均可以观察到大量形状为圆形的活细菌,但是(HA/CHIVan)5组硅片表面细菌却很少。见图3。

图2 活细菌染色的荧光显微镜图像(×20)

图3 金黄色葡萄球菌的越狱实验(a-c)和扫描电镜结果(d-f,×4 000)
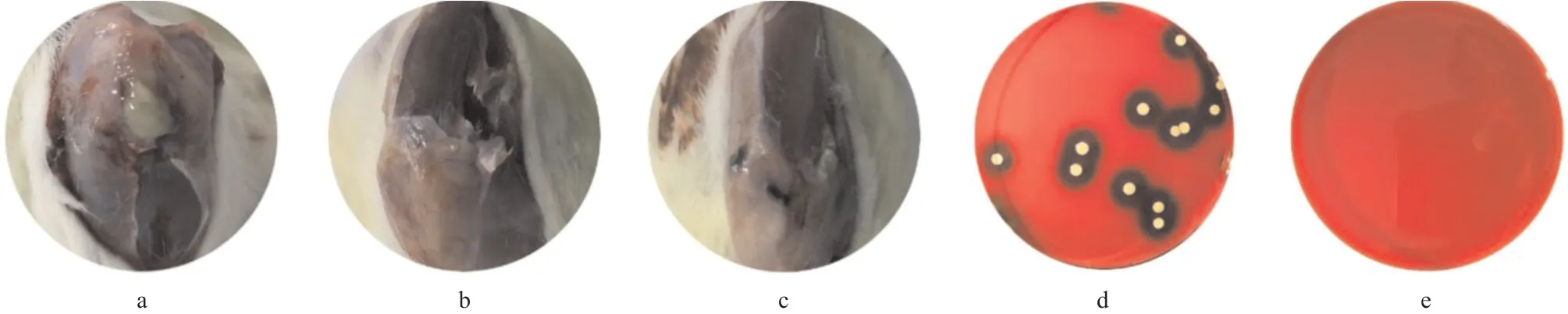
图4 大鼠伤口观察(a-c)及骨髓腔细菌检查(d-e)
2.4 大鼠伤口观察和骨髓腔细菌检查 空白组伤口有黄白色的脓液溢出,表明细菌繁殖并且无法控制。(HA/CHI-Van)5组的伤口愈合良好,无化脓,无异常流液,与假手术组相似。扩增骨髓液并在血平板培养基上培养后,我们发现空白组中出现了大量细菌,而且单个菌落呈金黄色,大而凸,圆形且不透明,表面光滑,周围有溶血环。这特异性证明伤口表面的细菌是金黄色葡萄球菌。但是在(HA/CHIVan)5组中,无法培养出细菌。假手术组未注射细 菌,因此未进行细菌检查。见图4。
2.5 X线检查和评分 从X线片检查结果可以看出,空白组的胫骨平台显示不清,骨质破坏严重,出现溶骨性病变。假手术组显示出正常的骨形态, (HA/CHI-Van)5组未能发现骨病变情况。为了量化骨感染的程度,遵循骨感染放射学评估系统,计算后可以发现空白组的得分为12.30±0.86, (HA/CHI-Van)5组的得分为0.70±0.47,假手术组的得分为0.30±0.47。X线得分越低,说明骨形态越好。(HA/CHI-Van)5组X线得分方面优于空白组(P<0.05),且非常接近假手术组(P>0.05)。见图5。

图5 X线检查结果
2.6 CT检查 我们进一步使用Micro-CT对植入6周后获得的骨标本进行成像评估(见图6d-f),并基于内置软件制作了3D图(见图6a-c)。空白组中的大鼠桥接和再生的速度最慢,图中的黄色部分代表新骨骼,6周后仅形成少量新骨骼。同样,这组骨小梁微结构也最稀疏。假手术组新骨再生良好,并显示出良好的骨小梁微结构,(HA/CHI-Van)5组也表现良好。接着我们对各项数据进行定量分析,空白组的BMD数值为(0.012±0.008)g/cm3,(HA/CHI-Van)5组为(0.047±0.004)g/cm3,假手术组为(0.058± 0.017)g/cm3。空白组的骨小梁数量为(1.238± 0.088)mm-1,(HA/CHI-Van)5组为(1.490±0.135)mm-1, 假手术组为(1.495±0.117)mm-1。空白组的骨体积分数为(20.082±1.236)%,(HA/CHI-Van)5组为(31.188±2.216)%,假手术组为(31.955±4.513)%。(HA/CHI-Van)5组在BMD、骨小梁数量和骨体积分数方面均优于空白组(均P<0.05),并且非常接近假手术组(均P>0.05)。见图6。
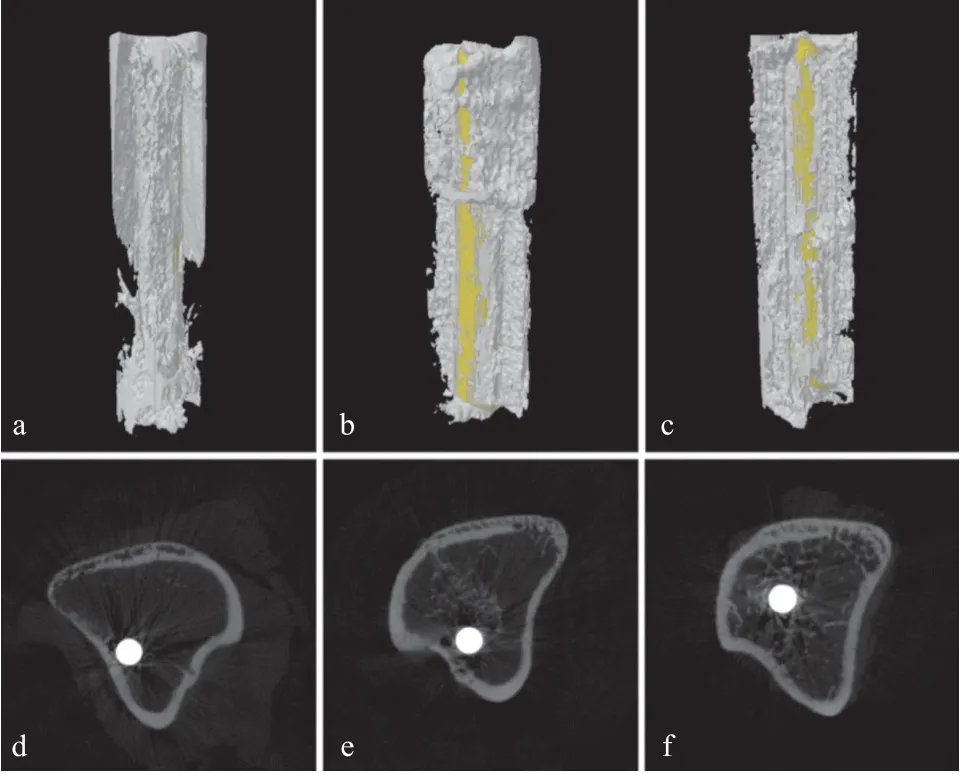
图6 克氏针周围新骨形成情况
2.7 骨组织HE染色 空白组的骨组织受到严重感染,形成脓肿,骨小梁形态消失,大多数骨髓细胞广泛坏死,炎性细胞核染成黑色,并且炎性细胞广泛分布。(HA/CHI-Van)5组和假手术组的骨组织结构正常,炎症细胞不明显,骨小梁清晰可见。见图7。

图7 骨组织HE染色(×200)
3 讨论
随着社会的发展和交通运输的增加,由高能暴力(如车祸和机械设备)引起的四肢骨折越来越多。临床上,通常使用外固定或内固定治疗。外固定支架不易操作,患者佩戴不舒服,价格昂贵,更重要的是,它容易造成骨折畸形,使用骨内植入物则没有这种问题。然而,内植入物感染是骨科手术失败的重要原因,这增加了患者的经济负担并在严重情况下导致残疾。尽管采取了预防植入物感染的措施,但仍有大约5%~10%的内植入物患者被感染[2-5]。 在临床治疗中,尽管使用了延迟手术和长期的抗生素治疗,但古斯蒂洛-安德森(Gustilo-Anderson)III型骨折的感染率仍然很高,甚至达到52%,而且当再次植入骨植入物时,这些残留的细菌会在植入物的表面上繁殖,从而导致感染的复发[6]。
研究人员首先探讨了植入物感染的原因。在内部植入物材料的表面张力和静电作用下,细菌黏附并在植入物表面繁殖[7]。附着在植入物表面的细菌开始分泌细胞外基质和分裂增生[8]。针对上述骨植入物感染的原因,研究人员在骨科抗菌涂层的改性方面取得了两个方面的重大进展:①植入物的表面装有抑菌物质涂层以抑制粘连植入物表面的细菌污染,也称为被动抑菌;②在骨植入物的表面上修饰杀菌材料涂层,当细菌与植入物的表面接触时直接杀死细菌,这也称为主动杀菌[9-11]。这为实验设计提供了一个思路,可以制备出具有抗细菌黏附和杀菌功能的多层膜结构。
层层自组装技术于20世纪90年代初期被正式提出[12]。层层自组装技术通过改变自组装多层膜的层数和聚电解质的类型,可以容易地控制多层膜的物理和化学性质。各种生物分子(如蛋白质、酶、药物和纳米颗粒)可以一层一层地沉积而不会失去其生物学功能[13]。目前,它们已被用于调节细菌黏附,制造阳离子涂料等,层层自组装技术的应用前景在医用领域方面非常广阔。骨科感染最常见的细菌是金黄色葡萄球菌[14],万古霉素是一种糖肽抗菌剂,对侵袭性的革兰氏阳性细菌有很强的作用,被认为是治疗金黄色葡萄球菌的首选药物。CHI是生物学上仅次于蛋白质胶原的最重要的动物结构材料,其独特的化学结构,活性羟基和氨基形成具有高电子密度的线性聚电解质链,使其表面带正电并能够吸引阴离子聚集体。CHI可以以1%的质量分数溶于乙酸溶液中,它具有良好的生物相容性,没有毒性和不良反应,可以在体内被生物降解[15-16]。研究表明,带正电的CHI分子与带负电的微生物细胞膜之间的相互作用导致细胞膜的破坏,最终有助于杀菌作用[16]。CHI由于其固有的抗菌特性已被用作预防感染的抗菌剂。然而,在骨组织工程中,单独使用CHI作为骨移植材料并不罕见,主要是将CHI复合到其他材料中起特定作用,例如复合支架材料形式,载体形式,涂层形式等[17]。HA是一种线性大分子黏多糖,广泛分布于人和动物中,具有广泛的临床疗效。例如,在关节疾病的治疗中,可以添加HA以恢复滑液的润滑功能并促进关节修复[18]。因此,该实验使用可靠的材料来制备多层膜,以避免不良反应。
本研究通过层层自组装方法制备(HA/CHI-Van)n多层膜结构。首先,通过物理吸附技术使基材表面胺化,然后使用带负电的HA和带正电的CHI-Van之间的静电相互作用来制备(HA/CHI-Van)n杂化涂层。由于HA溶液本身具有负电荷,CHI溶液具有正电荷,随着组装过程的进行,每次应用单层时,测得的电位正负交替变化,这表明通过静电相互作用成功完成了聚合物层的组装。而且该合成方法简便易行,可实现批量生产。
本研究采用活细菌染色实验,证明在没有抗生素的情况下,CHI对大肠杆菌和金黄色葡萄球菌都具有一定的抗黏附作用,这是因为CHI可与细菌细胞膜发生相互反应而导致细菌溶解死亡。越狱实验和FE-SEM实验证明,当细菌浓度较大时,(HA/CHIVan)n多层膜结构对金黄色葡萄球菌依然具有良好的杀菌作用。本研究还进行了大量的动物实验来检验(HA/CHI-Van)n多层膜的抗菌性能。X线影像学检查发现,空白组胫骨平台处出现骨质溶解,出现严重的骨膜反应。有意思的是,(HA/CHI-Van)n组的骨形态完好,没有发现病变,而且非常接近假手术组。本研究又进行了CT检查。BMD是骨质量的一个重要标志,反映骨质疏松程度,预测骨折危险性的重要依据。骨小梁数量用于描述骨小梁结构形态,解释骨量变化,其变化可影响骨量,在宽度一定的条件下,数量越多,骨量越多。骨体积分数表示骨组织体积与组织体积比值,可直接反映骨量多少。通过检测我们发现(HA/CHI-Van)n组的上述数据均优于空白组,而研究表明骨骼再生需要更严格的无菌条件,并且细菌定植会严重阻碍骨骼再生过程[19],证明(HA/CHI-Van)n组具有良好的抗感染效果,而接近假手术组则说明(HA/CHI-Van)n多层膜结构具有良好的生物相容性。各组骨组织切片结果也符合上述规律。因此,该多层膜结构兼有抗细菌黏附和杀菌的功能,同时具有良好的生物相容性,是一种很有潜力的预防骨植入物感染医用材料。
