定量分析钆塞酸二钠增强MRI预测肝纤维化和肝硬化病理分级
2020-10-10童洪飞王兆洪陈辉周斌倪仲琳
童洪飞,王兆洪,陈辉,周斌,倪仲琳
(温州医科大学附属第二医院育英儿童医院 肝胆外科,浙江 温州 325027)
目前临床上主要运用肝穿刺活检来精确评估肝纤维化和肝硬化,其标准是肝硬化病理分级的Laennec分级系统,该系统是KIM等[1]在Metavir分级系统的基础上提出的。有创的肝穿刺活检标本的病理检查是该半定量分级系统的基础。肝穿刺活检存在一定的风险,且穿刺部位单一,不能代表全肝的情况,因此对于肝纤维化和肝硬化程度的精准评估而言,寻找一种无创且精确的检查方法来替代肝穿刺活检显得更为重要。
钆塞酸二钠(gadolinium ethoxybenzyl diethylenetriaminepentaacetic acid,Gd-EOBDTPA)是一种新型的MRI对比剂,可被正常肝细胞特异性摄取。肝脏在Gd-EOB-DTPA增强MRI扫描的肝胆特异期表现为不均匀强化,肝脏功能障碍的程度与强化的差异相关[2]。因此有研究认为肝细胞的功能及密度、肝硬化的程度与肝脏Gd-EOB-DTPA增强MRI扫描的肝胆特异期的信号强度相关[3]。本研究通过定量分析Gd-EOB-DTPA增强MRI肝胆特异期信号强度来评估肝纤维化和肝硬化的病理分级,以期Gd-EOBDTPA增强MRI扫描能成为评估和预测肝纤维化和肝硬化的分析方法和有效无创工具,进而在临床上能取代肝组织穿刺活检。
1 资料和方法
1.1 资料
1.1.1 一般资料:选取温州医科大学附属第二医院育英儿童医院从2014年1月至2018年12月行不规则或规则肝部分切除术的患者,Gd-EOB-DTPA增强MRI扫描均在围手术期准备阶段实施。对于本身会影响肝细胞的功能状态的疾病以及可能会导致肝癌病灶周围的肝脏组织受到影响的治疗病史的患者均予以排除。总共入选55例患者,对照组10例,男6例,女4例,年龄(50.7±12.0)岁,其肝脏组织无肝纤维化和肝硬化;肝纤维化组10例,男7例,女3例,年龄(51.3±12.9)岁,其肝脏病灶周围肝脏组织为肝纤维化;肝硬化组为35例,男25例,女10例,年龄(54.8±9.0)岁,Child-Pugh分级A级和B级分别为21例和14例,其肝脏病灶周围组织为肝硬化。本研究获得本院医学伦理委员会的批准。
1.1.2 仪器和试剂:磁共振仪(Philips Achieva 3.0,荷兰Philips公司);组织包埋机(BMJ-B型包埋机,常州中威电子仪器有限公司);全封闭组织脱水机(泰州樱花医疗科技有限公司);全自动染片机(Varistain Gemini,美国赛默飞世尔科技公司);显微镜(奥林巴斯CX23,日本奥林巴斯公司)。MRI造影剂:Gd-EOB-DTPA注射液,德国拜耳先灵制药公司。
1.2 方法
1.2.1 Gd-EOB-DTPA增强MRI扫描:采用飞利浦3.0T磁共振仪,所有55例患者的扫描参数均相同,Gd-EOB-DTPA作为磁共振增强扫描剂。在术前3~15(8.0±2.4)d,肝脏病灶周边肝脏组织信号强度情况通过Gd-EOB-DTPA增强MRI扫描来获取和测算。具体扫描参数如下:脂肪抑制3D SPGR T1WI扫描:TR/TE:3.0~10.0 ms/1.0~2.0 ms,翻转角10°~ 15°,层厚:4 mm,矩阵:192×256,视野:420 mm× 420 mm;T1WI扫描TR/TE:3.0~10.0 ms/1.0~ 2.0 ms,翻转角10°~15°,层厚:4 mm,矩阵:192× 256,视野:420 mm×420 mm;平扫后,以注射速度为2.0 mL/s经肘静脉注入剂量为10 mL Gd-EOBDTPA注射液,注射20 min后即Gd-EOB-DTPA增强MRI的肝胆特异期,再次行MRI扫描。
1.2.2 肝脏的信号绝对增强强度(absolute enhancement value,AEV)和对比增强率(Contrast enhancement ratio,CER)的分析:在MRI扫描的 T1WI平扫期和肝胆特异期,分别选定近肝脏病灶的相同部位处为感兴趣区域(region of interesting,ROI),再测量ROI的信号强度(signal Intensity,SI)。ROI为限定在切除区域内的圆形或椭圆形区域。ROI应避免主要管道和组织坏死区域。ROI的大小为99.9~166.8(128.2±11.7)mm2。由一位固定的高年资医师计算ROI的肝胆特异期对平扫期的信号AEV和CER。不同病变程度的肝脏组织代表性图片见图1-3。ROI的信号AEV计算:AEV=SIlh-SIlu算得,SIlh(SIliver hepatobiliary phase)代表肝胆特异期肝脏的信号强度,SIlu(SIliver unhancement phase)代表平扫期肝脏的信号强度。肝脏肝胆特异期对平扫期CER计算:CER=SIlh-SIlu/SIlh。
1.2.3 病理学分析:组织病理学用来最终确定肝脏组织的病理情况。外科医师和病理科医师重新评估手术切除标本中的病灶周围肝脏组织部分,结合影像学进行ROI区域的定位。手术切除标本置于4%中性甲醛溶液固定,水洗,脱水透明,石蜡包埋,切片,HE染色和Masson染色。由2位对临床和病例资料不知情的高年资病理科医师来判断每个肝脏组织的病理分级。具体标准根据肝硬化病理学的Laennec分级系统,将肝组织分为7个等级:0级,无纤维化;1 级,极少纤维化(无间隔或极少细小间隔,可有汇管区扩大或轻度窦周纤维化);2级,轻度纤维化(偶有细隔);3级,中度纤维化(中等度细隔,不完全纤维化);4级肝硬化,细分为3个亚级[1]。肝纤维化和肝硬化的代表性HE染色和Masson染色图片见图1-3。
1.3 统计学处理方法 采用SPSS20.0软件进行统计学分析。不同病理分级的平均信号AEV和CER的差别以ANOVA-LSD来分析。计量资料以±s来表达,决定系数R2由散点图中的总计拟合线计算得出。信号增强程度和病理分级的相关性利用Spearman相关系数来确定。不同病理分级之间CER的最佳截断值利用ROC曲线确定。P<0.05为差异有统计学意义。
2 结果
2.1 Gd-EOB-DTPA增强MRI平扫期和肝胆特异期信号强度的定量分析 Gd-EOB-DTPA增强MRI肝胆特异期肝脏病灶周围肝脏信号强度均高于平扫期。正常肝脏组织、肝纤维化和肝硬化的平均信号AEV和肝胆特异期对平扫期的CER均存在差异。从正常肝脏组织组到肝硬化组,其肝胆特异期的信号强度逐渐减弱,其平均信号AEV也逐渐减弱。对照组信号AEV为666.50±186.69,肝纤维化组信号AEV为514.93 ±139.51,肝硬化组信号AEV为392.97±137.87。对照组的CER为0.96±0.16;肝纤维化组的CER为0.73±0.14;肝硬化组的CER为0.46±0.18。
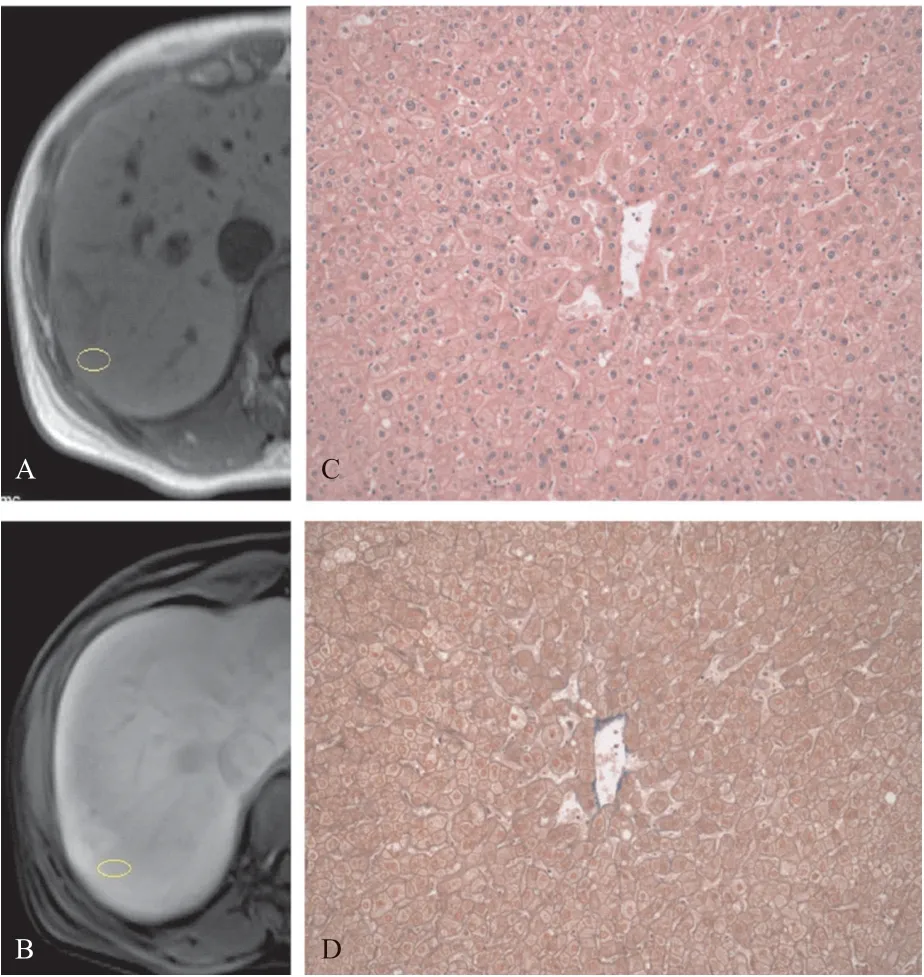
图1 对照组肝脏MRI平扫、肝胆特异期、HE染色和Masson染色图片
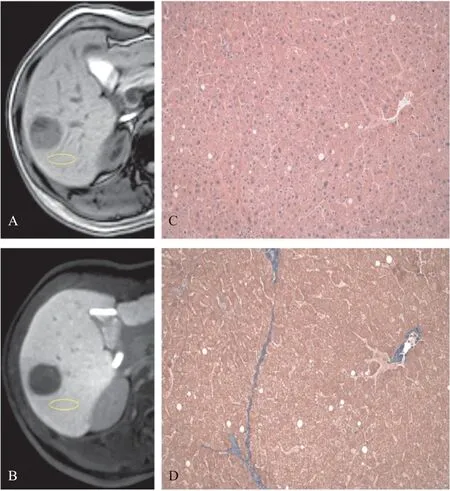
图2 肝纤维化组MRI平扫、肝胆特异期、HE染色和Masson染色图片

图3 肝硬化组MRI平扫、肝胆特异期、HE染色和Masson染色图片
2.2 3组的病理分级与信号AEV和CER的相关性分析 从正常肝脏组织、肝纤维化和肝硬化的病理分级与信号AEV和CER的相关性分析中发现:正常肝脏组织、肝纤维化和肝硬化的病理分级和信号AEV负相关(r=-0.526,P<0.001),见图4A;正常肝脏组织、肝纤维化和肝硬化的病理分级和CER负相关(r=-0.741,P<0.001),见图4B。比较病理分级与这2种分析方法的相关性后发现,正常肝脏组织、肝纤维化和肝硬化的病理分级和CER之间存在更显著的负相关。
2.3 CER预测正常肝脏组织、肝纤维化和肝硬化的病理分级 正常组和肝纤维化组间的AUC为0.840(95%CI=0.663~1.000),灵敏度为90.0%,特异度为50.0%,最佳截断值为0.76,见图5A。肝纤维化组和肝硬化组的曲线下面积为0.871(95%CI=0.751~0.992),灵敏度为100%,特异度为48.6%,最佳截断值为0.46,见图5B。
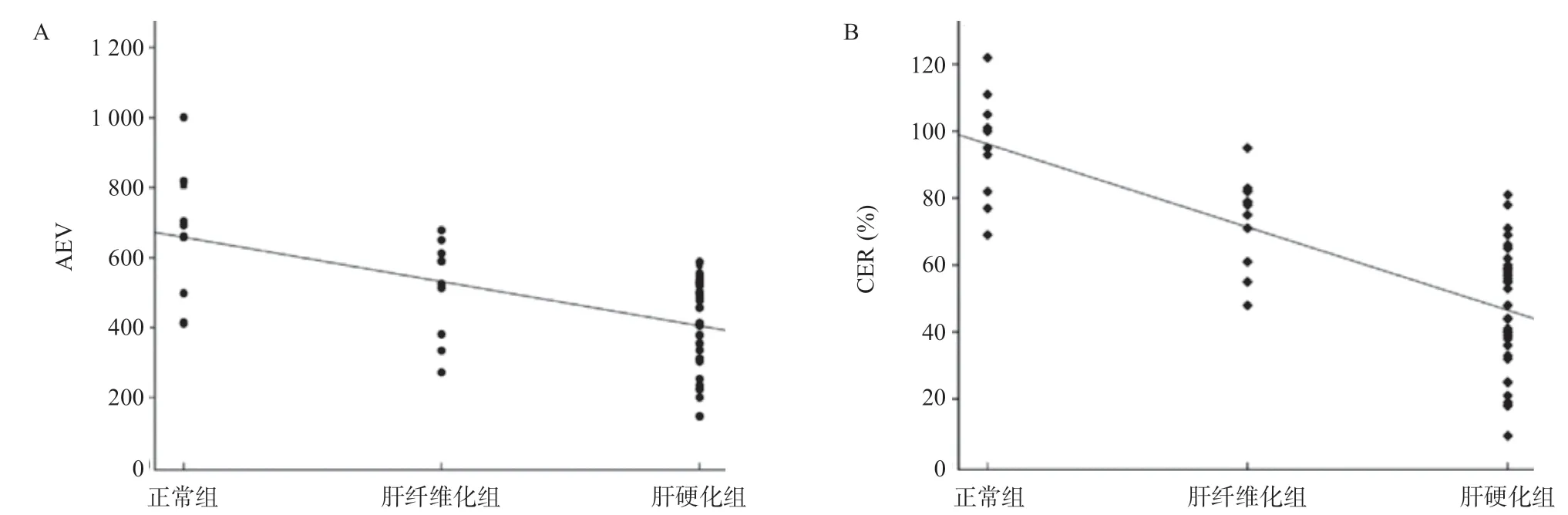
图4 AEV、CER和正常肝脏组织、肝纤维化和肝硬化的病理分级相关性
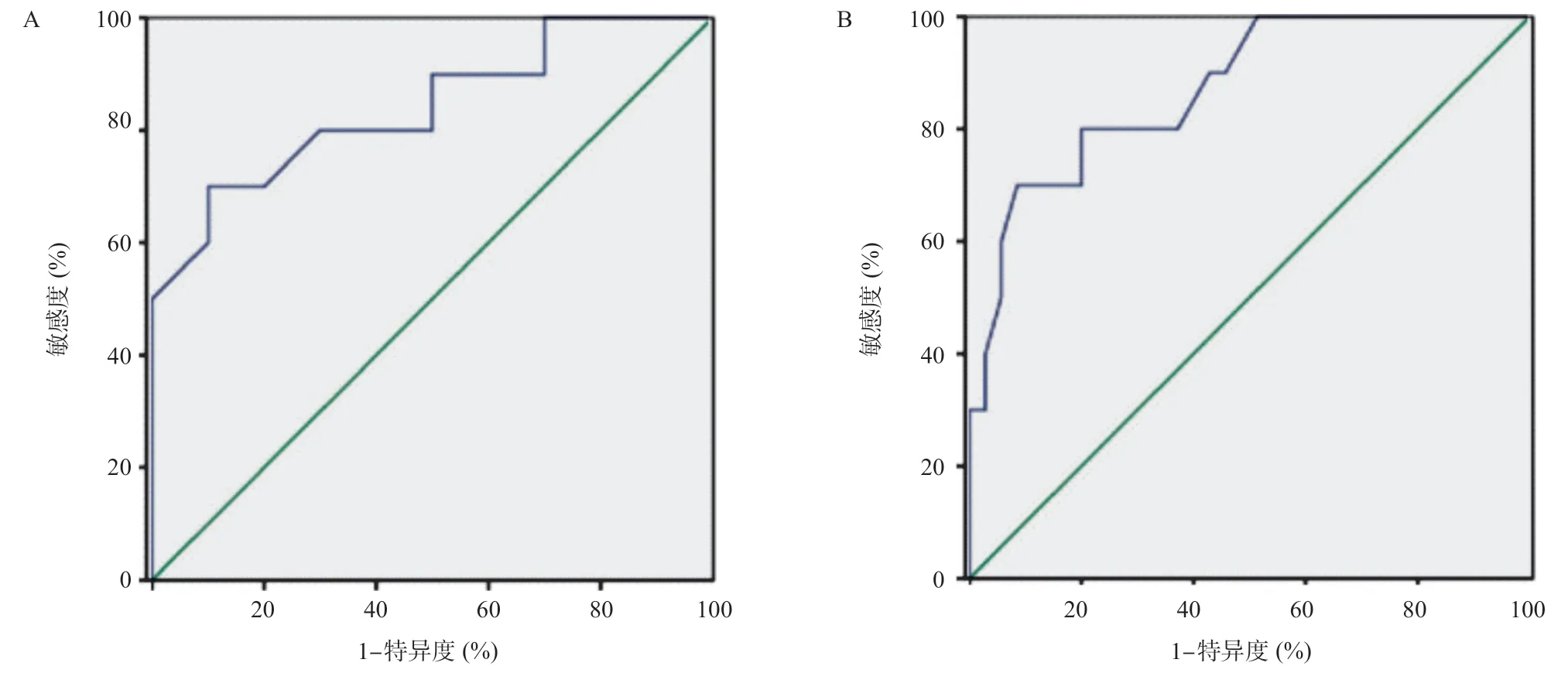
图5 正常肝脏组织、肝纤维化和肝硬化的病理分级之间CER差异AUC
3 讨论
目前有多种评分和分级系统用来评估肝纤维化和肝硬化的病理学分级。上世纪末,肝脏纤维化严重程度分级由Metavir首次通过肝活检评级系统提出,将肝脏的纤维化程度分为F0~F4共5级,F4即为肝硬化[4]。现今临床中主要依靠肝脏活组织检查来精确评估肝纤维化和肝硬化等肝脏的疾病和功能状态。事实上肝脏活检检查是一种有创的检查方式,其自身包含一定的危险性,尤其是肝硬化的患者。另外从全肝的角度考虑,肝纤维化和肝硬化存在不均一性,肝组织活检标本量少,从而会导致一定取样误差,因此肝穿刺活检并不适宜肝脏病变的筛查、较长时间的定期随访监测以及相应治疗反应的精准评估[5]。因此,寻找一种可重复性、无创和精准的方法在临床中来评估肝纤维化和肝硬化显得尤其重要。
现如今临床上对于肝脏功能状态的主要血液学检查评估手段包括谷丙转氨酶与血小板的比率、透明质酸水平、IV型胶原蛋白水平等指标[6]。另外目前B超、CT、MRI和肝胆核素显像等是临床中常用的无创影像学评价手段。B超的评估主要侧重于形态学及弹性指数方面。CT评估肝硬化的独立性预测指标是肝实质异常、结节性肝表面、门静脉高压及肝边缘变钝。普通MRI评估肝硬化的独立性预测指标是结节性肝表面、肝实质异常以及门静脉高压。MRI弹性成像、弥散成像以及灌注成像等主要通过检查肝脏组织的硬度、水弥散成像的限制程度和肝内血流的开放程度来评估肝纤维化和肝硬化[7]。上述影像学检查都是从形态学或弹性指数方面对肝硬化和肝硬化的严重程度进行评估,不能进一步从肝细胞功能状态来评估肝脏组织病变的严重程度。另外,肝胆核素显像虽然可以从功能角度进行评估,但由于其使用复杂、放射性损害、图像分辨率低等负面因素,应用受到限制。因此需要寻找一种更精准的方法来评估肝脏功能的状态。
肝细胞特异性的MRI造影剂Gd-EOB-DTPA的问世,为相应肝功能的精准评估创造了有利条件。目前阶段,对于Gd-EOB-DTPA的使用研究主要在于肝细胞肝癌的精准诊断方面,亦有少量用于肝脏的功能评估的研究,通过文献检索未发现有关肝脏实质的病理学状态与肝细胞摄取Gd-EOB-DTPA状况方面的研究。
由于Gd-EOB-DTPA特有的亲脂性乙氧基苯甲基基团,能够使约50%的Gd-EOB-DTPA被肝细胞特异性摄取,外周静脉团注后10~20 min即可获得清晰的T1WI肝细胞特异性图像[8-9]。有研究利用Gd-EOBDTPA增强MRI肝胆特异期的T1WI的信号强度来评估肝功能状况[10-11]。对于肝硬化程度与Gd-EOB-DTPA增强MRI肝胆特异期增强程度之间相关性方面也有研究报道,此类研究主要集中在其与肝硬化Child-Pugh分级之间的相关性[12]。在Gd-EOB-DTPA增强MRI肝胆特异期增强程度与肝脏组织病理学方面,GOSHIMA等[13]发现肝脏组织的增强指数(SI-post/SI-pre)和肝脏对肌肉的信号增强比率与肝纤维化的病理分级之间相关性非常显著。还有研究则发现肝脏对Gd-EOB-DTPA的摄取能力受到肝脏纤维化程度的显著影响[14]。有研究通过利用Gd-EOB-DTPA增强MRI扫描大鼠肝硬化动物模型,然后定量分析肝脏平扫期和肝胆特异期的信号强度,得出相对增强指数,发现相对增强指数可以提示肝纤维化和肝硬化所对应的肝脏损害。进一步分析了正常肝脏组织、肝纤维化和早期肝硬化的病理分级和相对增强指数之间的差异性,发现肝纤维化组和对照组之间、肝纤维化组和早期肝硬化组之间的差异无显著性,而对照组和早期肝硬化组之间存在差异性,从而得出相对增强指数有助于早期肝硬化的评估和判断[15]。
综上所述,定量分析Gd-EOB-DTPA增强MRI肝胆特异期信号强度发现,CER与正常肝脏组织、肝纤维化和肝硬化组的病理分级存在比较显著的相关性,并能通过分析CER来评估肝纤维化和肝硬化的病理分级。
