血清Klotho、FGF23、ALP、25-(OH)D水平对持续非卧床腹膜透析患者心脏瓣膜钙化的影响*
2020-10-09祁娇许珊珊其其格石东英王爱雪赵建荣
祁娇,许珊珊,其其格,石东英,王爱雪,赵建荣
(内蒙古医科大学附属医院 肾内科,内蒙古 呼和浩特 010050)
持续非卧床腹膜透析(continuous ambulatory peritoneal dialysis,CAPD)是慢性肾脏病(chronic kidney disease,CKD)首选治疗方案,属于终身替代疗法,可有效改善患者临床症状、延长生存周期[1]。临床实践研究表明[2],矿物质及骨代谢紊乱是CKD 常见并发症之一,可导致转移性钙化、心血管事件发生风险增加,给患者生命安全造成严重威胁,因此,寻找早期诊断和评估该病预后的血清学标志物对降低CAPD 患者心血管事件发生风险、改善预后有重要意义。研究表明[3-4],可溶性抗衰老蛋白Klotho,成纤维细胞生长因子23(fibroblast growth factor 23,FGF23)在血管钙化及血磷代谢过程中发挥重要作用,25 羟维生素D [25-(OH)D)]是慢性肾衰竭患者心脑血管发病危险因素。另有研究证实[5],碱性磷酸酶(alkaline phosphatase,ALP)与透析患者腹主动脉钙化关系密切,是评估血管钙化、骨质疏松的可靠指标。上述研究均表明Klotho、FGF23、ALP、25-(OH)D 参与血管钙化,但关于它们与CAPD 患者心脏瓣膜钙化相关性研究尚少。鉴于此,本研究对CAPD 患者的临床资料进行分析,了解血清Klotho、FGF23、ALP、25-(OH)D 水平与心脏瓣膜钙化的关系,并评估其对心脏瓣膜钙化的诊断效能价值,现报道如下。
1 资料与方法
1.1 一般资料
前瞻性选取2018年1月-2019年1月内蒙古医科大学附属医院收治的CAPD 患者132 例作为研究对象,均应用低钙(浓度1.24 nmol/L)、葡萄糖浓度为1.5%或2.5%的腹膜透析液,进行规范的CAPD 治疗。其中,男性67 例,女性65 例;年龄41~72 岁,平均(59.90±7.42)岁;透析龄3~35 个月,平均(22.55±4.70)个月;原发病:慢性肾小球肾炎58 例、糖尿病肾病42 例、高血压肾硬化20 例,其他12 例。纳入标准:①接受CAPD 治疗超过3 个月,且病情稳定者;②CAPD 治疗期间尿素清除指数(urea clearance index,Kt/V)≥1.7;③临床资料完整者。排除标准:①近1 个月内应用激素类药物或免疫抑制剂治疗者;②合并活动炎症性疾病、自身免疫性疾病、内分泌紊乱等全身系统性疾病者;③罹患恶性肿瘤者;④甲状旁腺切除者或精神疾病患者。另选取同期医院体检中心健康体检者,排除各项指标异常者,纳入40 例健康受试者。其中,男性22 例,女性18 例;年龄41~68 岁,平均(58.60±7.31)岁。CAPD 患者与健康受试者性别构成比、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究获得医院医学伦理委员会审批,受试者签署知情同意书。
1.2 方法
1.2.1 血清Klotho、FGF23、ALP、25-(OH)D 检测空腹抽取上臂静脉血,离心获得血清,采用酶联免疫吸附法检测Klotho、FGF23、25-(OH)D,血清Klotho、FGF23 试剂盒购自美国Millipore 公司,25-(OH)D 试剂盒购自上海雅吉生物科技有限公司,严格按照试剂盒说明书步骤操作。血清ALP 采用CX5PROL 型全自动生化分析仪及其配套试剂盒购自美国Beckman Coulter 公司。
1.2.2 心脏超声评估心脏瓣膜钙化采用Vivid7 BT08 型全数字彩色多普勒超声诊断仪(美国GE 公司,探头频率8~10 MHz)评估CAPD 患者心脏瓣膜钙化情况,包括主动脉瓣、二尖瓣及瓣环。以心脏瓣膜出现1 个及以上直径≥1 mm 的强回声区为心脏瓣膜钙化标准,根据评估结果将患者分别纳入钙化组和非钙化组。
1.2.3 临床资料收集收集并统计可能导致心脏瓣膜钙化的相关因素,包括性别、年龄、透析龄、原发病类型、空腹血糖、脉压差(收缩压-舒张压);评估肾功能指标:残余肾功能(RRF)、Kt/V;采用CX5PROL 型全自动生化分析仪及其配套试剂(美国Beckman Coulter 公司)检测患者血红蛋白、白蛋白、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)、血钙、血磷、超敏C 反应蛋白(hs-CRP),计算校正钙[总血钙+0.02×(40-白蛋白)]浓度,免疫测定法检测全段甲状旁腺素(iPTH)。
1.3 观察指标
①CAPD 患者与健康受试者血清Klotho、FGF23、ALP、25-(OH)D 水平;②钙化组与非钙化组血清Klotho、FGF23、ALP、25-(OH)D 水平及其他可能影响心脏瓣膜钙化相关因素水平。
1.4 统计学方法
数据分析采用SPSS 22.0 统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验;计数资料以例(%)表示,比较采用χ2检验;等级资料采用秩和检验;心脏瓣膜钙化的因素分析应用Logistic 回归;应用Med Calc 9.3.0 绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC);P<0.05为差异有统计学意义。
2 结果
2.1 CAPD 患者与健康受试者血清Klotho、FGF23、ALP、25-(OH)D 水平比较
CAPD 患者与健康受试者血清Klotho、FGF23、ALP、25-(OH)D 水平比较,差异均有统计学意义(P<0.05),CAPD 患者血清Klotho、25-(OH)D 水平均低于健康受试者,血清FGF23、ALP 水平均高于健康受试者。见表1。
2.2 钙化组与非钙化组血清Klotho、FGF23、ALP、25-(OH)D 水平及其他可能影响心脏瓣膜钙化相关因素比较
钙化组与非钙化组血清Klotho、FGF23、ALP、25-(OH)D 水平、RRF 及血磷水平比较,差异均有统计学意义(P<0.05)。钙化组血清Klotho、25-(OH)D水平、RRF 均低于非钙化组,FGF23、ALP、血磷水平均高于非钙化组;而两组男性患者构成比、原发病类型、年龄、透析龄、空腹血糖、脉压、Kt/V、血红蛋白、白蛋白、TC、TG、LDL、HDL、校正钙、iPTH、hs-CRP 水平比较,差异均无统计学意义(P>0.05)。见表2。
2.3 心脏瓣膜钙化的危险因素Logistic 回归分析
利用Logistic 回归对标准曲线进行拟合,决定系数R2>0.961,拟合效果优,分析方法可靠;经分析,RRF、血磷、血清Klotho、FGF23、ALP、25-(OH)D均是导致心脏瓣膜钙化的危险因素(=2.085、3.180、4.845、7.652、2.596 及2.440,均P<0.05)。见表3。
表1 CAPD 患者与健康受试者血清Klotho、FGF23、ALP、25-(OH)D 水平比较 (±s)
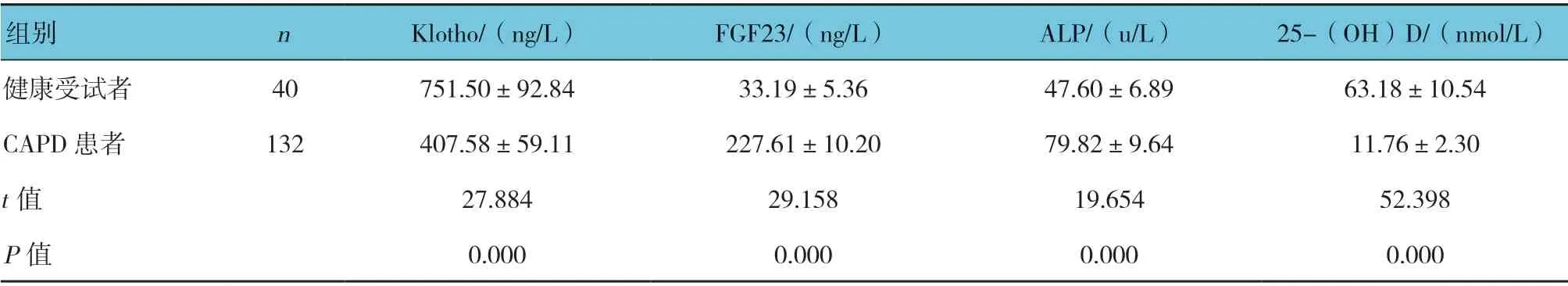
表1 CAPD 患者与健康受试者血清Klotho、FGF23、ALP、25-(OH)D 水平比较 (±s)
组别 n Klotho/(ng/L) FGF23/(ng/L) ALP/(u/L) 25-(OH)D/(nmol/L)健康受试者 40 751.50±92.84 33.19±5.36 47.60±6.89 63.18±10.54 CAPD 患者 132 407.58±59.11 227.61±10.20 79.82±9.64 11.76±2.30 t 值 27.884 29.158 19.654 52.398 P 值 0.000 0.000 0.000 0.000
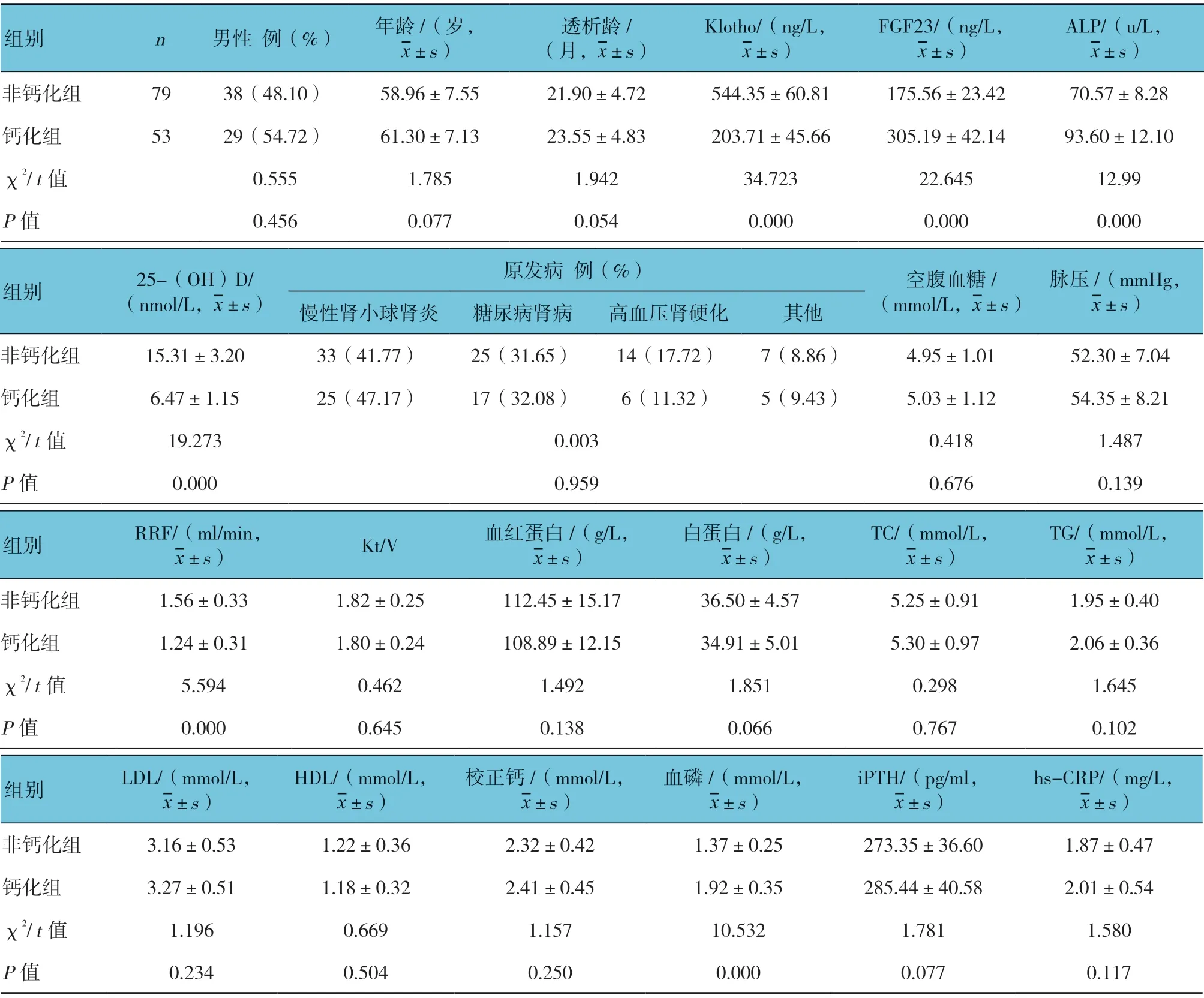
表2 钙化组与非钙化组可能影响心脏瓣膜钙化相关因素比较
2.4 血清Klotho、FGF23、ALP、25-(OH)D水平对心脏瓣膜钙化的诊断价值分析
血清Klotho、FGF23、ALP、25-(OH)D 诊断心脏瓣膜钙化的最佳截断点分别为401.10ng/L、231.91ng/L、76.50u/L 及11.36nmol/L,敏感性分别为88.68%、90.57%、71.70%及67.92%,特异性分别为88.61%、92.41%、77.22%及70.89%,AUC 分别为0.903、0.927、0.714 及0.698。见表4和图1。
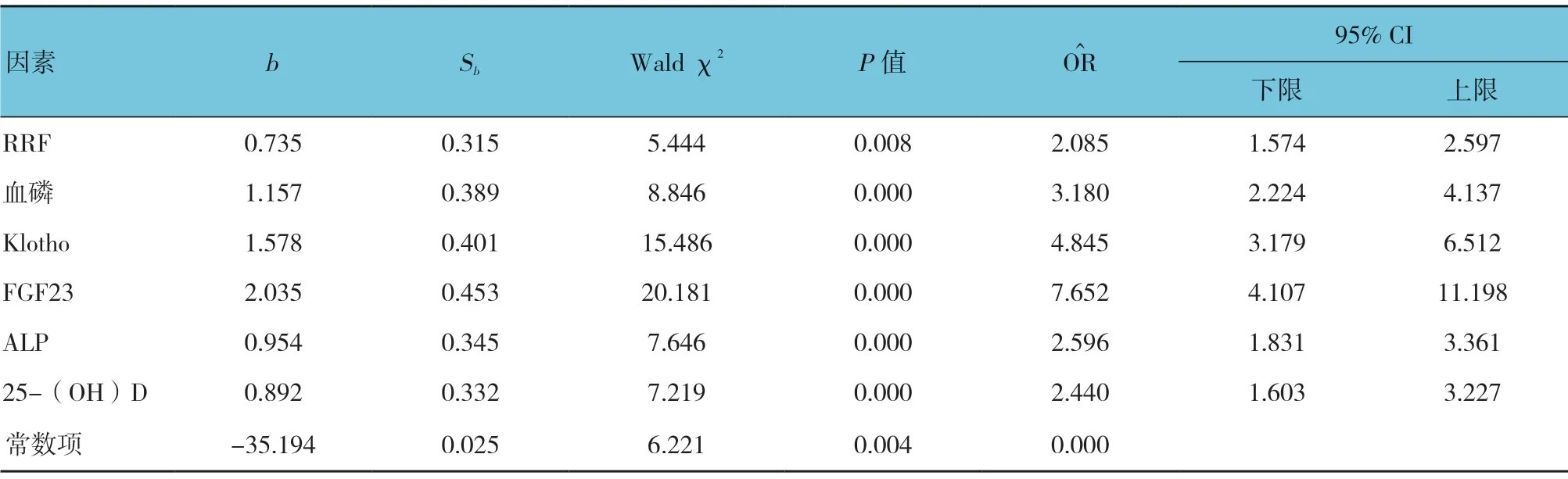
表3 心脏瓣膜钙化的危险因素Logistic 回归分析参数
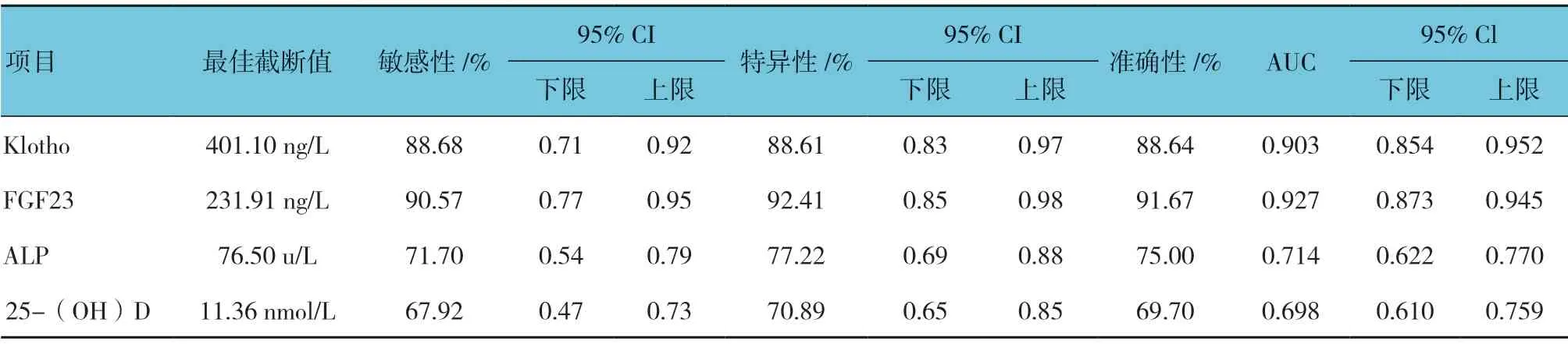
表4 血清Klotho、FGF23、ALP、25-(OH)D 水平对心脏瓣膜钙化诊断价值分析
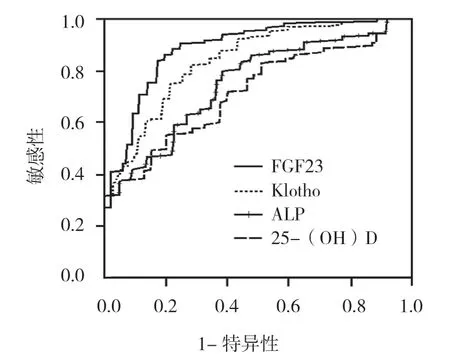
图1 Klotho、FGF23、ALP、25-(OH)D 诊断心脏瓣膜钙化ROC 曲线
3 讨论
CAPD 是终末期肾脏病患者维持生命的重要手段,患者需长期接受治疗,而CAPD 治疗期间心血管疾病是导致患者死亡的首要原因。研究发现[6-7],引起心血管疾病的危险因素很多,除高龄、吸烟、高血压等传统危险因素外,还包括肾功能不全所致炎症、氧化应激、矿物质及骨代谢紊乱等。研究发现[8-9],CKD患者肾小球滤过率异常降低,滤出磷减少,导致血磷水平升高,过饱和磷离子与钙离子结合形成结晶盐可沉积于血管及心脏瓣膜,引起血管钙化,尤其是心脏瓣膜钙化最为常见,最终导致动脉粥样硬化、瓣膜损伤及心律失常等心血管疾病发生风险增加。目前,临床对心脏瓣膜钙化的评估主要采用心脏超声检查[10],但仍缺乏评估和预测CAPD 患者心脏瓣膜钙化的可靠血清学指标。
Klotho 蛋白主要分布于肾脏、甲状旁腺等细胞上,属于骨-肾内分泌轴中最终调节蛋白;FGF23 主要由骨细胞分泌,属于成纤维细胞生长因子,Klotho、FGF23 均属于钙磷代谢蛋白,在矿物质-骨代谢紊乱相关疾病进展中发挥重要调控作用[11]。FGF23 主要通过调节钠磷协同转运蛋白的胞吞作用,促进近端肾小管尿磷排泄;Klotho 是FGF23 信号通路关键调控因子,可直接调控肾小管钙离子通道及磷转运体,参与钙磷转运和吸收过程[12]。此外,有研究发现[13],FGF23 还可通过抑制1-α 羟化酶、促进24-羟基酶的合成,降低维生素D 含量。陈金艳等[14]研究显示,CKD Ⅱ期患者血清FGF23 水平处于异常高水平状态,而随着CKD 疾病进展,高水平FGF23 不利于尿磷排出,引起高磷血症及维生素D 缺乏症。本研究中CAPD 患者血清Klotho、25-(OH)D 水平均低于健康受试者,FGF23 水平高于健康受试者,说明CAPD 患者血清Klotho、25-(OH)D 水平降低,FGF23、ALP 水平升高,进一步提示CAPD 患者存在矿物质-骨代谢紊乱。血清ALP 主要由肝脏细胞及成骨细胞分泌,ALP 代谢产物为磷酸,可促进局部血管矿化。另有研究发现[15],终末期肾病患者血清ALP 水平异常升高,与本研究结果相似。
Klotho、FGF23、ALP、25-(OH)D 在钙磷代谢中关系密切,相互影响,随着各指标血清水平出现异常,可对靶器官造成不同程度损害。有研究发现[16],FGF23 与动脉粥样硬化、左心室肥厚关系密切,Klotho、25-(OH)D 作为FGF23 信号通路中重要因子,在疾病进展中同样起重要作用。本研究发现,CAPD 合并心脏瓣膜钙化患者血清Klotho、25-(OH)D 水平均低于非钙化患者,FGF23 水平高于非钙化患者,且Logistic 回归分析显示这些指标均是导致心脏瓣膜钙化的危险因素,提示Klotho、FGF23、25-(OH)D 与CAPD 发生心脏瓣膜钙关系密切,参与心脏瓣膜钙化过程。另有研究发现[17-18],血清高水平ALP 与终末期肾脏病患者全因死亡、心血管事件发生率密切相关,且血清ALP 水平越高,可能导致肾功能进一步恶化,提示高水平血清ALP 参与心血管损害过程,导致预后不良风险增加。本研究发现,CAPD 合并心脏瓣膜钙化患者血清ALP 水平均高于非钙化者,且Logistic回归分析显示血清ALP 是导致心脏瓣膜钙化的危险因素,进一步证实高水平血清ALP 与心脏瓣膜钙化关系密切。此外,本研究ROC 曲线结果显示,血清Klotho、FGF23、ALP、25-(OH)D 诊断心脏瓣膜钙化均具有较高的敏感性和特异性。上述血清指标检测与影像学检查相比具有更好的患者依从性,且具有较高的诊断效能,临床中可考虑将其作为CAPD 患者心脏瓣膜钙化诊断指标。
综上所述,CAPD 患者血清Klotho、25-(OH)D水平降低,FGF23、ALP 水平升高,且均与CAPD 心脏瓣膜钙化关系密切,对CAPD 患者心脏瓣膜钙化有较高的诊断效能。因此,在CAPD 治疗期间,应密切关注血清Klotho、FGF23、ALP、25-(OH)D 水平变化,评估心脏瓣膜钙化情况,以早期实施有效干预手段预防心脏瓣膜钙化,改善患者预后。
