Rho/ROCK激酶信号通路在大鼠宫腔粘连中的作用
2020-10-09黄博李隽董兰钟亚娟程静黄志欣
黄博,李隽,董兰,钟亚娟,程静,黄志欣
(武汉大学人民医院 妇产科,湖北 武汉 430060)
宫腔粘连又称Asherman 综合征,是由多种病因导致子宫内膜基底层脱落或受损后出现的子宫内膜纤维化并形成粘连带,导致宫腔部分或全部闭锁。其主要临床表现为月经异常(可为经量减少或继发性闭经),周期性下腹痛,继发不孕及异常妊娠(包括复发性流产、胎死宫内及胎盘异常)等[1-2],严重影响育龄女性的身体健康和生活质量。近年来,宫腔粘连的发病率越来越高,其发病机制及防治方法仍是妇科生殖领域研究的难题。针对宫腔粘连的治疗主要是宫腔镜直视下分离粘连并术后放置宫内节育器、球囊支架等,可以辅以防粘连材料[3-5]及雌激素治疗。宫腔粘连最重要的治疗策略就是抑制子宫内膜纤维化,促进子宫内膜的再生和功能恢复,目前对其作用机制研究较少,故治疗上一直无突破。因此,探索宫腔粘连的发病机制,并寻求有效的靶点阻断子宫内膜纤维化,促进子宫内膜的再生修复是临床工作者共同面临的一大挑战。
相关研究已证实[6-9],Rho/ROCK 信号通路能够调控细胞增殖,参与组织损伤修复和再生,如肝纤维化、原发性高血压肾纤维化、肺纤维化等,提示该信号通路在组织纤维化进程中具有重要作用。Rho 蛋白为Ras 蛋白超家族成员之一,包括RhoA、RhoB 和RhoC 3 种分子,Rho 通过与鸟苷三磷酸(GTP)结合,触发下游激酶级联反应而发挥多种生物学功能[10]。ROCK又称Rho 激酶,是目前功能研究最为详细的Rho 下游靶效应分子[11],有ROCKI 与ROCKII 2 种亚型,ROCK接受Rho 传导的活化信号,使多个氨基酸位点被磷酸化而激活,从而介导下游的一系列磷酸化/脱磷酸反应[12]。Rho/ROCK 信号通路活化可使肌球蛋白轻链磷酸酶(myosin light chain phosphatase,MLCP)上的肌球蛋白轻链(myosin light chain,MLC)亚单位磷酸化,MLCP 活性降低,从而阻碍MLC 脱磷酸化,提高成纤维细胞内MLC 磷酸化水平,增加肌球蛋白和肌动蛋白交联[13],进而诱导细胞骨架重组、细胞迁移和应力纤维形成,参与组织纤维化病变。本研究采用宫腔注射95%无水乙醇复制大鼠宫腔粘连模型[14],并分析宫腔粘连大鼠模型子宫内膜组织中Rho/ROCK 信号通路相关蛋白的表达与宫腔粘连及TGF-β1表达的关系,探讨其可能的作用机制,为预防宫腔粘连及术后复发提供理论依据。
1 材料与方法
1.1 试剂及仪器
苏木精-伊红染液(HE)(珠海贝索公司),二抗试剂盒(北京中杉金桥公司),Vimentin、Keratin、TGF-β1、RhoA、RhoC、ROCKI、ROCKII 抗体(英国Abcam 公司),RhoB(北京博奥森公司)。光学显微镜(日本Olympus 公司,IX73 型),明美显微数码测量分析系统(广州明美光电技术有限公司)。
1.2 实验动物
健康SD 清洁级雌性大鼠32 只(国家实验动物种子中心上海分中心暨上海斯莱克实验动物有限责任公司),体重250~270g,9 周龄左右。实验中对动物的处置符合医学伦理学标准。
1.3 方法
1.3.1 大鼠宫腔粘连模型的复制随机将大鼠分为模型组和对照组,每组16 只。两组大鼠均正常饮水及进食。模型组大鼠按350mg/kg 10%水合氯醛麻醉,光照维持体温(37.0±0.5)℃。无菌手术切开腹壁,打开腹腔,缓慢挑出“Y”型子宫,动脉夹夹闭每侧子宫上下两端,在子宫最下端入针,注射0.5ml 95%乙醇,3min 后吸出乙醇,生理盐水冲洗2 遍,切口创面覆盖湿纱布。恢复正常子宫解剖位置,再用生理盐水冲洗腹腔后逐层关腹。术后3d 肌内注射青霉素预防感染。对照组大鼠阴道插管,宫腔灌注等量生理盐水。每天观察大鼠进食、排便及精神状况。
1.3.2 大鼠子宫解剖形态的观察模型复制后第15 天,两组大鼠体重无明显差异,恢复良好。处死所有大鼠,手术取两组大鼠子宫,经10%甲醛固定,石蜡切片,HE 染色,观察子宫形态学变化。采用明美显微数码测量分析系统测量子宫内膜厚度,每张图片选取3 个位置量取,取平均值,不同样本选取的位置尽量一致;同时在光学显微镜下,每组随机选取5 个切片,每个切片随机选取6 个视野进行腺体计数,取平均值。
1.3.3 免疫组织化学SP 法检测大鼠子宫内膜组织中角蛋白、波形蛋白、Rho/ROCK 信号通路相关蛋白及TGF-β1 的表达以上石蜡切片标本脱蜡水化,3%过氧化氢H2O2阻断内源性过氧化物酶,进行抗原修复,室温下非免疫羊血清封闭20min,吸去多余血清,滴加适当稀释的第一抗体,4℃过夜。加二抗,37℃温箱中培育0.5h。滴加链霉素抗生物素蛋白-过氧化物酶溶液,37℃温箱中培育0.5h。以上各步骤结束后均用磷酸盐缓冲液(PBS)冲洗3 次,5min/次。滴加新鲜配制的DAB 溶液,自来水冲洗,苏木精复染、脱水、封片。用已知阳性片作阳性对照,用PBS 代替第一抗体作阴性对照。
1.3.4 结果判断子宫内膜上皮细胞中有黄色或棕黄色颗粒为阳性细胞,先低倍镜后高倍镜,每张切片选取5 个阳性视野,采用Image-Pro-Plus 软件分析累积光密度(IOD)值和平均光密度(AOD)值,计算TGF-β1及Rho/ROCK 信号通路相关蛋白表达水平。
1.4 统计学方法
数据分析采用GraphPad Prism 8.0 软件统计,计量资料以均数±标准差(±s)表示,比较用t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠的子宫形态
复制模型后第15 天,模型组大鼠“Y”形子宫变得粗细不均,不顺滑,韧性变差;对照组大鼠子宫腔形态规则,结构完整,分为内膜层、肌层和外膜层,子宫内膜呈单层柱状上皮结构,覆盖宫腔表面,子宫内膜腺体丰富,呈椭圆形或圆形,主要位于黏膜下层和基底层(见图1)。模型组子宫腔变小,子宫内膜变薄,子宫内膜厚度为(211.283±47.059)μm,与对照组(455.979±58.824)μm 比较,差异有统计学意义(t=15.567,P=0.003);模型组子宫内膜结构松散甚至坏死,未见明显波浪形,部分上皮内膜缺失,连续性中断,组织开始纤维化粘连,子宫内膜腺体萎缩,腺体数目为(1.333±0.308)个,与对照组(5.667±1.385)个比较,差异有统计学意义(t=11.256,P=0.003),模型组腺体数目减少(见图2)。
2.2 大鼠子宫内膜组织角蛋白及波形蛋白的表达
对照组子宫内膜的柱状上皮细胞呈棕黄色颗粒,可见分布均匀的角蛋白,而模型组阳性着色很少;对照组角蛋白表达量为(0.033±0.003),模型组角蛋白表达量为(0.004±0.001),两组比较,采用t检验,差异有统计学意义(t=71.155,P=0.000),模型组中角蛋白表达下降。波形蛋白呈棕黄色颗粒,沉积于子宫内膜间质的基质细胞和内皮细胞中,对照组表达量为(0.040±0.012),模型组表达量为(0.029±0.003),两组比较,差异无统计学意义(t=1.167,P=0.071)。见图3。
2.3 大鼠子宫内膜组织中TGF-β1 的表达
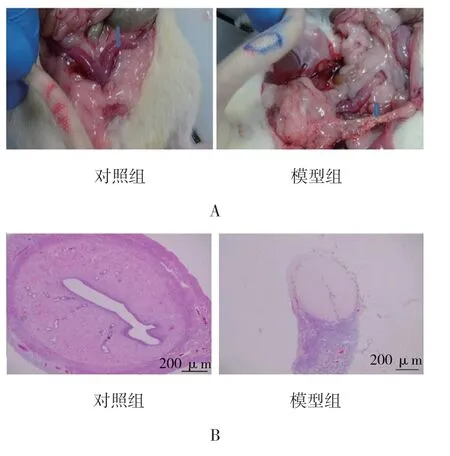
图1 两组大鼠子宫的形态学和组织学变化
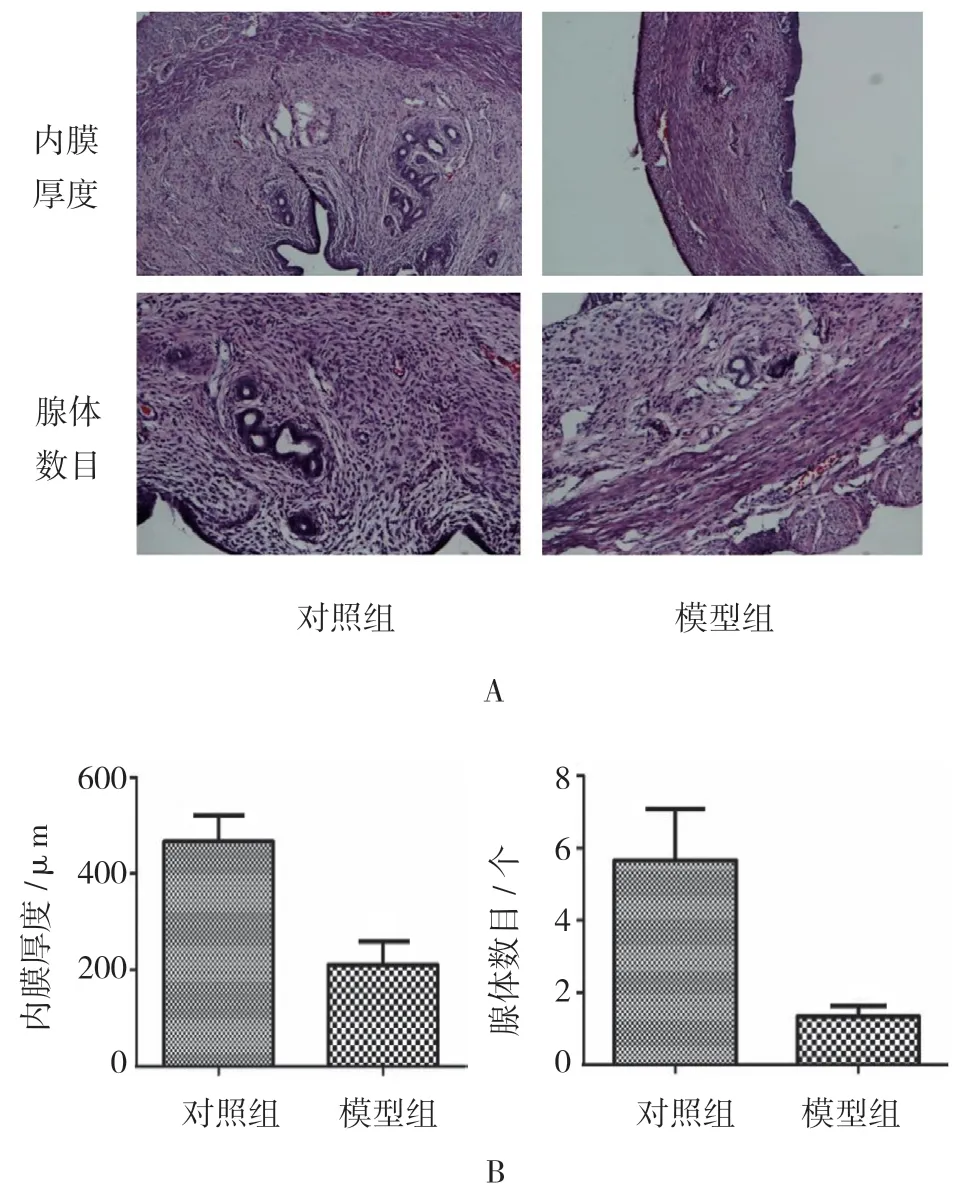
图2 两组大鼠子宫内膜和腺体的变化
对照组和模型组TGF-β1蛋白的表达量分别为(0.003±0.000)和(0.013±0.001),两组比较,差异有统计学意义(t=59.450,P=0.000),模型组TGF-β1表达升高。见图4。
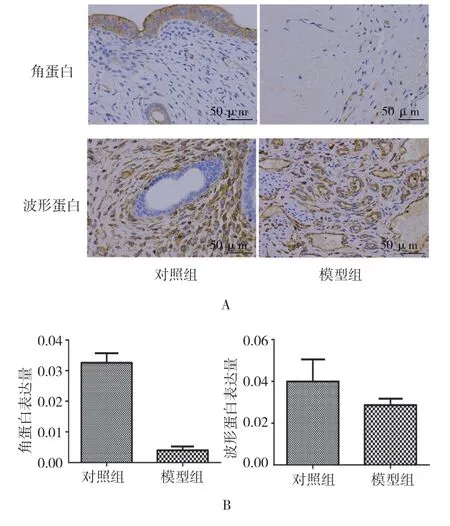
图3 两组大鼠子宫内膜组织角蛋白及波形蛋白的表达
2.4 大鼠子宫内膜组织中Rho/ROCK 信号通路相关蛋白的表达
两组大鼠子宫内膜的RhoA、RhoB、RhoC、ROCKI、ROCKII 表达量比较,差异有统计学意义(P<0.05),模型组子宫内膜RhoA、RhoB、RhoC、ROCKI、ROCKII 的表达均升高。见表1和图5~9。
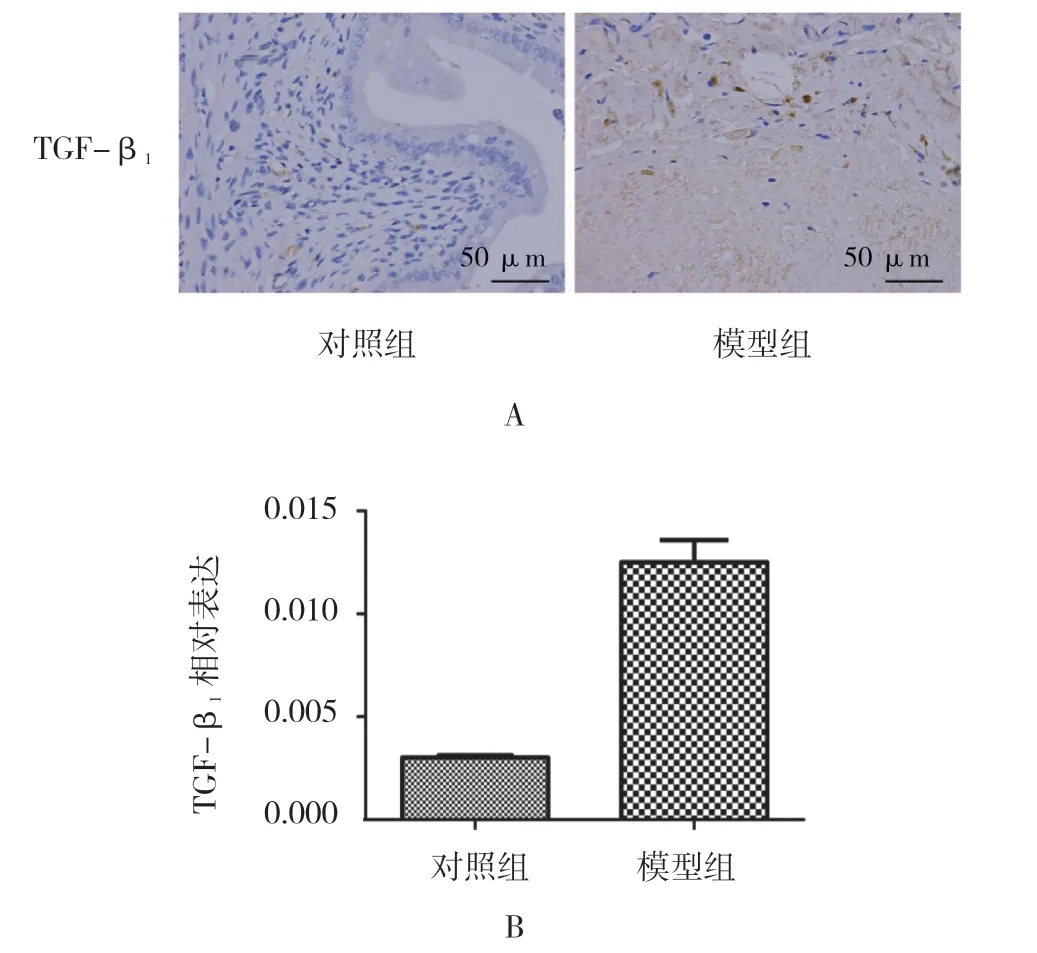
图4 两组大鼠子宫内膜组织TGF-β1 的表达
表1 两组大鼠RhoA、RhoB、RhoC、ROCKI、ROCKII 表达量比较 (±s)
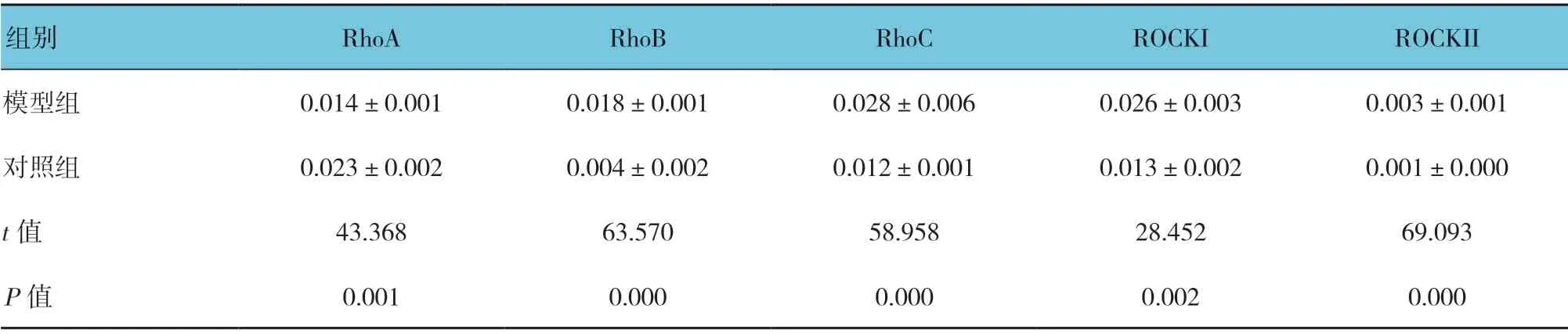
表1 两组大鼠RhoA、RhoB、RhoC、ROCKI、ROCKII 表达量比较 (±s)
组别 RhoA RhoB RhoC ROCKI ROCKII模型组 0.014±0.001 0.018±0.001 0.028±0.006 0.026±0.003 0.003±0.001对照组 0.023±0.002 0.004±0.002 0.012±0.001 0.013±0.002 0.001±0.000 t 值 43.368 63.570 58.958 28.452 69.093 P 值 0.001 0.000 0.000 0.002 0.000

图5 大鼠子宫内膜组织RhoA 的表达(免疫组织化学染色×400)
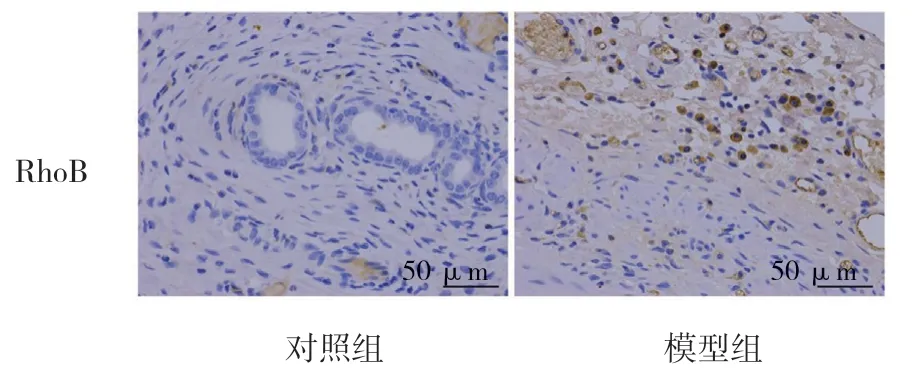
图6 大鼠子宫内膜组织RhoB 的表达(免疫组织化学染色×400)

图7 大鼠子宫内膜组织RhoC 的表达(免疫组织化学染色×400)
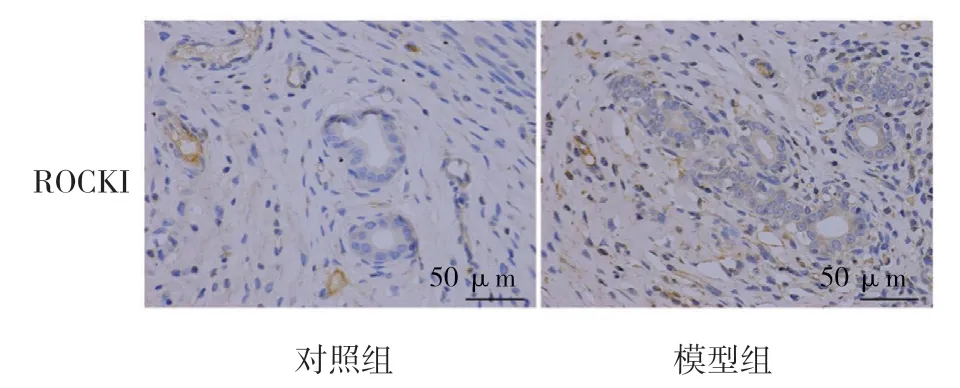
图8 大鼠子宫内膜组织ROCKI 的表达(免疫组织化学染色×400)
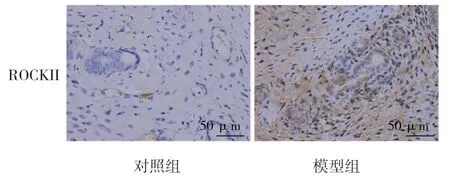
图9 大鼠子宫内膜组织ROCKII 的表达(免疫组织化学染色×400)
3 讨论
子宫内膜纤维化和子宫内膜再生障碍是宫腔粘连形成的关键[15]。有效的子宫内膜损伤动物模型是研究该类疾病发生、发展和治疗反应等不可或缺的支撑条件[16]。本研究大鼠模型复制成功后,模型组大鼠子宫变得粗细不均,不顺滑,韧性变差;子宫腔变小,子宫内膜明显变薄;腺体萎缩、数目减少。故注射无水乙醇可复制稳定的大鼠宫腔粘连动物模型。角蛋白作为子宫内膜上皮细胞标志物,会随组织膜纤维化程度的增加而减少[17],本研究结果也显示,宫腔粘连模型组中角蛋白表达下降。波形蛋白作为间质细胞标志物,在子宫内膜受损初期,基质细胞明显减少时表达下降,随着损伤的修复,子宫内膜上皮发生间充质转化,波形蛋白表达逐渐增加,表明波形蛋白可能参与了组织修复及纤维化,本实验中,两组波形蛋白的表达无差异,考虑与子宫内膜腺上皮损伤修复及纤维化程度有关。
研究认为[18-19],上皮-间质转化是宫腔粘连的可能发病机制之一,子宫内膜基底层损伤后,上皮细胞再生障碍,其向间质细胞转化并获得迁移能力,导致成纤维细胞不断增殖及细胞外基质(extracellular matrix,ECM)过度沉积,同时子宫内膜增生受到抑制,内膜组织逐渐被纤维结缔组织取代,出现内膜纤维化,进而导致宫腔组织粘连。TGF-β1蛋白主要表达于子宫内膜腺上皮细胞和间质细胞的细胞质中,是最主要的促纤维形成细胞因子,通过结合成纤维细胞膜上特异性受体而发挥作用。在正常的生理条件下,成纤维细胞释放的纤维蛋白原和纤维蛋白溶解处于动态平衡,但在病理条件下,TGF-β1通过刺激ECM 的合成,从而诱导合成纤溶酶原活化因子抑制(PAI-1)和金属蛋白酶组织抑制因子(TIMP),进而抑制基质金属蛋白酶(MMPS)的表达和活性,进一步导致ECM 合成和降解紊乱,使ECM 沉积。ECM 大量堆积在子宫内膜中,内膜中结缔组织逐渐生成,最终导致纤维化,形成宫腔粘连[20]。国内外研究结果显示,TGF-β1子宫内膜的高表达与宫腔粘连的发生、发展关系密切,并随宫腔粘连疾病严重程度的加重而升高[21-22]。本研究也显示,模型组大鼠子宫内膜中TGF-β1表达高于对照组,TGF-β1参与大鼠宫腔粘连的形成。
近年来,Rho/ROCKI 信号通路在组织器官纤维化发生发展过程中的作用已受到广泛关注。已有研究表明,TGF-β1通过激活RhoA 诱导腹膜纤维化病变[23];TGF-β1能够直接在转录水平上诱导RhoB[24]及RhoC[25]的表达。TGF-β1也可通过激活ROCK 导致组织纤维化病变[26-27]。TGF-β1通过激活Rho/ROCK 信号通路诱导晶状体上皮细胞的上皮-间质转化[28],诱导尿道瘢痕成纤维细胞纤维化[29]病变及心房重构[30]。有文献报道,激活ROCKI 可促进子宫内膜纤维化[31]。上述一系列研究表明,Rho/ROCK 是TGF-β1重要的下游信号通路,也是其促组织纤维化的重要分子机制。但TGF-β1和Rho/ROCKI 信号通路在子宫内膜纤维化进程中的作用尚未见报道。本研究显示,模型组大鼠子宫内膜的Rho(RhoA、RhoB、RhoC)、Rho 激酶(ROCKI、ROCKII)及TGF-β1的表达高于对照组,推测TGF-β1可能通过激活Rho/ROCK 信号通路促使子宫内膜损伤后组织纤维化,导致宫腔粘连。Rho/ROCK 信号通路很有可能成为新的、有前景的治疗靶点,也为临床治疗宫腔粘连提供合理有效的方法。
