初发与复发急性B淋巴细胞白血病患儿单核细胞microRNA表达谱分析*
2020-10-09邱丽娟世淑兰蒲刚玲夏世梅房建铭田新
邱丽娟,世淑兰,蒲刚玲,夏世梅,房建铭,田新
[昆明市儿童医院(昆明医科大学附属儿童医院),云南省儿童重大疾病研究重点实验室,云南 昆明 650228]
急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是由于原始及幼稚淋巴细胞在造血组织异常增殖并可侵犯各组织脏器的一种造血系统恶性克隆性疾病。根据白血病细胞的免疫表现型,分为急性B 淋巴细胞白血病(B-cell acute lymphoblastic leukemia,B-ALL)和急性T 淋巴细胞白血病(T-cell acute lymphoblastic leukemia,T-ALL),统计显示其中80%为B-ALL[1]。ALL的发病人群年龄最常见于<5 岁及>50 岁,其中80%为儿童[2]。ALL 患儿治疗后可完全缓解,5年生存率可达到80%,远高于成人ALL 患者30%~40%的3年总生存率[3-4]。即使如此,由于个体差异和化疗药物耐药等问题,仍然存在部分ALL 患儿在诱导治疗后复发,继而面临更差的预后结果。所以探索治疗后的预后指征,以及初发与复发患者间的差异,对临床治疗具有重要的指导意义。
MicroRNA(miRNA)作为非编码RNA 分子,可以在转录和转录后水平上调控基因的表达,参与细胞的生命活动,继而影响疾病的发生、发展。大量研究证实miRNA 能够影响造血细胞的分化以及多种肿瘤细胞增殖、分化和凋亡,与白血病密切相关。在B-ALL中,下调miR-3173 能通过蛋白酪氨酸蛋白激酶2促进细胞的浸润[5]。miR-196b 在B-ALL 及T-ALL 中均低表达,可以通过结合C-myc癌基因的3'-端调控期转录[6]。同时,miR-196b/miR-1290 能通过调节ALL 中胰岛素样生长因子结合蛋白-3 的表达,参与白藜芦醇的抗肿瘤作用[7]。在融合基因型t(2 ∶11)(p21 ∶q23)白血病和t(11 ∶14)(q24 ∶q32)B-ALL中miR-125b 高表达,与白血病的发生紧密相关[8]。结合临床分析发现,miR-125b 与儿童ALL 的德国柏林法兰克福蒙斯特化疗方案的不良疗效相关[9]。miR-16 在生存期长的患者组表达,高于生存期短的患者组,可作为T-ALL 的候选预后指示靶标[10]。回顾以往研究,多种miRNA 参与ALL 的发病,影响药物的治疗效果,甚至与预后相关[10]。但还没有针对儿童B-ALL初发和复发患者血液中的单核细胞miRNA 表达谱差异的研究,而这些差异表达的miRNA 可能成为临床治疗的靶标分子和判断预后的辅助指标。
1 资料与方法
1.1 一般资料
采集3 例初发B-ALL[初发组(EX1):EX1 1、EX1 2、EX1 3]、3 例复发B-ALL 患者[复发组(EX2):EX2 1、EX2 2、EX2 3]及3 例无血液疾病的健康儿童[对照组(control):control 1(NS815619)、control 2(NS706165)、control 3(NS596963)]的外周血。ALL 分型采用细胞形态学和免疫表型诊断。诊断标准满足骨髓中原始/幼稚淋巴细胞比例≥20%,疾病分型参照WHO 2016 版分类标准,免疫分型采用多参数流式细胞术。形态学:细胞大小不一,胞浆量少,核浆比较高;胞浆呈蓝色,可见空泡;核呈圆形或不规则形,偶见切迹及凹陷;染色质细致-粗超;可见核仁1~3 个。标志物:CD19+、人类白细胞抗原-DR(HLA-DR)+、末端脱氧核苷酸转移酶(TdT)+、cCD79a+。复发诊断标准:①骨髓原始淋巴细胞+幼稚淋巴细胞>5%~<20%,经过抗白血病治疗1 个疗程仍未达到骨髓完全缓解者;②骨髓原始淋巴细胞+幼稚淋巴细胞>20%者;③髓外白血病细胞浸润者;有其中三者之一视为复发。
1.2 方法
1.2.1 分离细胞3 ml EDTA 抗凝血中加入等体积Ficoll 分离液(德国Sigma 公司,10771),1 400 r/min离心20 min,取上、中层界面的单个核细胞层,用D-Hank's 液(北京百奥莱博科技有限公司,SJ0724)洗涤、1 050 r/min 离心5 min,重复1 次,取部分细胞重悬于生理盐水中检测细胞数及红细胞的分离效果。剩余部分加入Trizol[赛默飞世尔科技(中国)有限公司,15596-026]混匀后保存于超低温冰箱备用。
1.2.2 核酸提取及建库通过Trizol 裂解细胞,采用酚/氯仿抽提分离DNA 和RNA,吸取水相层与异丙醇混匀沉淀RNA,75%乙醇洗涤2 次获得细胞总RNA。琼脂糖电泳分析RNA 降解程度,Nanodrop [赛默飞世尔科技(中国)有限公司]检测OD260/OD280 比值。使用Small RNA Sample pre Kit(中国北京Illumina 有限公司,RS200-0012)构建文库,Qubit[赛默飞世尔科技(中国)有限公司]定量RNA 浓度,Agilent 2100[安捷伦科技(中国)有限公司]精确检测RNA 完整性,上机进行HiSeq 检测。
1.3 统计学方法
高通量测序平台下机的原始数据,结合对测序序列(reads)、比对(mapped)和测序质量的综合分析,对筛选得到的sRNA 进行种类和数量分析。其中,利用miR Evo-v1.1 分析已知miRNA 数,整合miR Evo-v1.1 和miR deep2-0-0-5 预测新miRNA。差异表达分析使用基于负二项分布的DESeq2[11],进一步行K-means/SOM 聚类分析。利用miRanda、PITA 和RNAhybrid 取交集行靶基因预测,然后通过GO[12]和KEGG[13]进行富集分析。Student-t检验计算不同样本间各参数的差异,针对有生物重复的同一实验组内的样本,使用DESeq R package(1.8.3)对不同组进行差异表达分析。P值使用Benjamini-Hochberg 方法进行矫正,P<0.05 为差异有统计学意义。
2 结果
2.1 各个标本miRNA 检测结果
对测序获得的原始数据进行筛选并选择长度在18~35 nt 的sRNA,与miR Base 数据库中指定范围序列进行比对,获得匹配上的sRNA 信息,包括比对上的miRNA 成熟体,miRNA 前体,sRNA 种类,sRNA个数。最终鉴定到的已知miRNA 成熟体(mature)和前体(hairpin)及novel miRNA(新的非同源miRNA)成熟体和前体的个数。见表1。
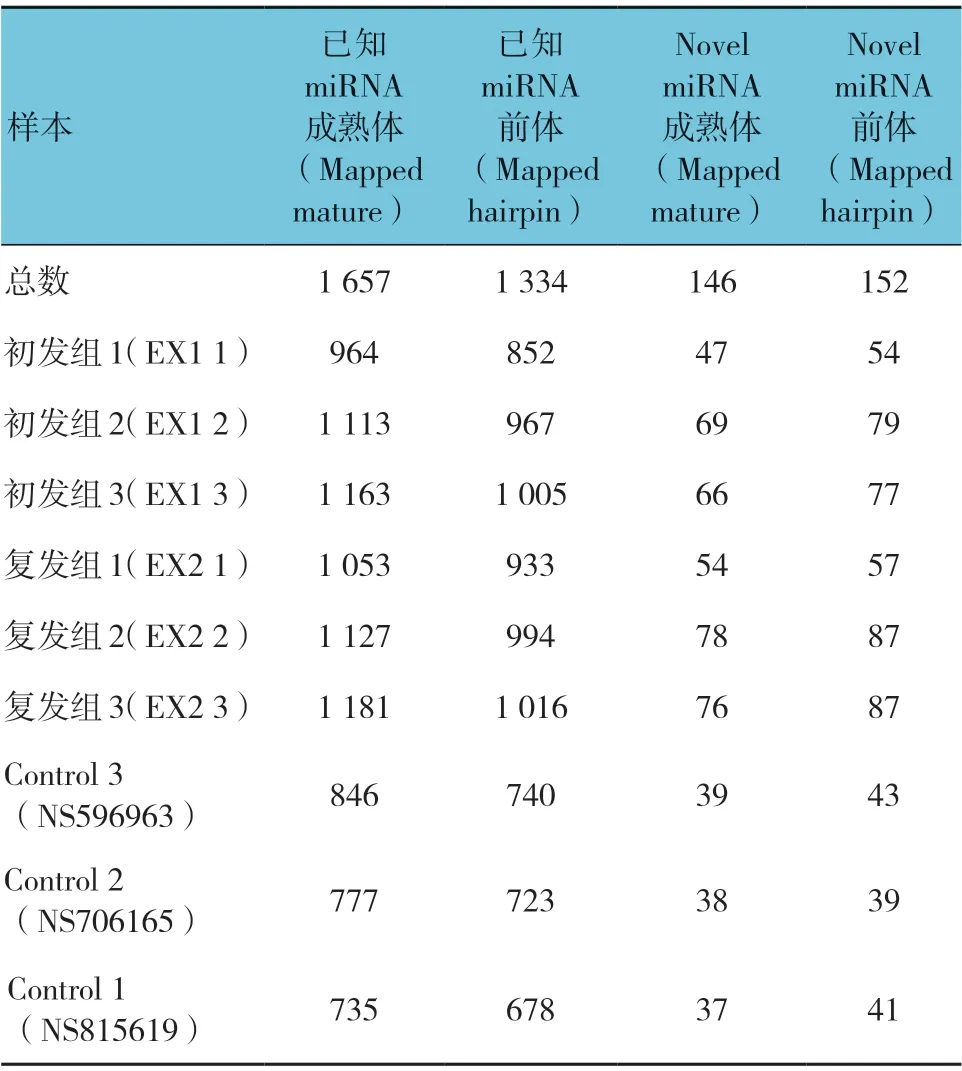
表1 鉴定的miRNA 及预测的相关miRNA
2.2 差异miRNA 的筛选
B-ALL 疾病组与对照组的miRNA 表达谱存在差异。统计测序所得miRNA 表达量(已知miRNA 及新miRNA),并利用每百万条reads 的转录本(transcripts per million,TPM)进行表达量归一化处理(公式为:单一miRNA reads 数×106/总reads 数),来校准miRNA 的表达量,根据TPM 密度分布,各样本的基因表达模式见图1A。通过计算Pearson 相关系数的平方,反映实验组内独立样本间基因表达水平相关性,结果显示每组内的3 个独立样本的相似度较高(见图1B)。其中,对照组的R2>0.922,复发组的R2>0.886,初发组的R2>0.896(1.00,完全相关;0.70~<1.00,高度相关;0.40~<0.70 中度相关;0.10~<0.40,低度相关;<0.10,微弱或无相关)。
通过差异倍数(fold change)和校正后的水平(校正后Padj/ Qvalue)评估每组样本之间miRNA 的表达差异,筛选出差异的miRNA,结果显示EX1 VS control,173 miRNA 上调,193 miRNA 下调,EX2 VS control,176 miRNA 上调,201 miRNA 下调,存在较多差异表达的miRNA。但是EX1 vs EX2,10 miRNA上调,10 miRNA 下调,存在表达差异(见图2)。
每个实验组均含有3 个样本(初发组、复发组、对照组),即生物学重复,所以根据校正后P<0.05 的条件筛选获得20 个差异表达的miRNAs,其中差异较大的5 个miRNA 分别为has-miR-30a-3p,has-miR-30a-5p,has-miR-30c-2-3p,has-miR-139-5p,hasmiR-99b-5p。见表2。
2.3 差异miRNA 分析
利用疾病组和对照组之间的两两比较所得miR集的并集在每个组/样本中的TPM 值,进行层次聚类分析(见图3A)。将差异miRNA 进行统计,绘制差异miRNA 维恩图,反映各组样本的miRNA 差异表达集(见图3B)。
2.4 靶基因预测及富集分析
根据基因功能国标标准分类体系,结合筛选到的差异表达miRNA 靶基因(候选靶基因),获得Gene Ontology 富集分析结果(见表3)。差异表达miRNA对应靶基因主要功能集中在细胞质、细胞内组分、蛋白结合、细胞内、细胞质部分。
结合3 种基本分类[生物学过程(BP)、细胞成分(CC)、分子功能(MF)],针对EX1 VS EX2,大部分的候选靶基因功能为CC,少数为BP 和MF(见图4)。
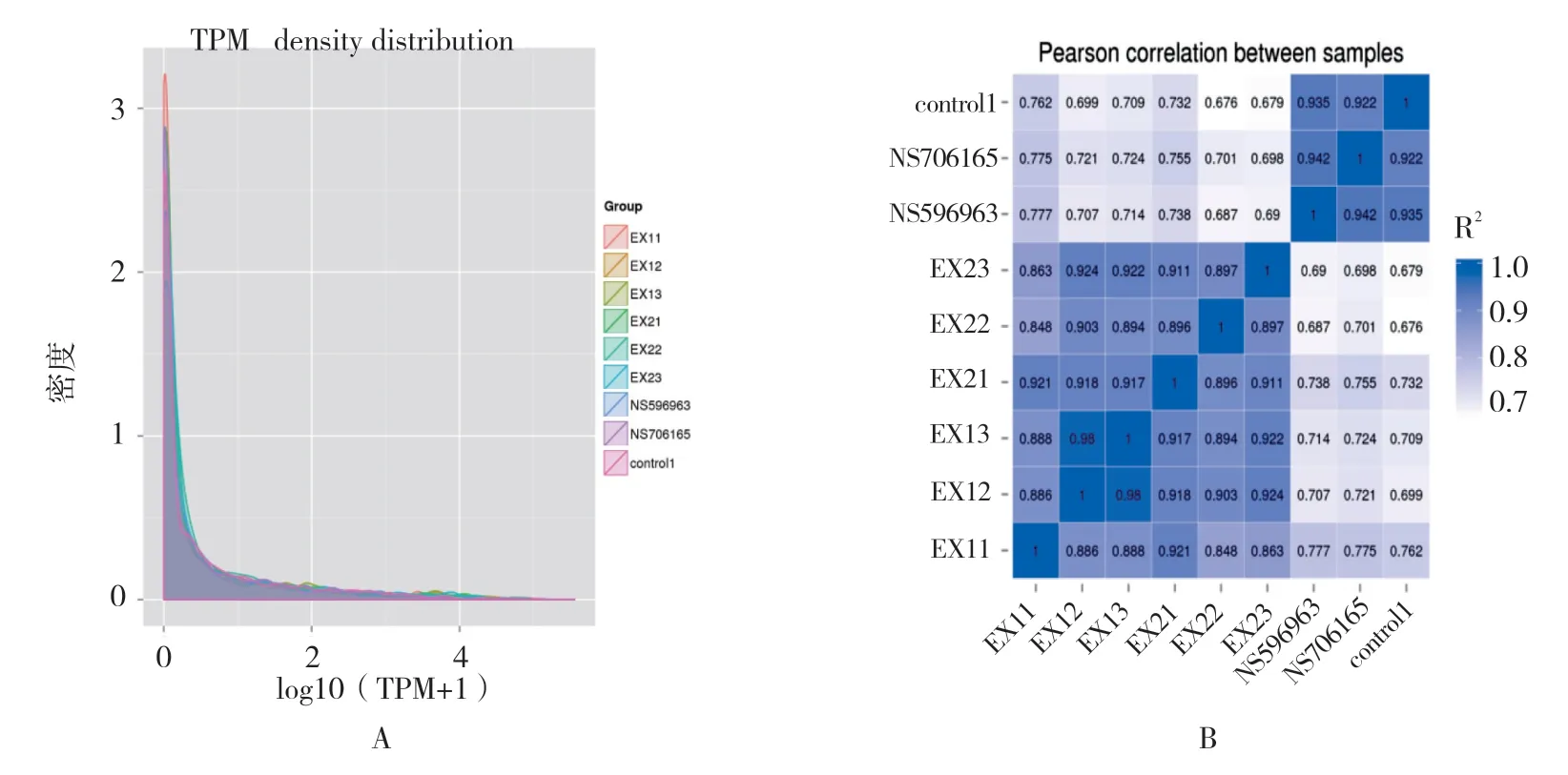
图1 样本miRNA 表达量TPM 密度分布及样品间相关性

图2 差异miRNA 的火山图
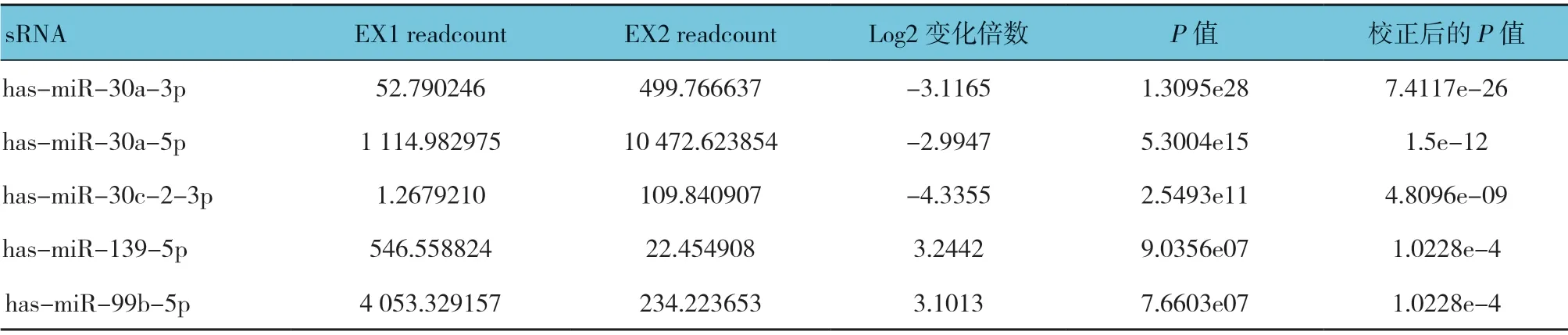
表2 miRNA 表达差异分析结果(前5)
根据KEGG 公共数据库,基于复发组和初发组差异表达miRNA 对应的候选基因,富集的Pathway 前4名包括糖代谢、AMPK 信号通路、甘氨酸/丝氨酸/苏氨酸代谢、mTOR 信号通路,但校正后的P值差异无统计学意义(见表4)。
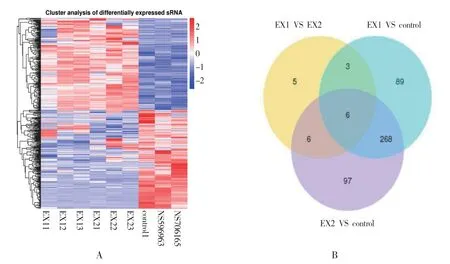
图3 差异表达miRNA 集及其聚类分析

表3 样品中候选靶基因的Gene Ontology 富集列表(前5)
图4 候选靶基因GO 富集柱状图
表4 候选靶基因KEGG 显著性富集列表(前4)
3 讨论
ALL 疾病的发生是多种遗传学与分子生物学异常的综合结果,目前其临床治疗以化疗为主,儿童ALL治疗缓解率较高。但是一旦出现复发,患儿的治疗效果会明显降低,甚至死亡。另外,研究发现miRNA 参与包括DNA 修复、病毒防御、发育、造血过程、细胞增殖、细胞凋亡等很多生物过程,研究ALL 发病中miRNA 的作用机制具有重要意义。miRNA 可以为ALL 分型提供参考,有研究组通过对比T-ALL 和B-ALL 的miRNA 表达情况,筛选获得不同型急性淋巴细胞白血病的差异表达miRNA[14]。同时,有研究提出可将miRNA 作为区分判断急性髓系白血病和ALL的参考因素[15]。针对B-ALL,还有研究专门针对儿童发病人群,筛选到发病预测分子靶标(miR-326)。本研究通过对比复发和初发患者miRNA 表达谱,分析miRNA 在复发的ALL 病例中的差异变化,发现20 个差异表达的miRNA,可能为筛选今后区分复发和初发ALL 患者的靶标提供参考,为白血病发病机制研究提供新思路。
除此以外,miRNA 与ALL 的疾病发展和临床治疗密切相关。在动物模型中,共表达miR-125b 和Bcr/Abl 融合基因能使小鼠患白血病[8],提示miRNA直接参与了白血病的发病。通过统计分析397 例ALL儿童患者不同药物的化疗效果和其miRNA 表达情况,发现miRNA 与药物疗效之间密切关联[16]。本研究发现,复发患者和初发患者差异表达的5 个miRNAs:has-miR-30a-3p,has-miR-30a-5p,has-miR-30c-2-3p,has-miR-139-5p,has-miR-99b-5p。其中,miR-30a 被证实在ALL 中和MYC 及MYBL2 癌基因的调控相关[17-18]。miR-30a-5p 在乳腺癌、肠癌和非小细胞肺癌中的异常表达,影响癌症的发展和治疗效果[19-22],提示miR-30a 可以作为肿瘤治疗的候选靶点。miR-139-5p 在髓系白血病和T-ALL 中表达受到抑制,可能作为肿瘤候选治疗靶点[23-25]。并且miR-30a 和miR-139-5p 均在肿瘤中参与P53信号的调 控[23,26]。本研究结果显示,B-ALL 复发组与初发组中miR-30a 和miR-139-5p 的差异表达,提示复发B-ALL 中P53 信号通路可能发挥重要作用。has-miR-30c-2-3p 和has-miR-99b-5p 与白血病相关的研究报道较少,有研究发现慢性粒细胞白血病中检测到miR-99b下调,在1 项筛选白血病相关的研究中发现髓系白血病中miR-30c 下调[26-27]。结合本研究结果中miR-30c和miR-99b 表达量在初发和复发组之间发生改变,提示其可能在B-ALL 复发期间分别发挥抑制或促进作用。
差异表达的miRNA 候选靶基因在疾病组与正常对照组和复发组与初发组间的富集结果存在差异,值得注意的是,复发组与初发组间候选靶基因GO 富集结果提示大部分基因属于细胞成分分类。提示复发与初发期比较,包括细胞质、细胞内、细胞表面蛋白结合等细胞结构可能发生变化。同时,糖代谢异常是影响白血病预后的因素之一,本研究中复发组与初发组间的差异预示糖代谢在复发过程中发挥促进作用[28]。结合LKBI-AMPK-mTOR 信号通路在调节细胞代谢、生长、增殖和凋亡中发挥重要作用的前期研究结论[29],即使矫正P>0.05,但其调控miRNA 变化倍数大于2,可推测其参与B-ALL 的复发,但具体的调控作用,需进一步的研究。总的来说,对复发B-ALL 与初发B-ALL 的区别研究,将为更准确地探讨ALL 发病机制提供思路,筛选其差异表达miRNA 谱从miRNA 水平为B-ALL 的研究提供了数据基础。
