脉冲强光对多酚氧化酶活性及结构特性的影响
2020-10-09赵震震马丹妮蔡金秀曹少谦戚向阳
赵震震 马丹妮 蔡金秀 曹少谦 张 镜 戚向阳
(1浙江万里学院生物与环境学院,浙江 宁波 315100; 2 浙江医药高等专科学校食品学院,浙江 宁波 315100)
果蔬在加工贮藏中易发生酶促褐变[1],而钝化酶活性可以有效抑制褐变,减少酚类、维生素等营养功能成分的流失。热处理是最常用的钝酶方法,有研究表明热处理在取得良好钝酶效果的同时,其产生的热效应易造成热敏性成分的损失[2-3]。脉冲强光(intense pulsed light,IPL)是由脉冲强光装置通过氙灯电离作用产生的一段覆盖紫外到红外(200 ~1 100 nm)的脉冲光谱,具有瞬时、低功耗、高能量、低热量等特点[4]。自1996年被美国FDA 批准应用于食品加工以来,人们对IPL 的杀菌效果、机制,以及其对食品品质的影响进行了较多研究[5-7],IPL 在食品加工领域的独特优势逐渐被人们所认识。据报道,IPL 主要通过光化和光热作用对微生物细胞壁、核酸等结构造成不可逆损伤,达到杀菌效果[8-9],且在提高果蔬制品中总酚、维生素等功能营养物质含量方面效果显著[10-12]。但有关IPL钝酶及相关机理方面的报道相对较少。王正东等[13]研究发现,在pH 值3.2 条件下,500 J·cm-2IPL 处理7次可以钝化54.7%的杨梅多酚氧化酶(polyphenol oxidase,PPO)活性;刘亮等[14]研究表明,与紫外线照射相比,IPL 处理钝化水蜜桃PPO 活性的速度更快。在钝酶机制方面,Pellicer 等[15-17]探讨了IPL 对辣根过氧化物酶、蘑菇PPO 及多聚半乳糖醛酸酶活性及结构的影响,结果表明,IPL 处理能打断蛋白分子间二硫键,改变蛋白疏水性,破坏蛋白二级和三级空间结构,使蛋白结构展开松散。但对于IPL 处理后蛋白分子间是否会发生重组交联,形成蛋白聚集体尚需进一步研究。故本研究以PPO 为对象,考察IPL 处理对其活性和结构特性的影响以及IPL 处理对蛋白分子交联和聚集的影响,以期为IPL 在果蔬制品加工中的应用及开发提供一定的参考。
1 材料与方法
1.1 材料与试剂
PPO(870 U·mg-1),购于生工生物工程(上海)股份有限公司;左旋多巴(levodopa,L-DOPA,纯度99%),上海阿拉丁生化科技股份有限公司;8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS),美国Sigma 公司;5,5-二硫代-2-硝基苯甲酸[5,5′-dithio bis-(2-nitrobenzoic acid),DTNB],上海阿拉丁生化科技股份有限公司;Tris、甘氨酸(Gly),索莱宝科技有限公司; 乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、磷酸二氢钠、磷酸氢二钠,均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
ZWS-Y1-D2 型脉冲强光杀菌试验台,宁波中物光电杀菌技术有限公司;721G 可见分光光度计,上海菁华科技仪器有限公司;TU-1810 紫外可见分光光度计,北京普析通用电器有限责任公司;DK-8D 数显控温水浴锅,上海维诚仪器有限公司;F-380 荧光分光光度计,天津港东科技发展股份有限公司;MOS-500 圆二色光谱仪,法国Biological 公司;PowerPacTMBasic 电泳仪及Universal HoodⅡ凝胶成像系统,美国Bio-Rad公司。
1.3 试验方法
1.3.1 PPO 活性测定 参考王正东等[13]的方法,并稍作修改。分别用pH 值6.8 的0.05 mol·L-1磷酸盐(phosphate buffer saline,PBS)缓冲液配制3 mmol·L-1的L-DOPA 底物溶液与0.4 mg·mL-1的PPO 酶溶液。反应体系为2.8 mL 底物溶液加上0.2 mL 酶溶液,在475 nm 波长处测定吸光度值,每隔30 s 记录一次,以吸光度值对反应时间作图,记录呈良好线性关系的初始反应时间内的吸光度值。定义每分钟内吸光度值变化0.001 为1 个酶活力单位,单位为U·min-1。IPL 对PPO 活性的影响用酶活残存率来表示,根据公式计算:

1.3.1.1 IPL 能量对PPO 活性的影响 取5 mL PPO酶溶液于直径90 mm 塑料培养皿中,使其均匀铺满皿底,然后置于脉冲装置室内氙灯正下方处,固定脉冲次数为30 次,脉冲板间距为12 cm,分别在100、200、300、400、500 J 脉冲能量下进行IPL 处理,然后测定酶活性。
1.3.1.2 IPL 次数对PPO 活性的影响 取5 mL PPO酶溶液于直径90 mm 塑料培养皿中,使其均匀铺满皿底,然后置于脉冲装置室内氙灯正下方处,固定脉冲能量为500 J,脉冲板间距为12 cm,分别在10、15、20、25、30 次脉冲次数下进行IPL 处理,然后测定酶活性。
1.3.1.3 IPL 板间距对PPO 活性的影响取5 mL PPO 酶溶液于直径90 mm 塑料培养皿中,使其均匀铺满皿底,然后置于脉冲装置室内氙灯正下方处,固定脉冲能量为500 J,脉冲次数为30 次,分别在9、12、15、18、21 cm 脉冲板间距下进行IPL 处理,然后测定酶活性。
1.3.2 PPO 结构特性测定 为了探究IPL 处理下PPO 失活的相关机制,进一步考察了在脉冲能量500 J,脉冲板间距12 cm,脉冲次数分别为0、20、40、60、80条件下,PPO 表面疏水性、游离巯基含量、内源荧光强度等蛋白结构特性的变化。
1.3.2.1 表面疏水性测定 采用ANS 荧光探针法[18]。用PBS 缓冲液将IPL 处理过的PPO 样品溶液稀释至0.01~0.10 mg·mL-1,然后取1 mL 稀释样液,向其中分别加入50 μL 8 mmol·L-1的ANS 荧光指示剂,涡旋混匀后于暗室静置10 min,然后利用荧光分光光度计测定荧光强度。设定激发波长390 nm,发射波长470 nm,狭缝宽度5 nm,高压700 Ⅴ,增益1,重复扫描3 次。以荧光强度对蛋白浓度作图,所得良好线性关系直线斜率即为蛋白表面疏水性。
1.3.2.2 内源荧光光谱扫描 参考邱春江[19]的方法。取0.2 mL IPL 处理过的PPO 样品溶液于微量荧光比色皿中,利用荧光分光光度计测定荧光强度。设定激发波长293 nm,发射波长300 ~450 nm,激发、发射狭缝5 nm,扫描速度240 nm·min-1,高压700 Ⅴ,增益1,重复扫描3 次。以PBS 缓冲液代替样品作空白对照。
1.3.2.3 游离巯基含量测定 采用Ellman 法,参考贝君等[20]的方法,并稍作修改。分别添加2 mL Tris-Gly 缓冲液(1.04 g Tris、0.69 g Gly、0.12 g EDTA 用蒸馏水定容至100 mL)、0.2 mL Ellman 试剂(0.2 g DTNB 溶于50 mL 缓冲液)于1 mL IPL 处理过的PPO样品溶液中,涡旋混匀后于室温放置15 min,在412 nm 波长处测定吸光度值。按照公式计算巯基含量(sulfydryl,-SH,μmol·g-1):
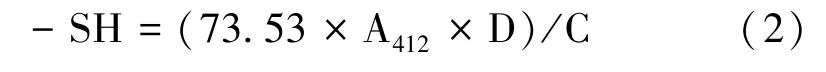
式中,A412为412 nm 波长处的吸光度值;D 为样品稀释倍数;C 为样品浓度,mg·mL-1。
1.3.2.4 SDS-PAGE 电泳 参考Laemmli[21]的方法。配制浓度5%的浓缩胶和浓度10%的分离胶,分别在还原和非还原条件下进行。非还原条件下的蛋白上样缓冲液中不含β-巯基乙醇。蛋白上样量20 μL,Marker 上样量3 μL。浓缩胶电泳电压60 Ⅴ,分离胶电泳电压120 Ⅴ。凝胶经考马斯亮蓝染色,脱色液脱色后用凝胶成像系统拍照。
1.3.2.5 圆二色光谱扫描 参考Kuznetsova 等[22]的方法。取0.2 mL IPL 处理过的PPO 样品溶液于光程1 mm 的石英比色皿中,在190 ~250 nm 波长处利用圆二色光谱仪进行扫描,以PBS 缓冲液为背景扣除本底,重复扫描3 次。扫描图谱经Bio-Kine 软件平均残基椭圆率单位转换后,执行Dicroprot 软件中K2D 程序进行二级结构含量分析。
1.4 数据处理
使用GraphPad Prism 软件绘图,SPSS Statistics 软件进行Duncan(D)方差分析,显著性水平为P<0.05,数据以平均值±标准偏差(mean±SD)表示。
2 结果与分析
2.1 IPL 处理对PPO 活性的影响
由图1可知,PPO 酶活残存率随着脉冲能量和次数的增加及脉冲板间距的减小不断降低,在脉冲能量500 J、脉冲30 次、脉冲板间距9 cm 条件下,PPO 酶活残存率不足40%。

图1 IPL 处理对PPO 酶活残存率的影响Fig.1 Effect of IPL treatment on residual activity rate of PPO
2.2 IPL 处理对PPO 结构特性的影响
2.2.1 表面疏水性 表面疏水性是蛋白质的重要特性之一,其在蛋白质功能性质的发挥方面具有重要作用[19,23]。由图2可知,随着IPL 处理次数的增加,PPO 表面疏水性显著增强。
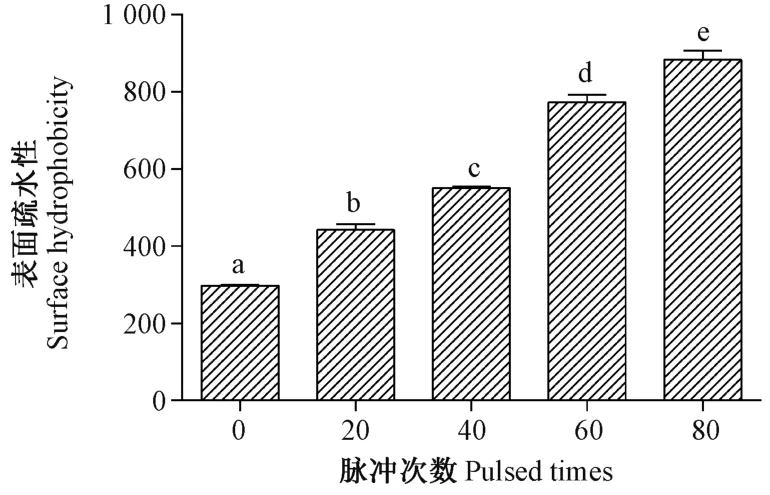
图2 IPL 处理对PPO 表面疏水性的影响Fig.2 Effect of IPL treatment on surface hydrophobicity of PPO
2.2.2 内源荧光光谱扫描 内源荧光光谱通常用于蛋白三级结构的检测。由图3和表1可知,未进行IPL 处理时,在338 nm 波长处发射出最强荧光,随着IPL 处理次数的增加,荧光强度不断降低,当IPL 处理次数达到80 次时,荧光强度降低约70%,而此时最佳发射波长也红移至344 nm,可见IPL 处理后PPO 三级结构发生了改变。

图3 IPL 处理PPO 内源荧光光谱扫描图Fig.3 Intrinsic fluorescence spectra of PPO by IPL treatment

表1 IPL 处理对PPO 内源荧光强度的影响Table1 Effect of IPL treatment on the peak and fluorescence intensity of PPO
2.2.3 游离巯基含量 巯基是存在于半胱氨酸中的一种活泼基团,可以氧化形成二硫键,维持蛋白立体空间结构。由图4可知,随着IPL 处理次数的增加,PPO游离巯基含量显著增加,在IPL 处理20、40、60、80 次后PPO 游离巯基含量分别由58.73 μmol·g-1显著上升至60.20、61.95、62.78、63.79 μmol·g-1。
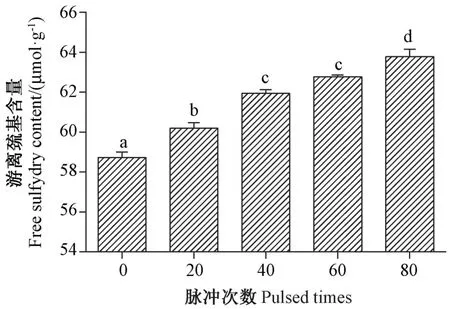
图4 IPL 处理对PPO 游离巯基含量的影响Fig.4 Effect of IPL treatment on free sulfhydryl content of PPO
2.2.4 SDS-PAGE 分析 为了进一步了解IPL 处理对蛋白结构的影响,分别对IPL 处理后的蛋白样品进行还原性和非还原性电泳试验。非还原条件下,电泳体系中SDS 能打断蛋白分子间非共价键,使得通过非共价键结合的蛋白亚基相互分离,但由于未引入还原剂β-巯基乙醇,无法分离通过二硫键结合的蛋白亚基;还原条件下,由于β-巯基乙醇的作用,蛋白分子内及分子间的二硫键被打断,致使蛋白电泳行为主要受分子量大小影响。因而,通过对比还原和非还原条件下电泳图可以分析蛋白共价聚集情况[24]。在非还原条件下,IPL 处理前后PPO 分别在70 kDa 和25 kDa产生一条重链(α 链)和一条轻链(β 链);而在还原条件下,IPL 处理前后PPO 除产生一条重链(a 链)和一条轻链(d 链)外,还在48 kDa 和50 kDa 产生两条中间分子量蛋白条带(b、c 链),表明非还原条件下α 链的蛋白聚集主要是二硫键共价结合的结果。此外,随着IPL 处理次数的增加,a、b、c、d 及α 链条带亮度逐渐降低,且在IPL 处理80 次后,α 链条带基本消失,表明PPO 蛋白受IPL 处理的影响发生了降解[25]。
2.2.5 圆二色光谱扫描 圆二色光谱扫描是研究蛋白二级结构常用的一种方法。蛋白质4 种主要的结构α-螺旋、β-折叠、β-转角和无规则卷曲在不同波长下有不同的特征吸收峰,通常认为208 nm 和222 nm 波长处的两处负峰为α-螺旋结构特征吸收峰[26],峰值大小表示结构含量的高低。由图6可知,未进行IPL处理时,在210 nm 和220 nm 波长处有两处明显的负吸收峰,但随着IPL 处理次数的增加,210 ~230 nm 波长范围内平均残基椭圆率不断降低,峰也逐渐变得平缓,且210 nm 峰位向左蓝移,说明IPL 处理改变了PPO 二级结构,使得α-螺旋含量下降[22]。结合表2中K2D 程序分析的PPO 二级结构含量变化可知,与未处理组相比,当IPL 处理20、40、60、80 次后,α-螺旋结构含量分别下降了8、14.67、17、21 个百分点,相反,β 型结构分别上升了9、15.66、17.33、21.33 个百分点,而无规则卷曲结构含量几乎不变。

表2 IPL 处理对PPO 二级结构含量的影响Table2 Effect of IPL treatment on the content of PPO secondary structure /%
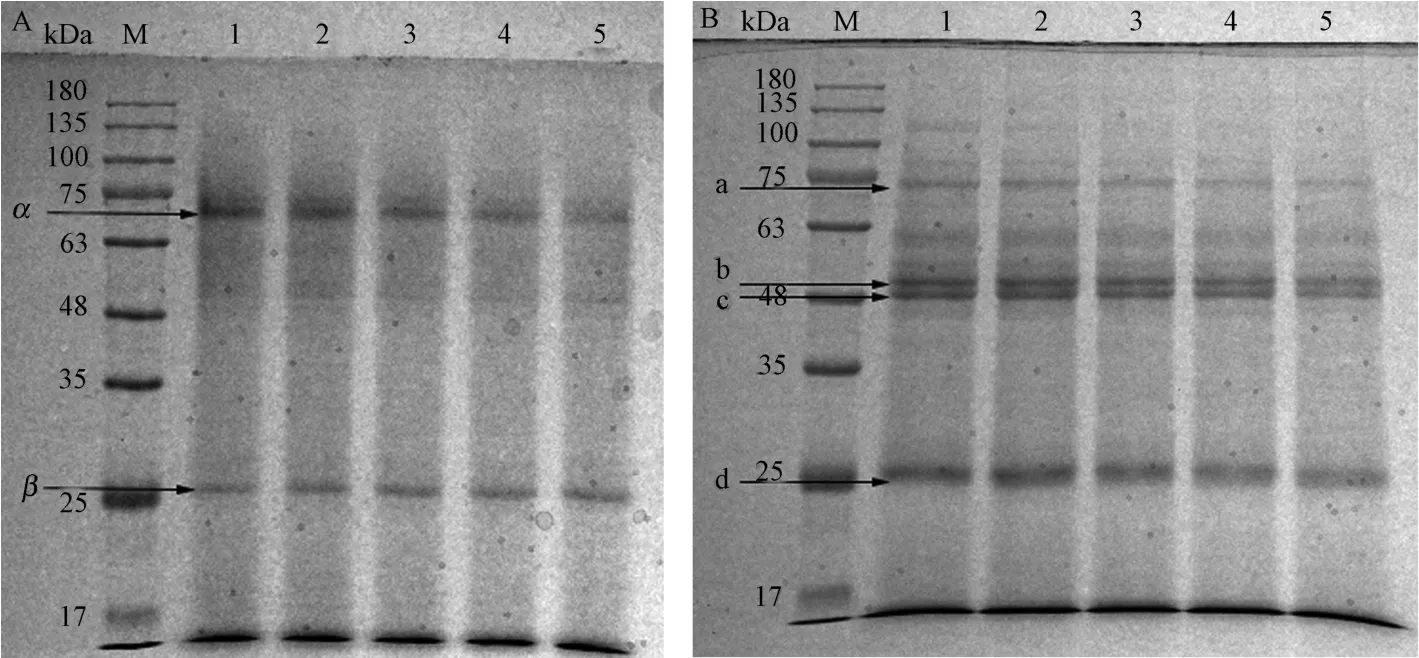
图5 IPL 处理PPO 凝胶电泳图Fig.5 SDS-PAGE patterns of PPO by IPL treatment
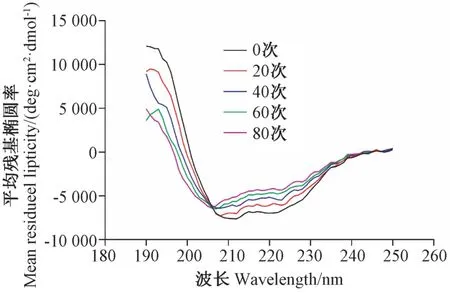
图6 IPL 处理PPO 圆二色光谱扫描图Fig.6 CD spectra of PPO by IPL treatment
3 讨论
本研究结果表明,增加单次脉冲能量及脉冲次数或降低脉冲间距均能降低PPO 活性。通过分析PPO蛋白结构发现,IPL 处理使蛋白结构展开,内部疏水性基团暴露,引起表面疏水性增加[27]。而且该结果通过内源荧光强度测定进一步得到验证。色氨酸是组成蛋白质的一种疏水性氨基酸,当其在蛋白质内部时,具有较高的量子产率,293 nm 波长下可以激发出较强的荧光;但当蛋白发生去折叠反应,色氨酸从蛋白内部暴露出来时,量子产率开始下降,荧光强度也随之下降[19,28],因而可以作为内源荧光探针检测蛋白内部疏水内核微环境的变化。本研究发现,随着IPL 处理次数的增加,内源荧光强度不断降低,最佳发射波长逐渐红移,表明PPO 蛋白结构展开,色氨酸更多地从蛋白内部暴露出来,所处环境极性上升。前人研究也表明IPL 处理能降低蘑菇PPO[16]及多聚半乳糖醛酸酶[17]的色氨酸荧光强度。
二硫键由巯基氧化而成,其作为一种共价键对维持蛋白肽链三级空间结构起着重要作用。当蛋白结构展开时,通常伴随着二硫键的断裂[29]。由表面疏水性及荧光强度试验结果可知,由于蛋白结构展开松散,蛋白分子间的二硫键断裂,释放巯基,从而引起巯基含量升高。而非还原条件下电泳图中没有新的蛋白条带形成,也表明IPL 处理破坏的主要是蛋白亚基内的二硫键,对蛋白亚基间的二硫键影响较小。此外,由非还原条件下电泳结果可知,β 链条带亮度随着IPL 处理次数的增加不断增加,原因可能是PPO 蛋白降解形成的小分子多肽、氨基酸等物质的巯基发生氧化,诱导二硫键形成,促使蛋白交联聚集。这种蛋白降解、结构重组并引发交联聚集的现象通常认为是蛋白氧化的结果[30-31]。这与Wu 等[32]的研究结果一致,其通过质谱分析发现,近紫外光能打断二硫键,增加巯基含量,但也诱导了新的二硫键形成;Siddique 等[33]研究也发现,IPL 处理能打断二硫键,促使二聚体解离,同时诱导18.4 kDa 和14.2 kDa 蛋白分子形成二硫键,引起蛋白交联聚集。
此外,蛋白二级结构变化的分析结果表明,IPL 处理破坏了蛋白二级结构,随着IPL 处理次数的增加,PPO 二级结构α-螺旋和β 型结构含量分别呈现显著降低和升高,这与Pellicer 等[15]的研究结果一致。
4 结论
本研究结果表明,IPL 处理能够钝化PPO 活性,且钝化效果随着单次脉冲能量和脉冲次数的增加,以及脉冲板间距的减小逐渐增加。而PPO 失活原因可能与IPL 处理破坏二级和三级结构,使得蛋白结构展开,并氧化降解有关。本研究为揭示IPL 钝化PPO 活性机理及其在果蔬加工中的应用提供了理论依据。
