三穗鸭ORAI1基因遗传变异与蛋壳品质的相关性
2020-10-09谭光辉李杰章覃媛钰张依裕
谭光辉, 李杰章, 覃媛钰, 吴 磊, 张依裕
(1.贵州大学动物科学学院;2.贵州大学高原山地动物遗传育种与繁殖教育部重点实验室,贵州 贵阳 550025)
众所周知,优质的蛋壳不仅能降低蛋的破损率,而且能有效防止病菌等微生物侵入蛋内,保障蛋制品的安全;此外,蛋壳还能调节代谢气体和水的交换,并为胚胎提供钙[1].据估计,将蛋壳平均强度提高1 N,每只母鸡每下一个周期的破蛋率将减少0.5%[2].可见,提高蛋壳品质对于减少蛋壳破损带来的经济损失、增强食品安全以及保证胚胎的正常发育有着重要意义.蛋壳在蛋壳腺中由大量的无机物沉积形成,其中,碳酸钙占总含量的93%,表明蛋壳品质的优劣与蛋壳腺中的Ca2+量有直接关系[3].钙释放激活钙调节蛋白1是ORAI的家族成员之一,该基因编码的蛋白广泛表达于动物各种类型的细胞中,主要定位于细胞膜上,是一种操控Ca2+进出细胞的膜蛋白,它的关闭与打开受到细胞内钙库(内质网或肌浆网)中Ca2+浓度的严格调控[4-7].Dong et al[8]研究揭示,ORAI1基因能够控制细胞Ca2+内流,Ca2+内流通过ORAI1基因通道间歇性激活.钙释放酶激活钙调器1是Ca2+通道的一个亚型,能够调控细胞中Ca2+的浓度,进而调节细胞的增殖与凋亡[9-10].此外,Woo et al[11]研究表明,ORAI1基因可能是肌肉肥大中Ca2+信号改变的原因之一.Dou et al[12]在敲除小鼠ORAI1基因后,发现小鼠神经细胞中Ca2+的浓度发生改变,显著降低了有害刺激引起的急性疼痛.综上研究表明,ORAI1基因编码的蛋白作为调控Ca2+进出细胞的膜蛋白,可能通过调节Ca2+流入细胞进而影响动物的表型现状.近年来,ORAI1作为一种存在于质膜中的高度Ca2+选择性通道,尽管其生物功能在老鼠和人上已经得到广泛的研究,但在家禽上的研究甚少.本研究通过检测鸭ORAI1基因的遗传变异,探讨其与蛋壳品质的关联性,为从分子角度改善蛋壳品质提供参考.
1 材料与方法
1.1 材料
在贵州大学动物科学学院农场中随机选择单体笼饲养、健康无病及同等管理条件下的45周龄三穗鸭102只,收集并记录一周内每只鸭产下的蛋(共630枚).鸭逐只静脉采血1.0~1.5 mL用于基因组DNA的提取.
1.2 蛋壳品质的测定
参照文献[13]的方法测定630枚鸭蛋的蛋形指数及蛋壳的厚度、强度、重量,收集每只鸭7 d产下的蛋,测定蛋壳品质数据,求平均值.用清水洗去附着在蛋外壳的粪便,用镊子夹去内膜后用BL-320H型电子天平(日本岛津公司)测量蛋壳重(g);蛋的长度和宽度用游标卡尺(武汉道简贸易有限公司)测量,蛋的形状指数为长度与宽度之比(长度/宽度);采用ETG-1061型蛋壳厚度测定仪(北京天翔飞域仪器设备有限公司)在钝性、赤道性和锐性区域测量不带内膜的蛋壳厚度(精确度0.01 mm),取3个值的平均值为蛋壳厚度;用EFR-01型蛋壳压力计(北京天翔飞域仪器设备有限公司)测定蛋壳强度.
1.3 ORAI1基因遗传变异的检测
1.3.1 血液基因DNA的提取 用DNA提取试剂盒(天根生化科技有限公司)提取102只三穗鸭血液基因组DNA,用分光光度计检测D260 nm和D280 nm.根据D260 nm/D280 nm预测DNA的纯度,纯品DNA的D260 nm/D280 nm为1.6~1.9.用1.5% 琼脂糖凝胶电泳结合核酸浓度测定仪检测,稀释成最终浓度为100 ng·μL-1.
1.3.2 引物设计 根据NCBI GenBank数据库公布的鸭ORAI1基因外显子序列(NC_040061.1),采用在线Primer 3.0程序(http://primer3.ut.ee/)设计的引物(表1)交由生工生物工程(上海)股份有限公司合成.
1.3.3 DNA池的PCR扩增程序及测序分型 PCR反应体系:8 μL 2×Es Taq MastermMix(北京擎科生物公司),正、反向引物(10 pmol·L-1)各1.0 μL,1 μL DNA,用dd H2O补足至20 μL.PCR扩增程序:于95 ℃预变性6 min;于94 ℃变性35 s,参考表1的温度退火40 s,于74 ℃延伸50 s,于72 ℃终延伸6 min,共38个循环.PCR扩增产物采用1.5%琼脂糖凝胶进行电泳检测,具有目的条带的送往生工生物工程(上海)股份有限公司测序.测序结果采用DNAStar软件中的MegaAlign程序初步筛选单核苷酸突变(single nucleotide polymorphism, SNP)位点.根据筛查结果选用相应的引物,以个体DNA为模板进行PCR扩增及测序分型.

表1 三穗鸭ORAI1基因的引物信息
1.4 数据处理
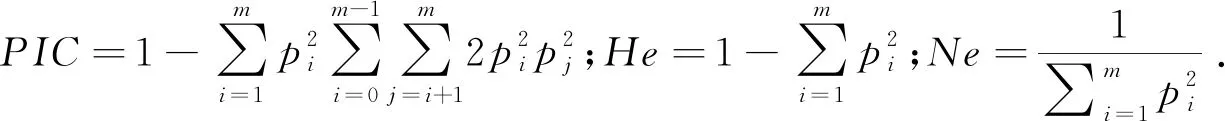
采用统计软件SPSS 18.0中的一般线性模型(GLM)单因素方差分析ORAI1基因SNP基因型与蛋壳品质的关联性.
2 结果与分析
2.1 三穗鸭ORAI1基因SNP位点的筛查与鉴定
将ORAI1基因在NCBI GenBank数据库中公布的序列与PCR扩增后测序得到的序列运用MegaAlign程序进行比对,查找SNP,结果如图1所示.在三穗鸭ORAI1基因第3外显子发现3个SNP位点,分别是g.16789 C>T、g.16984 C>T和g.17074 A>G,分别位于CDS区的第186、381和471位,均产生3种基因型.进一步分析发现,3个SNP位点未引起氨基酸的改变,属于同义突变.
2.2 三穗鸭ORAI1基因3个SNP位点的遗传特性
三穗鸭ORAI1基因3个SNP位点遗传参数的分析结果(表2)显示:g.16789 C>T、g.16984 C>T和g.17074 A>G 3个位点的优势基因型分别是CC、CC和AA,其频率分别为0.529、0.529和0.588;优势等位基因分别是C、C和A,其频率分别为0.647、0.647和0.735;3个SNP位点均属于中度多态(0.25

表2 三穗鸭ORAI1基因3个SNP位点的遗传参数1)
2.3 三穗鸭ORAI1基因3个SNP位点连锁不平衡分析
对三穗鸭ORAI1基因3个SNP位点进行连锁不平衡分析.结果(表3)显示:g.16789 C>T位点与g.16984 C>T位点之间的D′值为1,γ2值为0.998;g.16789 C>T位点与g.17074 A>G位点之间的D′值为1,γ2值为0.196;g.16984 C>T位点与g.17074 A>G位点之间的D′值为1,γ2值为0.185.根据Ardlie et al[14]和Slatkin[15]的报道,当|D′|>0.8,γ2>0.33时,SNP位点间存在强连锁不平衡,因此从本研究结果来看,3个SNP位点之间只有g.16789 C>T位点与g.16984 C>T位点存在强连锁不平衡.

表3 三穗鸭ORAI1基因3个SNP位点的连锁不平衡D′和γ2值1)
2.4 三穗鸭ORAI1基因3个SNP位点的单倍型和双倍型分析
对三穗鸭ORAI1基因3个SNP位点进行单倍型和双倍型分析,结果(表4)显示:3个SNP位点在三穗鸭群体中共检测到3种单倍型和6种双倍型,其中,优势单倍型是H1,频率为0.382;劣势单倍型是H2,频率为0.265;优势双倍型是H1H1和H3H3,频率分别为0.335和0.235.
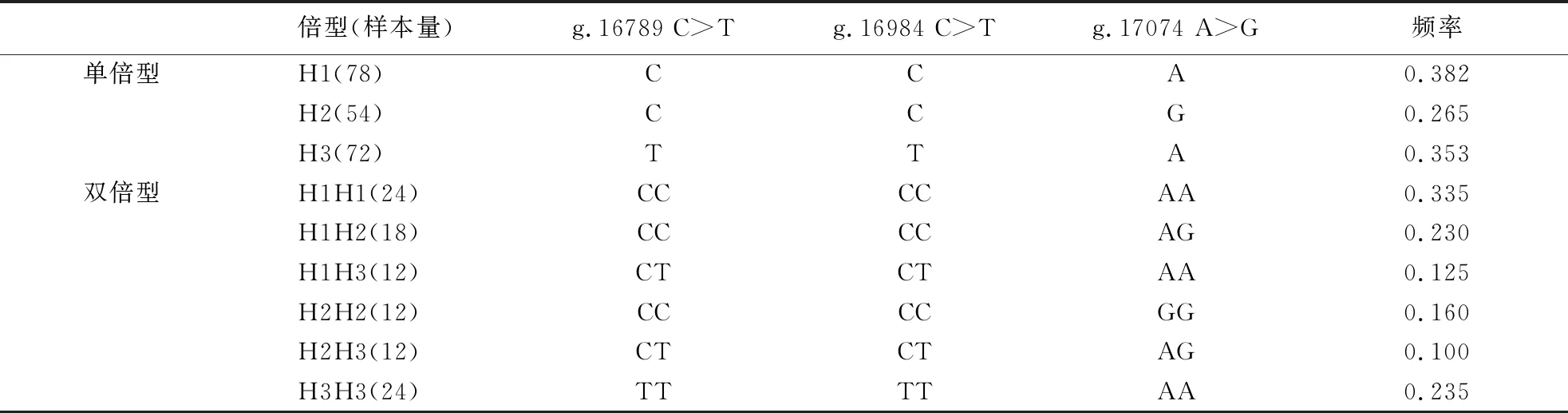
表4 三穗鸭ORAI1基因3个SNP位点的单倍型和双倍型频率
2.5 三穗鸭ORAI1基因3个SNP位点与蛋壳品质的关联性
三穗鸭ORAI1基因3个SNP位点与蛋壳品质关联性的分析结果(表5)显示,g.16789 C>T、g.16984 C>T和g.17074 A>G 3个位点均对蛋壳强度的影响达到显著水平(P<0.05).其中,g.16789 C>T和g.16984 C>T两个位点CT杂合基因型个体的蛋壳强度均显著高于TT纯合基因型(P<0.05),而g.17074 A>G位点GG基因型个体的蛋壳强度显著高于AG基因型(P<0.05).

表5 三穗鸭ORAI1基因3个SNP位点与蛋壳品质的关联性1)
2.6 三穗鸭ORAI1基因3个SNP位点双倍型与蛋壳品质的关联性
三穗鸭3个SNP位点组合基因型与蛋壳品质关联性的分析结果(表6)显示:H2H3和H3H3双倍型个体的蛋壳厚度显著高于H2H2型(P<0.05);H3H3型的蛋壳强度显著高于H2H2型(P<0.05);其他双倍型与蛋壳品质没有产生显著差异(P>0.05).

表6 三穗鸭ORAI1基因3个SNP位点双倍型与蛋壳品质的关联性1)
3 讨论
优质的蛋壳不仅能降低蛋在自动分拣包装和运输等过程中造成的物理损伤,而且能够阻挡有害病菌入侵蛋的内部,保障禽类胚胎的正常发育和食品安全.Onouchi et al[16]和Chang et al[17]研究表明,ORAI1作为Ca2+释放激活通道,介导存储操作的Ca2+进入质膜,位于ORAI1基因外显子2(rs3741596)非同义单核苷酸多态性与川崎病的发生显著相关,揭示ORAI1基因SNP影响Ca2+进入质膜,引起机体组织细胞中Ca2+的释放量从而影响细胞的增殖与凋亡.Lian et al[18]研究表明,ORAI1作为一种操控Ca2+进入细胞的膜蛋白,当ORAI1基因发生突变,能导致Ca2+进入细胞受阻,引起机体胚层发育不良和免疫缺陷.本研究在三穗鸭ORAI1基因第3外显子共检测到3个同义突变位点,可见三穗鸭ORAI1基因相对来说是比较保守的,突变位点较少.3个SNP位点除了g.17074 A>G 位点符合Hardy-Weinberg平衡(P>0.05)外,另外两个位点(g.16789 C>T、g.16984 C>T)的基因型分布均显著偏离Hardy-Weinberg平衡(P<0.05).Hardy-Weinberg平衡是在一个无限大的群体中,若个体之间随机交配,没有突变、迁移和遗传漂变,群体内一个位点上的基因型及其频率将保持代代不变,处于遗传平衡状态[19].因此,g.16789 C>T和g.16984 C>T两个位点可能受到突变、选择和遗传漂变等影响,也可能与本研究样本量较少有关,致使两个突变位点显著偏离Hardy-Weinberg平衡.连锁不平衡分析发现,g.16789 C>T位点与g.16984 C>T位点之间存在强连锁不平衡,揭示这两个SNP位点趋向整体遗传.
分子标记辅助选择是改善畜禽机体,使其更有利于人类生产发展所需的一种有效而简便的重要途径.本研究在三穗鸭3个SNP位点发现3种单倍型和6种双倍型,理论上应该有8种单倍型和36种双倍型,试验观测到的数据与理论值之间相差8种单倍型、30种双倍型,可能在现代集约化养殖的过程中,人工的选择培育致使其他单倍型和双倍型个体缺失或者在三穗鸭群体中本就没有其他单倍型和双倍型.3个SNP位点与蛋壳品质关联性的分析结果显示,g.16789 C>T 和g.16984 C>T位点对蛋壳强度的影响显著(P>0.05),其两个位点CT杂合基因型个体的蛋壳强度显著高于纯合TT基因型,而g.17074 A>G位点GG基因型个体的蛋壳强度显著高于AG基因型(P<0.05).蛋壳强度直接体现蛋壳的破损程度,高强度蛋壳在运输和储存过程中更有利于降低物理损伤.因此,初步判断CT和GG基因型是提高蛋壳品质相对有利的基因型.3个SNP位点组合基因型对蛋壳强度和厚度均有不同程度的影响,H2H3和H3H3双倍型个体的蛋壳厚度显著高于H2H2型(P<0.05),H3H3型的蛋壳强度显著高于H2H2型(P<0.05).前人研究表明,单核苷酸的替换,不管是同义突变还是错义突变,均有可能导致mRNA的剪切效应及剪切准确性的改变,而多个位点之间的联合对畜禽基因结构的调控作用更加强烈,它可能与该基因控制蛋壳品质关键功能位点连锁共同影响蛋壳钙的沉积[20-22].因此,多个位点结合对蛋壳品质的调控作用更加有效,更具有说服力.H2H2和H2H3双倍型对蛋壳厚度和强度的影响均达到显著水平,在分子标记辅助选择培育上,H2H2和H2H3双倍型作为标记位点可能比单个位点更具有参考价值.本研究由于样本量较少,致使部分双倍型个体数较少,因此,还需增加更多的实验样本,进一步确定关联结果;同时,应开展三穗鸭ORAI1基因3个SNP位点是否引起该基因构象变化的深入研究,进一步挖掘ORAI1基因与蛋壳品质密切相关的单倍型,提高育种进度.
