甜菜CPD基因家族生物信息学分析
2020-10-02朱晓庆李宁宁王玮张少英
朱晓庆,李宁宁,王玮,张少英
(内蒙古农业大学甜菜生理研究所,呼和浩特 010018)
0 引言
植物持续光形态建成与矮化基因(Constitutive photomorphogenesis and dwarf,CPD)编码细胞色素P450类固醇侧链羟化酶(CYP90),在植物激素油菜素甾醇(Brassinosteroids,BRs)的生物合成中起重要作用[1-2]。已有研究表明,CPD 基因在植物生长发育过程中通过促进BRs 的合成,调控植物的株高、产量、粒型、育性、纤维等多种农艺性状[3-5],参与细胞的伸长与分裂、维管束分化、光形态建成、叶和根的发育、衰老、育性以及对逆境胁迫的响应等多个生物学过程,对植物生长发育起着至关重要的作用[6-8]。在BR 合成过程中参与催化反应的酶主要有6 种,其中有5 种为细胞色素P450 单加氧化酶(Cytochrome P450s,CYPs)。到目前为止,与拟南芥CPD 同源的基因已经在豌豆、番茄、水稻、大豆、马铃薯、胡杨、棉花、玉米、杨树等[9-16]植物中被鉴定和研究,但在甜菜上未见报道。本研究以P450保守结构域序列,为检索序列通过HMM 和BLAST 在甜菜基因组数据中进行同源性搜索,对BvCPD 家族成员进行分析。利用ExPASy、MEGA 7.0、MapInspect、MEME等生物信息学分析工具对BvCPD 家族成员进行理化性质、系统进化关系、基因染色体定位及模体分析。同时,根据本课题组在甜菜块根不同发育时期的转录组数据分析已得出的BvCPD 家族成员Bv2_qyup 与甜菜块根膨大有关的结果[17],进一步对Bv2_qyup 蛋白的理化性质、蛋白质结构、蛋白信号肽和跨膜预测、亚细胞定位、蛋白保守结构域以及蛋白磷酸化位点进行生物信息学分析,以期阐明BvCPD 的基本理化特性,并为Bv2_qyup的克隆及功能鉴定提供理论依据。
1 材料与方法
1.1 BvCPD 家族成员系统进化特征分析
以拟南芥CPD 氨基酸序列(ACCESSION:At5g05690,来自拟南芥数据库及蛋白序列数据库)作为探针序列,基于“隐马尔可夫模型”(HMM)下载自Pfam 蛋白家族数据库(http://pfam.xfam.org/)的保守性P450 结构域序列在甜菜基因数据库RefBeet-1.1和RefBeet-1.2中进行BLASTP搜索,把编码完整的任何P450结构域均视为BvCPD家族基因,并确保其非冗余(E值≤10-15)。将SMART分析作为二次检验的标准,确保每一条蛋白质序列都包含保守性P450结构域。
利用软件ExPASy 中的Prot-Param 工具对BvCPD 蛋白的氨基酸组分和理化性质进行分析;利用ClusterW(在默认设置下)软件对来自甜菜和拟南芥的CPD 蛋白氨基酸序列进行多序列比对;利用MEGA7.0 软件分析与构建无根系统进化树;统计方法为邻接(Neighbor joining)法。同时利用Maximum Likelihood 和Minimum Evolution法分别构建的系统进化树对所得系统进化树进行验证。
1.2 BvCPD家族成员的染色体定位
根据上面分析,再通过对甜菜基因组数据集RefBeet-1.1(http://bvseq.molgen.mpg.de/Genome/Download/index.shtml)的搜索确定BvCPD 家族基因所在的位置,利用Mapin-spect 软件绘制BvCPD 家族基因的染色体定位图谱。
1.3 BvCPD家族基因的保守性模体鉴定
进一步,使用在线工具MEME(http://meme-suite.org/tools/meme)统计分析BvCPD 家族蛋白序列中的保守性模体,模体数量上限设为10,其他值均设为默认值。
1.4 Bv2_qyup基因的生物信息学分析
利用ExPASy-Protparam 和Protscale在线软件预测分析蛋白的理化性质和亲水性;利用NCBI CD search及NPSA-PRABI、Swiss-Model 软件分别预测蛋白的保守结构域及二、三级结构;并在线网站Psort 进行亚细胞定位预测。根据SignalP4.1、TMHMM Server v.2.0 和NetPhos 3.1 Server软件预测分析蛋白信号肽、蛋白跨膜及磷酸化位点[18-21]。
2 结果与分析
2.1 BvCPD基因家族的分子特征
以P450保守结构域序列为检索序列通过HMM和BLAST在甜菜基因组数据中进行同源性搜索,共获得76个BvCPD家族成员,其mRNA 长度范围在786~4 132 bp,外显子数为1~16个;编码蛋白质的氨基酸数量为235(Bv6_pfpc)~767(Bv7u_xmah)个,分子质量为26.40(Bv1_iokn)~87.49(Bv7u_xmah)kDa,等电点变化范围为5.59(Bv2_dnyj)~9.45(Bv0_xcyt),亲水性指数为-0.369~0.077(表1)。
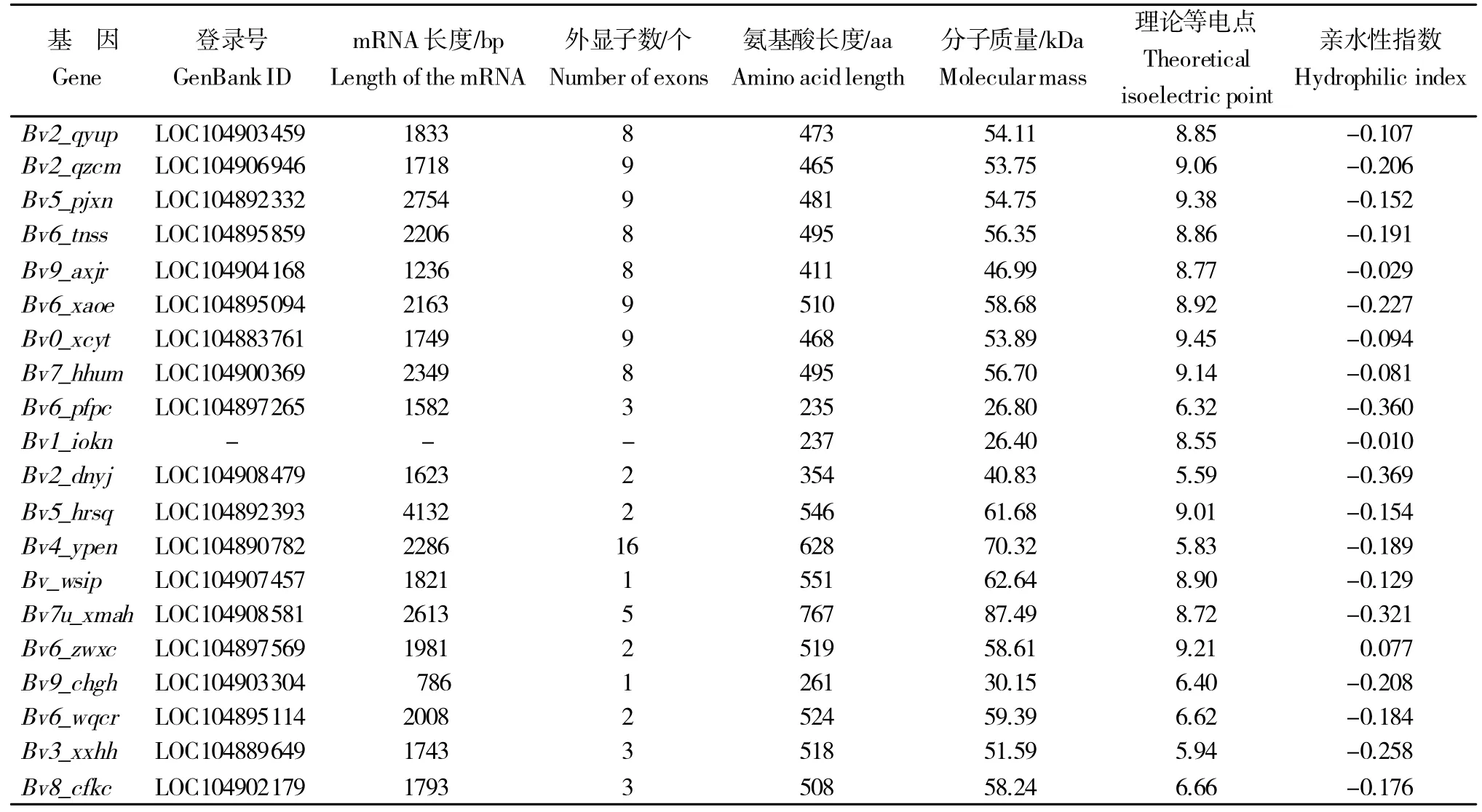
表1 部分BvCPD 家族成员信息Table 1 Part of the BvCPD family genes information
2.2 BvCPD 基因家族的系统发育分析
将76 个BvCPD 的氨基酸序列与52 个AtCPD 的氨基酸序列用NJ 法构建系统进化树,并根据BvCPD 家族成员与AtCPD 家族成员的进化关系将BvCPD 家族成员分成10 个亚组(图1),1~10 个亚组中的BvCPD数量分别是3、16、13、3、11、9、7、7、2和5个,其中Bv2_qyup和AtCYP90A1同源性最高,共同位于亚组Ⅹ中。
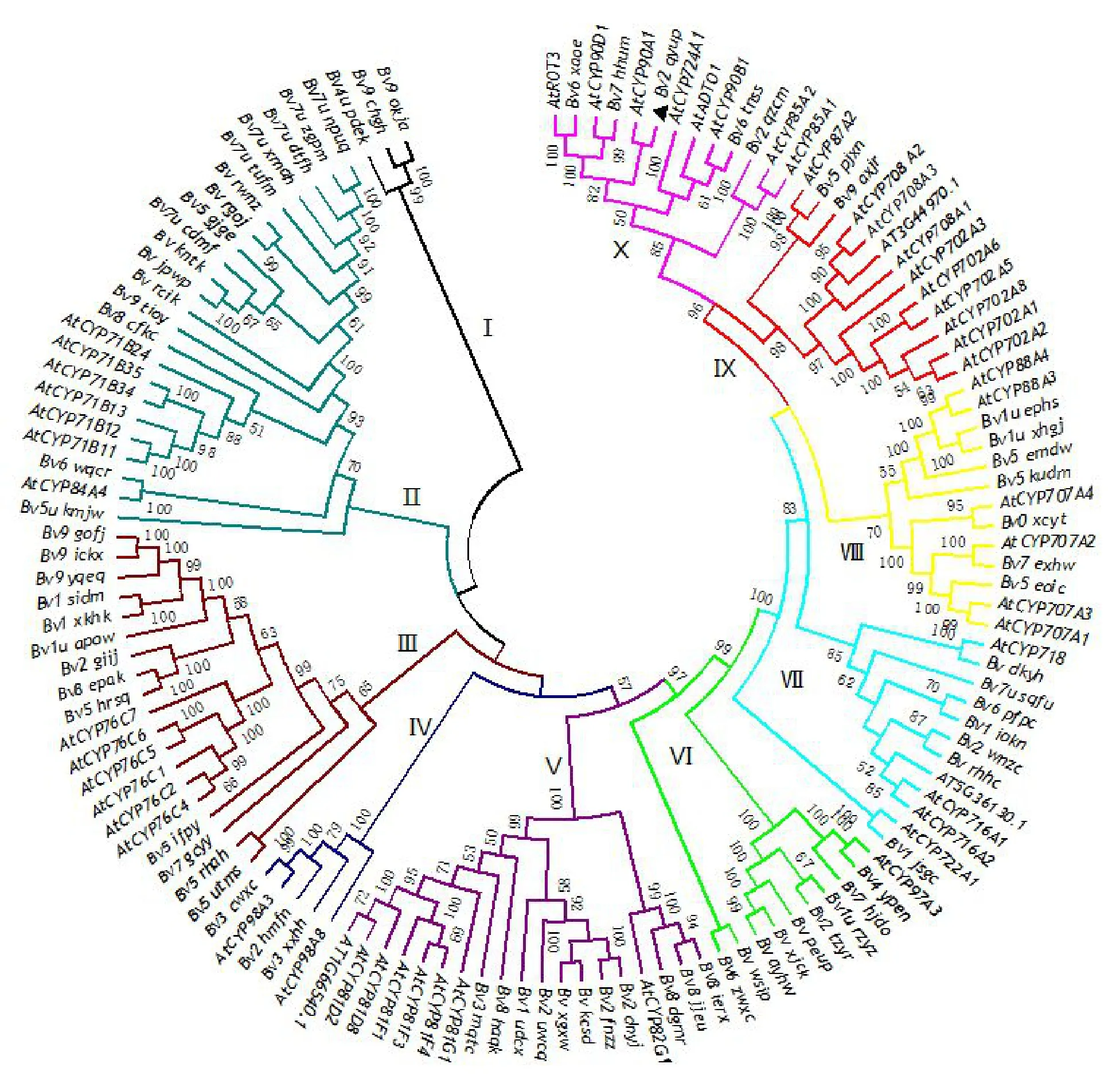
图1 CPD基因家族系统进化树分析Fig.1 Phylogenetic tree analysis of CPD gene family
2.3 BvCPD 家族成员保守性模体分析
对BvCPD蛋白序列进行保守性模体预测,经分析共得到10个保守性模体,所有BvCPD家族成员均含有4~10 个模体,且均含有模体2 和模体7,除Bv_hhum 外均含有模体1,除Bv_sqfu 外均含有模体4 和模体5(图2)。结合系统进化树的分组,每个亚组中模体数量和种类相近。
2.4 BvCPD 家族基因染色体定位分析
通过Mapin-spect 软件分析发现,有66 个BvCPD 家族成员分布在甜菜的9 条染色体上,其中第7 条染色体上分布最多,分布有13 个基因;其次为第5 条和第1 条,分别分布有11 个和9 个基因;在第3 条染色体上分布的基因最少,只有3 个基因(图3)。除此之外,还有10 个基因尚未明确定位。Bv2_qyup被定位于第2 条染色体上。

图2 CPD家族蛋白保守性模体分布Fig.2 Conservative pattern distribution of CPD family protein
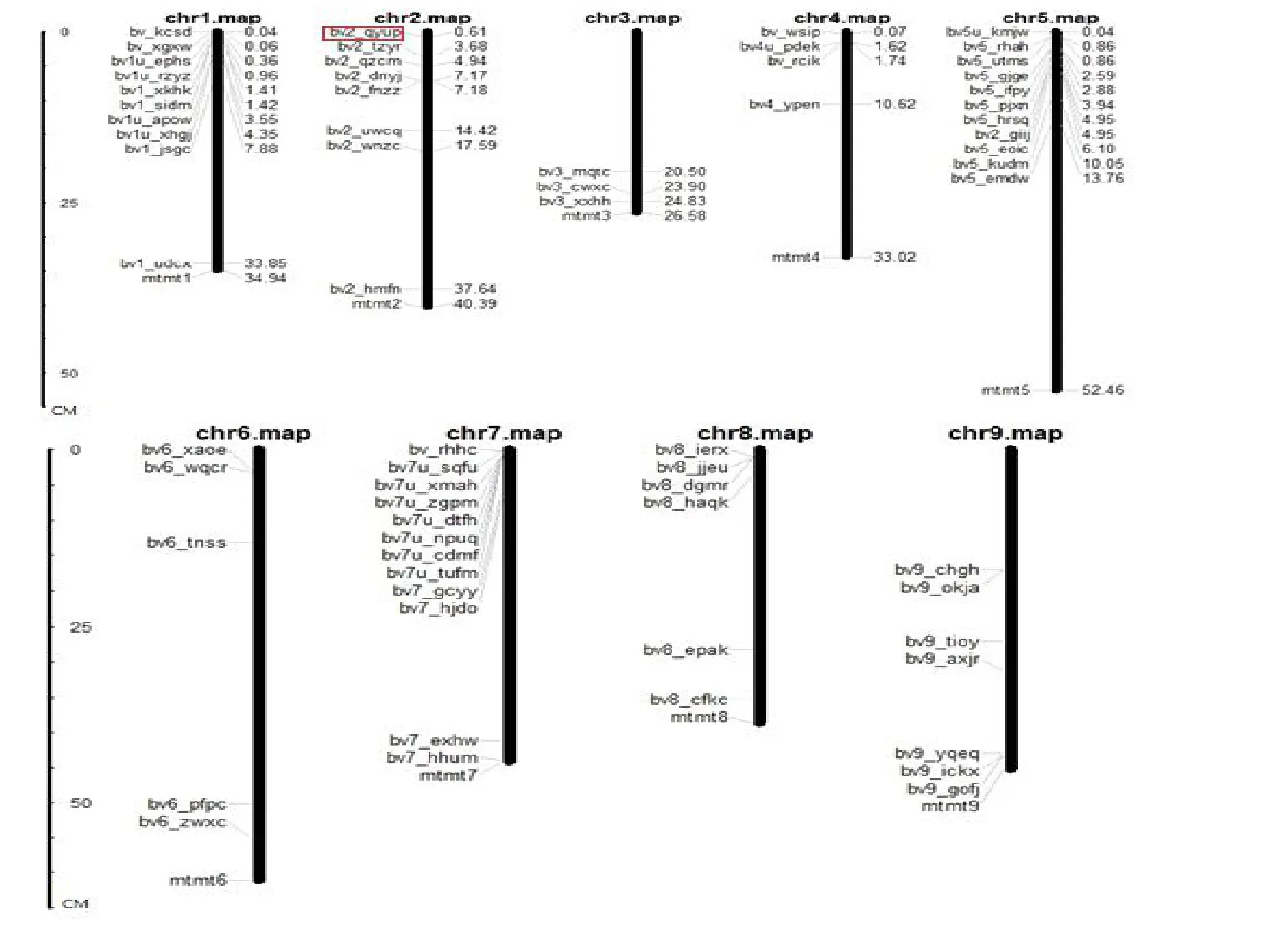
图3 BvCPD家族成员的染色体分布Fig.3 Chromosome distribution of BvCPD family genes
2.5 Bv2_qyup的生物信息学分析
为进一步调查BvCPD 的功能,结合本课题组对甜菜块根发育的转录组数据分析所发现的BvCPD 基因家族中Bv2_024470_qyup.t1与甜菜块根膨大呈正相关的结果,我们进一步对Bv2_qyup 及其编码蛋白进行生物信息学分析,以期为研究该基因在甜菜块根发育中的功能奠定基础。
2.5.1Bv2_qyup的序列分析
利用NCBI 数据库中ORF finder 软件预测Bv2_qyup 的开放阅读框(ORF),结果显示Bv2_qyup 的cDNA序列包含有1 422 bp 的ORF,编码473 个氨基酸(图4)。其中亮氨酸(Leu)、苏氨酸(Thr)所占比例较高,分别为12.1%、7.8%,半胱氨酸(Cys)的占比最低,为1.1%;含碱性氨基酸精氨酸(Arg)和赖氨酸(Lys)共58 个;含酸性氨基酸天冬氨酸(Asp)和谷氨酸(Glu)共52个。

图4 Bv2_qyup的核苷酸序列及推测的氨基酸序列Fig.4 Nucleotide and deduced amino acid sequences of Bv2_qyup
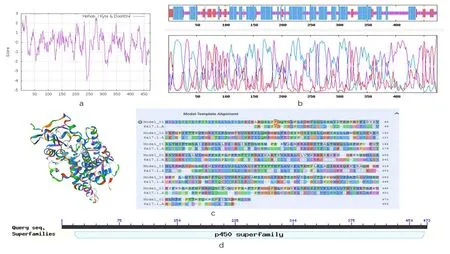
图5 Bv2_qyup的理化性质及结构分析Fig.5 Physical and chemical properties and structure of Bv2_qyup
2.5.2Bv2_qyup的理化性质及结构
通过ExPASy-Protparam 在线工具对Bv2_qyup 的理化性质进行分析。得出该蛋白的相对分子量为54.11 kD,等电点为8.85;蛋白质不稳定指数为37.49,说明该蛋白是稳定蛋白(不稳定系数<40)[22];总平均亲水指数(GRAVY)为-0.107,再根据ProtScale 软件检测其亲水性和疏水性。Bv2_qyup 最大的亲水性和疏水性值分别为-4.033和2.833。从图5a可以看出Bv2_qyup亲水性和疏水性氨基酸分别为157个和135个,说明Bv2_qyup属于亲水蛋白。
通过在线网站NPSA-PRABI预测Bv2_qyup的二级结构,如图5b 所示:Bv2_qyup由α-螺旋、延伸链和无规卷曲组合的超二级结构,其中α-螺旋区域有230 个氨基酸,占48.63%;参与形成无规则卷曲的氨基酸有187个,占39.53%;参与形成延伸链的氨基酸有56个,占11.84%。
通过Swiss-Model 数据库运用同源建模的方法预测Bv2_qyup 的三级结构,预测的结果如图5c 所示,Bv2_qyup 的主要空间结构由α-螺旋和无规则卷曲构成,与其二级结构预测分析一致,经折叠、弯曲等一系列复杂的过程形成了一个稳定的三级结构。
利用软件NCBI CD search 预测Bv2_qyup 蛋白序列保守结构域(图5d)。预测结果表明Bv2_qyup 具有细胞色素p450超家族结构。
2.5.3Bv2_qyup的亚细胞定位、磷酸化位点、跨膜区域及信号肽预测
通过Psort分析表明,Bv2_qyup定位于细胞质中可能性占比最高(表2)。
表2 Bv2_qyup 的亚细胞定位分析Table 2 Analysis of subcellular localization of Bv2_qyup
通过软件TMHMM Server v.2.0 分析Bv2_qyup 的跨膜结构,其N 末端位于膜内侧的概率为0.4541(图6a),预测该蛋白在第4~23 个氨基酸存在跨膜结构域,说明Bv2_qyup是一种膜蛋白。根据对目的肽链氨基酸间潜在酶切位点的预测来判断是否存在信号肽[23]。预测分析表明:Bv2_qyup在第28~29个氨基酸位置存在信号肽(图6b)。
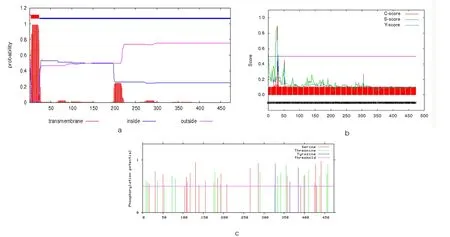
图6 Bv2_qyup的跨膜区域、信号肽及磷酸化位点预测Fig.6 Prediction of transmembrane region,signal peptide and phosphorylation site of Bv2_qyup
蛋白修饰在翻译后细胞的调控机制中起极其重要的作用,磷酸化修饰是蛋白修饰的主要方式。对Bv2_qyup 编码蛋白磷酸化位点进行分析预测,当潜在磷酸化位点的阈值为0.5 时,Bv2_qyup 潜在的磷酸化位点有44 个,其中22 个丝氨酸(Ser)位点、19 个苏氨酸(Thr)位点、3 个酪氨酸(Tyr)位点(图6c),推测Bv2_qyup被这3种氨基酸的磷酸激酶磷酸化并激活。
2.5.4Bv2_qyup蛋白序列的同源性分析
利用ClustalW 软件进行同源多重比对,结果如图7 所示,Bv2_qyup 与藜麦CqCPD、菠菜SoCPD、毛果杨PtCPD、黄瓜CsCPD 和拟南芥AtCPD的同源性较高,分别为91%、89%、75%、75%和75%。

图7 Bv2_qyup与不同植物的CPDs氨基酸序列比对Fig.7 Sequence alignment of CPDs amino acids between Bv2_qyup and different plants
3 讨论与结论
通过生物信息学分析可以了解基因的结构、染色体定位、保守结构域、编码蛋白序列及结构、信号肽、跨膜结构和磷酸化位点等信息。本研究对甜菜CPD 基因家族进行了生物信息学分析,研究结果表明,甜菜CPD 基因共有76 个家族成员,分为10 个亚组,66 个BvCPD 家族基因分布在甜菜9条染色体上,有10个基因尚未明确定位;编码蛋白含10 个保守性模体,系统进化树分组中每个亚组的模体数量和种类相近。进一步对Bv2_qyup 基因及其编码的蛋白质分析表明,Bv2_qyup 由473 个氨基酸组成,是一种含信号肽的亲水跨膜蛋白,二级结构以α-螺旋和无规则卷曲为主要组成部分,与藜麦、菠菜、毛果杨、黄瓜和拟南芥CPD的同源性较高。细胞定位预测表明该蛋白在细胞质中存在的可能性最大,与中国樱桃Unigene5028(CPD)定位于叶绿体中不同[24],表明甜菜CPD 家族成员在细胞中的定位不同,Bv2_qyup 存在44 个磷酸化位点,可被丝氨酸、苏氨酸、酪氨酸磷酸激酶磷酸化并激活。根据以上研究结果,我们将对Bv2_qyup克隆,并对其在甜菜块根发育中的功能进行深入研究。
