TGM2对甲状腺癌干细胞紫杉醇化疗敏感性的影响及作用机制①
2020-09-30王承芳洪志军
林 琳 王承芳 洪志军
(大连医科大学附属第一医院普外科,大连 116021)
甲状腺癌发病率占所有内分泌癌90%以上,位居所有癌症发病率第5名[1]。Globocan 2018年肿瘤发病率和死亡率统计数据显示,全球男性和女性甲状腺癌的发病率分别为3.1/10万和10.2/10万,死亡率分别为0.4/10万和0.5/10万[2]。分化型甲状腺癌是甲状腺癌的最常见形式,治疗手段包括手术、化学治疗、内分泌治疗、核素内放疗等传统治疗,预后相对较好[3,4]。低分化和未分化的甲状腺癌由于其复发和侵袭转移等恶性行为,传统治疗效果不佳,总中位生存期仅为2~6个月[5]。化疗药物的耐药性是恶性甲状腺癌治疗的主要挑战,而导致甲状腺癌不良预后的化疗抵抗、复发和转移均与肿瘤干细胞(cancer stem cell,CSC)相关,CSCs存在于包括甲状腺癌在内的多种肿瘤细胞中[6-8]。甲状腺癌干细胞(thyroid cancer stem cell,TCSC)是存在于甲状腺细胞中的小部分侧群细胞,具有干细胞的多分化潜能和自我更新能力,导致化疗后肿瘤复发[9]。因此,阐明TCSC对化疗药物敏感性的作用机制有望改善恶性甲状腺癌患者预后。
转谷氨酰胺酶2(transglutaminase 2,TGM2)是转谷氨酰胺酶家族成员,其基因编码组织转谷氨酰胺酶2(tissue transglutaminase type 2,TG2)蛋白,参与调节细胞凋亡和细胞外基质降解[10]。研究表明TGM2与患者对药物的低敏感性和低存活率显著相关,体外和体内实验已证实TGM2可能是骨肉瘤顺铂化疗耐药性的潜在治疗靶点[11]。TGM2在甲状腺癌中的作用尚未见报道,其与甲状腺癌细胞的化疗药物耐药性是否相关尚未阐明。紫杉醇是各肿瘤治疗中广泛应用的化疗药物,可抑制肿瘤细胞的有丝分裂,诱导肿瘤细胞凋亡[12]。本研究以TCSC为工具细胞,研究TGM2表达影响TCSC对紫杉醇敏感性的作用及机制,寻找TCSC对化疗药物敏感性的潜在治疗靶点。
1 材料与方法
1.1材料
1.1.1主要试剂 Ⅳ型胶原酶购自美国Sigma公司;碱性成纤维细胞生长因子和表皮生长因子均购自美国Gibco公司;逆转录、qRT-PCR试剂盒等均购自日本TaKaRa公司;MTS增殖、Tunnel凋亡染色、细胞凋亡检测试剂盒均购自南京凯基生物技术有限公司;RIPA组织裂解液及PVDF膜均购自北京索莱宝科技有限公司;蛋白浓度检测BCA液购自美国Thermo公司;TGM2小干扰RNA由上海吉凯基因公司合成;兔抗人TGM2抗体(15100-1-AP)、兔抗人Nanog抗体(14295-1-AP)、兔抗人Sox2抗体(11064-1-AP)、鼠抗人GAPDH抗体(60004-1-Ig)均购自Proteintech公司;鼠抗人caspase-3抗体(ab13585)、鼠抗人Bax抗体(ab182733)均购自abcam公司。
1.1.2组织来源 取我院未分化型甲状腺癌新鲜组织1例,该患者未接受放化疗等任何形式的治疗。实验操作根据赫尔辛基宣言和我院伦理指南进行,患者知情同意。
1.2方法
1.2.1肿瘤细胞分离和TCSC培养 肿瘤组织无菌条件下去除正常组织和脂肪,用含有抗生素的生理盐水冲洗。组织剪碎后放入含有1 mg/ml Ⅳ型胶原酶的DMEM-F12培养基中,37℃摇床孵育2 h。用含10% FBS的DMEM-F12完全培养基终止消化后,无菌尼龙细胞过滤器过滤,2 000 r/min离心5 min。完全培养基洗1次后,将细胞重悬至含有表皮生长因子和碱性成纤维细胞生长因子的无血清培养基中培养。显微镜下观察,2周左右时细胞球开始形成,流式细胞仪分选CD133+的TCSC,无血清培养基中悬浮扩大传代培养。
1.2.2细胞转染和qRT-PCR检测 将呈对数生长期的TCSC细胞传代至6 cm培养皿,按说明书将脂质体2000与TGM2 siRNA、各组对照转染试剂转染至细胞,分为si-TGM2组和si-NC组,放至培养箱培养。si-TGM2引物序列:5′-GCAGTGACTTTGACG-TCTT-3′,si-NC引物序列5′-GATGAAAGAATTAC-CGAAT-3′。
收集紫杉醇处理72 h及转染TGM2 siRNA 24 h的各组细胞,TRIzol裂解法提取总RNA。设计合成TGM2引物F:5′-GAGGAGCTGGTCTTAGAGAGG-3′,R:5′-CGGTCACGACACTGAAGGTG-3′。以GAPDH为内参,以cDNA为模板进行qRT-PCR。每个样品设置3个复孔,2-ΔΔCt法计算各组实验数据。
1.2.3MTS实验检测细胞率 取转染24 h的各组细胞,3 000个/孔、150 μl培养基接种于96孔板,贴壁后分别加入不同浓度紫杉醇 (0、0.062 5、0.125、0.25、0.5、1、2、4、8、16、32和64 μmol/L),每个浓度设置6个复孔,并设置空白对照。72 h后30 μl/孔加入MTS试剂,37℃孵育2 h。酶标仪检测490 nm处OD值,以药物浓度的Log值为横坐标,细胞存活率 (OD实验组-OD空白/OD对照组-OD空白) ×100%为纵坐标,绘制细胞存活曲线,并计算各组细胞IC50值。
1.2.4软琼脂克隆形成实验检测肿瘤细胞干性 20%无血清培养基与1.2%高压灭菌的软琼脂1∶1充分混匀后,2 ml均匀铺至6 cm培养皿,4℃冰箱冷却至固态作为底层胶。20%无血清培养基与0.6%高压灭菌的软琼脂1∶1充分混匀后作为上层胶,37℃预热,并与100 μl 1×105个紫杉醇处理72 h及转染TGM2 siRNA 24 h后的各组细胞充分混匀,铺至固态底层胶培养,每隔2 d加入1 ml培养基,显微镜下观察拍照,2周左右肿瘤球长至较大。
1.2.5Tunnel凋亡染色 将紫杉醇处理48 h的TSCS,以1×106个、150 μl培养基接种于6孔板爬片,分别转染si-NC和si-TGM2 24 h后,PBS洗 2次,1 ml 4%多聚甲醛固定30 min。PBS洗1次,加入100 μl Tunnel染色液,37℃避光孵育1 h,PBS洗3次,将爬片放置载玻片上滴加50 μl含有DAPI的抗荧光淬灭封片剂,倒置荧光显微镜观察细胞荧光。
1.2.6流式细胞术检测细胞凋亡 用无EDTA的胰酶消化紫杉醇处理72 h及转染TGM2 siRNA 24 h后的各组细胞,PBS洗3次,6×105个/管,按照说明书分别加入500 μl Binding Buffer、5 μl 7-ADD、5 μl Annexin V-APC染液,混匀后室温避光孵育15 min。PBS洗1次,流式细胞仪检测凋亡细胞百分数,重复实验3次。
1.2.7裸鼠移植瘤模型建立 4周龄雌性裸鼠随机分为si-NC和si-TGM2组,每组6只。将转染后的各组细胞分别注射于裸鼠右侧腋下,1×107个/只,共100 μl。灌胃给予30 mg/(kg·d)紫杉醇,每4 d 用游标卡尺测量一次肿瘤体积,观察裸鼠移植瘤大小。
1.2.8Western blot检测蛋白表达 将紫杉醇处理72 h 及转染TGM2 siRNA 24 h的细胞PBS洗3次,每皿加入100 μl含有1%蛋白酶抑制剂和磷酸酶抑制剂的RIPA,超声冰上裂解30 min,14 000 r/min、4℃离心30 min。将上清移至新EP管中,测量蛋白浓度,煮沸变性冷却,行SDS-PAGE电泳,湿转方式移至PVDF膜,牛奶室温封闭2 h,加入稀释的一抗4℃孵育过夜,TBST洗3次,加入二抗室温孵育2 h,ELC化学发光法显示条带。
2 结果
2.1TCSC的筛选及鉴定 分选出CD133+的细胞约占全部细胞的1.21%,CD133+细胞中干性相关基因Nanog、Sox2蛋白表达显著高于CD133-细胞,TGM2蛋白在CD133+细胞中表达显著上升(P<0.05),见图1、表1。
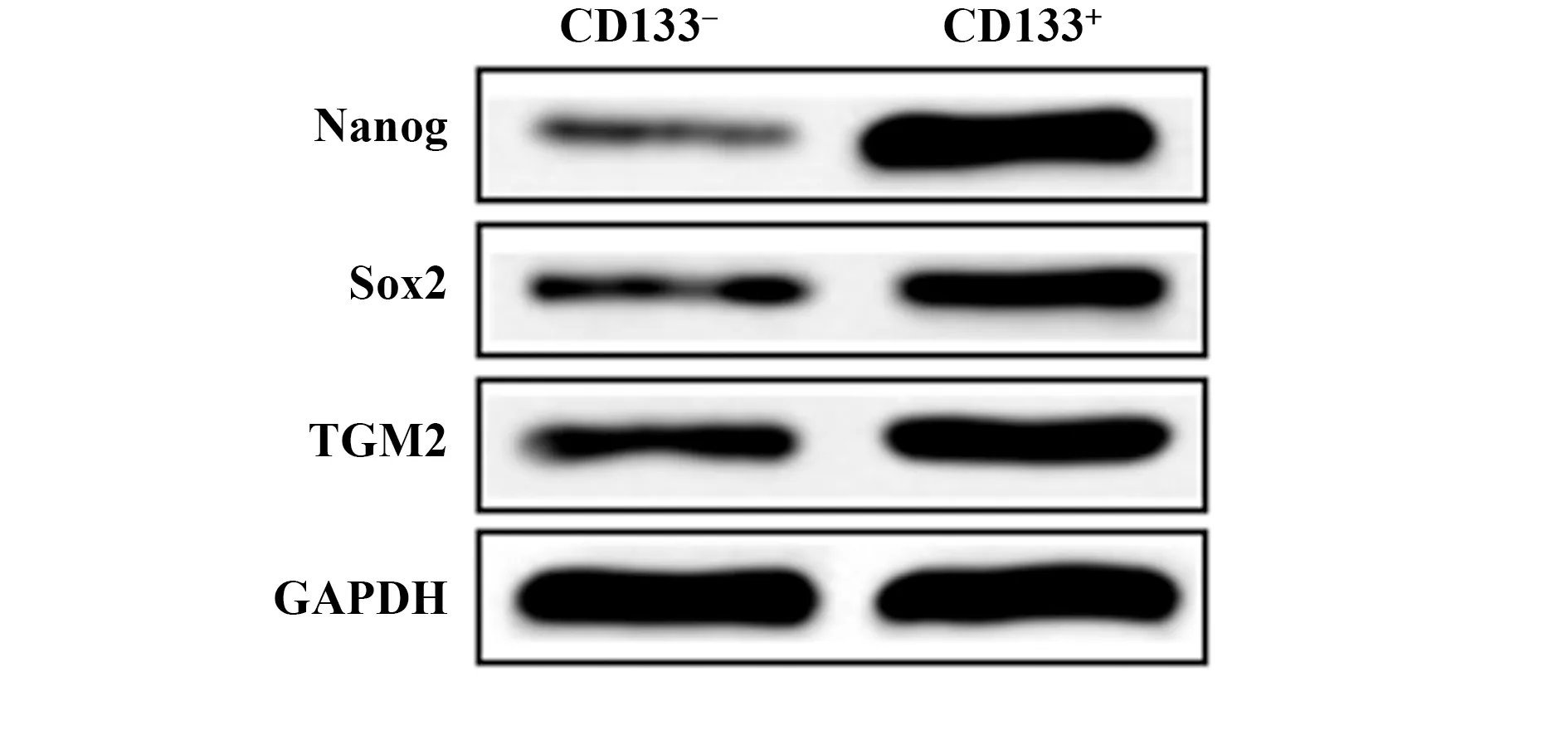
图1 Western blot检测CD133-和CD133+细胞中干性相关基因Nanog、Sox2及TGM2蛋白表达Fig.1 Expression of stem-related genes Nanog,Sox2 and TGM2 proteins in CD133- and CD133+cells were detected by Western blot
表1 CD133-和CD133+细胞干性相关基因Nanog、Sox2及TGM2蛋白表达
2.2MTS检测抑制TGM2表达对紫杉醇敏感性的影响 si-TGM2组紫杉醇处理72 h的IC50值为(3.05±0.26)μmol/L,显著低于si-NC组紫杉醇处理72 h的IC50值(7.97±0.49)μmol/L(P<0.05),见表2,表明沉默TGM2表达可提高TCSC对紫杉醇的敏感性。
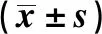
表2 MTS实验检测抑制TGM2表达对各组细胞存活率的影响
2.3紫杉醇作用于TCSC对TGM2表达的影响 选择与si-TGM2组紫杉醇处理72 h的IC50较为接近的浓度(3 μmol/L)的紫杉醇处理TCSC 72 h,qRT-PCR检测结果显示紫杉醇处理的TCSC中TGM2mRNA的表达为(8.34±0.12),显著高于未处理的TCSC中的表达(1.00±0.02) (P<0.05)。
2.4TGM2对紫杉醇处理的TCSC干性的影响 软琼脂克隆实验显示,si-NC和si-TGM2组肿瘤克隆球形成的数目分别为(16.67±2.51)个、(7.81±1.42)个,si-TGM2组紫杉醇处理72 h的TCSC肿瘤克隆球形成能力低于si-NC组(P<0.05),见图2。
2.5TGM2对紫杉醇处理的TCSC凋亡的影响 Tunnel凋亡染色检测显示,与si-NC组相比,si-TGM2组细胞凋亡率明显提高(P<0.05),见图3。流式细胞术检测显示,与si-NC组相比,si-TGM2组细胞凋亡率明显与提高(P<0.05),见图4。

图3 Tunnel凋亡染色检测抑制TGM2的表达对紫杉醇处理的TCSC凋亡的影响Fig.3 Tunnel apoptosis staining assay detected effect of inhibition of TGM2 expression on paclitaxel-treated TCSC apoptosis
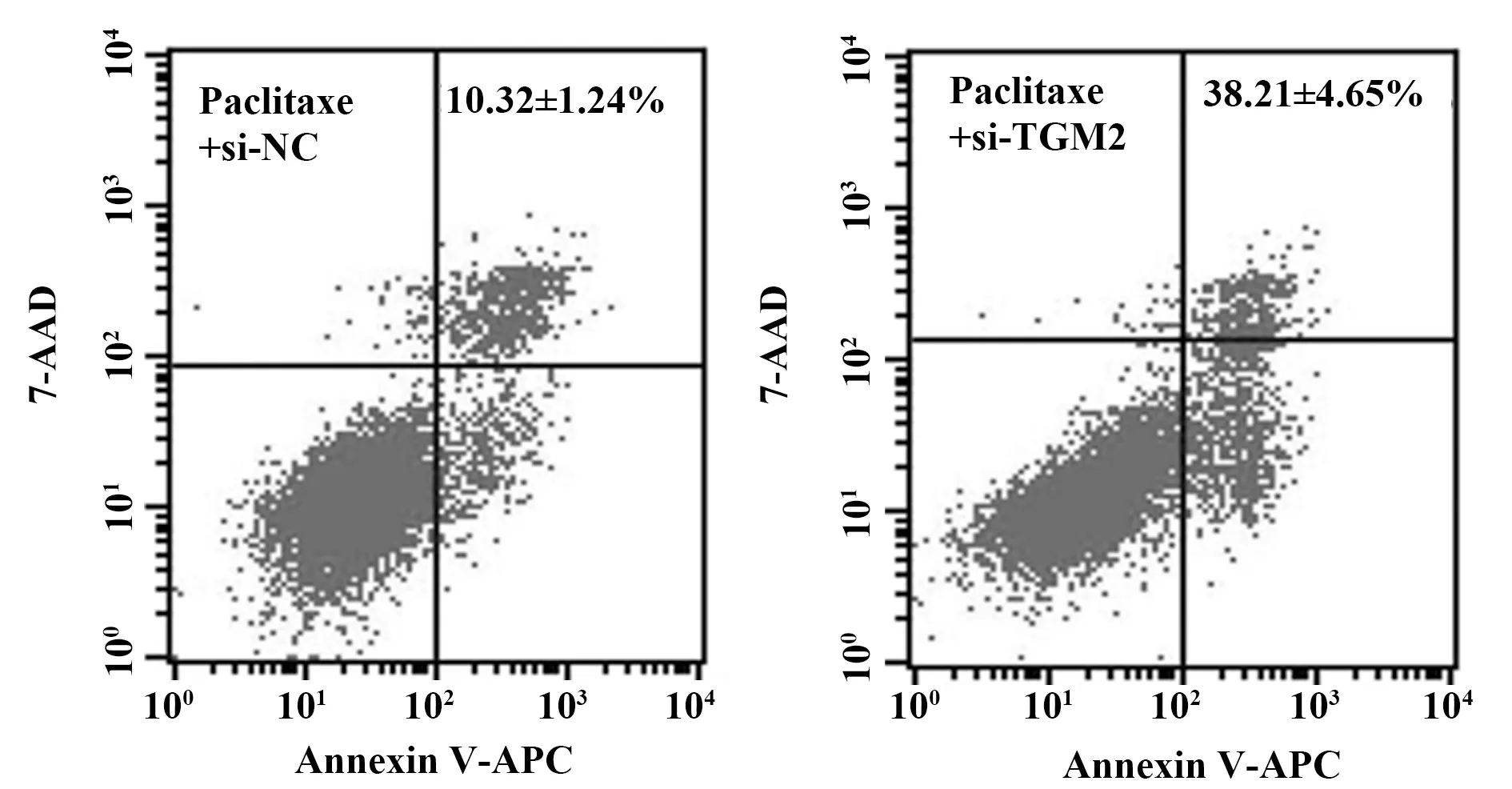
图4 流式细胞术检测检测抑制TGM2表达对紫杉醇处理的TCSC凋亡的影响Fig.4 Flow cytometry detected effect of inhibition of TGM2 expression on paclitaxel-treated TCSC apoptosis
2.6TGM2对紫杉醇处理TCSC敏感性的影响 紫杉醇处理后,si-TGM2组裸鼠肿瘤体积显著小于si-NC组裸鼠肿瘤体积(P<0.05),见图5,抑制TGM2表达可提高TCSC细胞在体内对紫杉醇的敏感性。
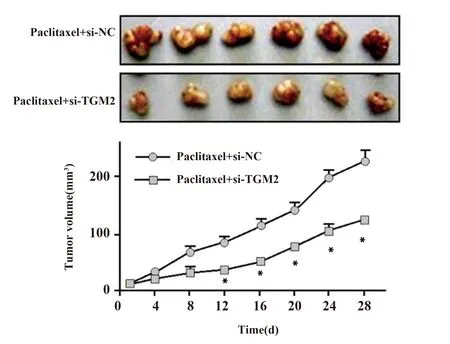
图5 裸鼠移植瘤实验检测TGM2对紫杉醇处理TCSC敏感性Fig.5 Subcutaneous xenograft experiment detected effect of TGM2 on sensitivity of paclitaxel-treated TCSCNote:Compared with si-NC,*.P<0.05.
2.7TGM2对紫杉醇处理的TCSC相关凋亡蛋白的影响 Western blot检测显示结果显示,si-TGM2组相关凋亡蛋白caspase-3、Bax的表达显著高于si-NC组细胞(P<0.01),见图6、表3。
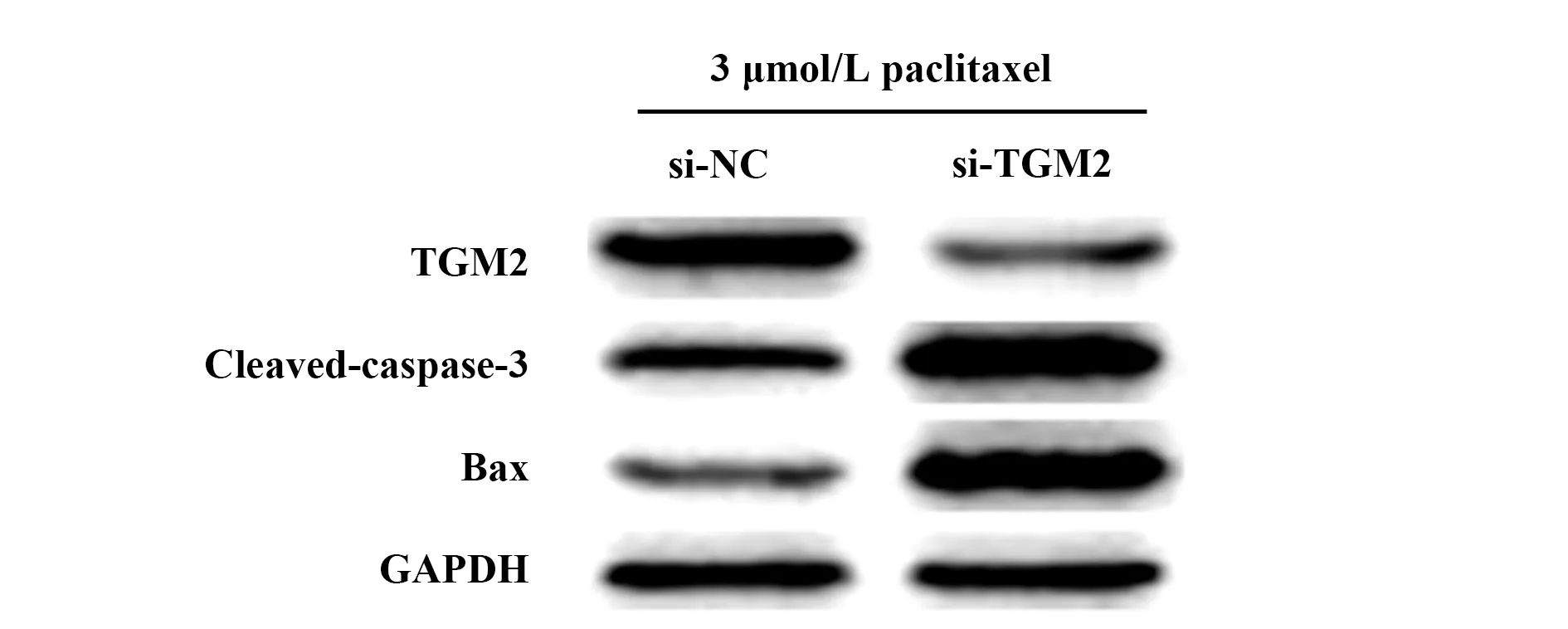
图6 Western blot检测抑制TGM2表达对紫杉醇处理的TCSC相关凋亡蛋白的影响Fig.6 Western blot detected effect of inhibition of TGM2 on expressions of paclitaxel-treated TCSC-associated apoptotic proteins
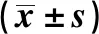
表3 各组细胞TGM2及凋亡蛋白caspase-3、Bax表达
3 讨论
甲状腺癌近30年发病率急剧提高,转移和复发是甲状腺癌相关死亡的主要原因[13-15]。虽然目前检测方法和治疗手段已提高甲状腺癌患者生存率,但恶性甲状腺癌化疗药物耐药性仍是影响患者预后的重要因素[9]。多种肿瘤中已证实CSC可促进化疗耐药,miR-33a可有效提高肝癌CSC对多柔比星的敏感性,卵巢癌CSC中抑制survivin表达可提高CSC对紫杉醇的敏感性[16-18]。TCSC具有侵袭性,对常规疗法包括放化疗具有高度抗性,导致疾病复发,靶向TCSC可能是侵袭性甲状腺癌的有效治疗策略[19]。因此寻找调控TCSC的关键基因,对克服CSC耐药具有重要意义。
TGM2是一种多功能蛋白质,以钙依赖的方式催化蛋白质共价交联,参与细胞迁移、分化、凋亡和炎症等过程[20]。研究发现TGM2可通过调节EMT和干性相关蛋白SOX2影响结肠癌CSC的转移潜能和干性[21]。Fisher等[22]报道TGM2是鳞状细胞癌干细胞的干预靶点,但其调控TCSC的作用机制尚未明确。TGM2可促进骨肉瘤患者对顺铂耐药,但TGM2是否调控TCSC导致紫杉醇耐药尚未阐明。本研究采用原代培养的方法成功分离TCSC,发现TGM2蛋白在TCSC中高表达,抑制TCSC中TGM2表达后,其对紫杉醇72 h的IC50值降低,而紫杉醇处理TCSC细胞TGM2表达升高,抑制紫杉醇处理的TCSC TGM2表达后,TCSC软琼脂克隆形成能力降低,表明TGM2可促进TCSC对紫杉醇耐药,但具体作用机制需进一步研究。
研究报道TGM2通过调节BCL-2相关X(Bax)表达及在缺氧条件下释放细胞色素C抑制骨肉瘤细胞凋亡[23]。化疗药物杀伤肿瘤细胞增强其敏感性的重要作用机制为促进肿瘤细胞凋亡,本研究采用Tunnel凋亡染色和流式细胞仪检测细胞凋亡情况,结果显示抑制紫杉醇处理的TCSC TGM2表达,细胞凋亡增加,同时裸鼠实验观察到抑制TGM2表达,TSCS对紫杉醇的敏感性增强,表明TGM2通过调控凋亡信号通路影响TCSC对紫杉醇的敏感性。细胞凋亡是一种正常生理过程,其启动受到严格调控,由多个凋亡信号通路相关蛋白执行,caspase和Bcl-2信号通路是最常见的凋亡途径。caspase蛋白家族存在细胞质,其改变是细胞凋亡的重要标志,caspase-3蛋白是凋亡通路中的效应者,通常以无活性前体形式存在,经凋亡信号刺激后剪切为具有活性的caspase-3,是不可逆的细胞凋亡标志[24,25]。Bcl-2信号通路是线粒体引发的凋亡,包括Bcl-2、Bad、Bax等成员,Bax蛋白为凋亡过程通路效应者,具有BH结构域。Bax在正常条件下主要分布于细胞质,在凋亡信号作用下移至线粒体,并通过BH结构域结合线粒体膜上的Bcl-2蛋白,降低Bcl-2的抗凋亡作用。此外Bax可在线粒体膜上形成Bax-Bax同二聚体,改变线粒体膜通透性,释放细胞色素C促发细胞凋亡[26]。本研究采用Western blot法检测紫杉醇处理的TSCS中敲减TGM2表达后caspase-3及Bax蛋白表达变化,发现紫杉醇处理的si-TGM2组caspase-3及Bax蛋白表达显著升高,表明TGM2可能通过作用于凋亡蛋白,调控凋亡信号通路降低TSCS对紫杉醇的敏感性。
综上所述,TGM2在TCSC中高表达,抑制其表达可提高TCSC对紫杉醇的敏感性,其机制可能是通过作用于凋亡蛋白,调控凋亡通路。本研究为改善TCSC耐药提供新的研究策略,TGM2可能成为改善甲状腺癌患者预后的潜在靶点。