膜联蛋白A1拟肽Ac2-26对大鼠心肺复苏后脑神经损伤的保护作用
2020-09-30毛新发范卫兵宋琰驹武卫周
罗 鑫,毛新发,范卫兵,罗 星,宋琰驹,武卫周
近年来,心血管疾病急症发作常引发心源性猝死,且呈年轻化。随着心肺复苏(cardiopulmonary resuscitation,CPR)技术的普及和急诊医学的进步,通过及时抢救的自主循环恢复(return of spontaneous circulation,ROSC)的成功率上升,心脏骤停(cardiac arrest,CA)患者的病死率降低。心脏骤停后黄金抢救时间仅有4~6 min,错过黄金抢救时间可能会造成脑缺血缺氧性损伤。因此,CA后缺血缺氧性脑损伤是导致患者病死和致残的主要原因之一[1]。膜联蛋白A1(annexin A1,ANXA1)作用于磷脂结合蛋白与钙离子的结合位点,从而调节抗炎反应、细胞凋亡、细胞分化增殖等[2, 3]。ANXA1在阿司匹林、地塞米松等引起的体内炎性反应消除过程中起着关键的作用[4]。在深低温体外循环导致的脑损伤中,ANXA1肽可抑制早期大脑核因子-κBp65(nuclear factor-κB p65, NF-κBp65)磷酸化和核转位,下调如肿瘤坏死因子-α(tumor necrosis factors,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)等促炎因子,可以减轻脑组织损伤,但其是否对CPR后脑损伤产生保护作用尚不清楚[5]。Ac2-26是具有ANXA1功能端的肽片段,目前许多实验通过拟肽Ac2-26进行ANXA1的相关研究[6, 7]。本研究通过建立大鼠窒息性CA/CPR模型,探讨ANXA1拟肽Ac2-26对模型大鼠生存率和神经功能的影响。
1 材料与方法
1.1 材料 雄性SD大鼠53只,SPF级,体重为350~450 g,购于长沙天勤生物技术有限公司。饲养温度为25 ℃,相对湿度40%~60%,安静、通风及空气过滤系统良好的清洁级环境中饲养,维持昼夜节律(12 h/12 h)。
使用Ac2-26(Tocris公司)、IL-1β、IL-6、TNF-α检测试剂盒(上海碧云天生物技术有限公司),兔抗大鼠NF-κBp65多克隆抗体(Santa Cruz公司)、肝素钠注射液(上海第一生化药业)。MD3000型生物信号采集系统(淮北正华生物仪器设备公司),大鼠体温维持仪器(瑞沃德生命科技公司),R407 小动物呼吸机(瑞沃德生命科技公司),微量注射泵(瑞沃德生命科技公司),麻醉咽喉镜(泰兴斯美特医疗器械有限公司)。
1.2 大鼠窒息性CA/CPR模型的制备 用5%戊巴比妥钠进行腹腔麻醉。将麻醉的大鼠常规备皮,消毒,铺巾,放置于腹部朝上仰卧位,四肢固定于手术平板,抬高头侧手术平板约呈45°,将大鼠舌头牵拉后置入喉镜缓慢抬起其舌根,吸气时把经过润滑的14 G导管插进声门,固定导管。顺利插入导管以后,连接呼吸机,设定呼吸频率70次/min,潮气量6 ml/kg。用碘伏对大鼠右边骼窝进行消毒、备皮,切1 cm 左右的切口,在腹股沟附近选取较粗的股动脉进行插管。在插入导管之前,在动脉插管和压力换能器中冲入0.3%肝素生理盐水注射液,彻底排出气泡,并提前备好生物信息采集系统。将股动脉远心端结扎,近心端使用动脉夹牢牢固定,然后用专用线系上活结。用24G套管针穿刺插管,把线拉紧,固定导管,接上压力换能器,移除动脉夹,便能看见动脉搏动波形,并监测动态血压、心电图,采用体温计探头持续监测体温。采用白炽灯辐射加热保持其体温36.2~37.2 ℃。股动静脉置管结束后,在其生命体征保持平稳后,每隔5 min登记基线平均动脉压、心率及肛温。
本实验模型基于Yang等[8]诱导大鼠窒息性心脏骤停方法并改进从股静脉注入短效肌松药罗库溴铵(1 mg/kg)诱导大鼠肌松,5 min之后,停用专用呼吸机,诱导大鼠窒息,并在同一时间开启 5 min 倒计时。停用呼吸机后,观察血压及心率均逐渐降低,3~4 min至动脉搏动波形及平均动脉压降低20 mmHg以下。大鼠出现窒息现象直至平均动脉压<20 mmHg的这段时间,便是窒息至心脏停搏的时间。完全不进行干预5 min之后,对其展开CPR。重启呼吸机,将机器参数重设为呼吸频率80次/min,潮气量维持原状。肾上腺素(0.01 mg/kg)静脉注入,并在同一时间展开人工胸外按压(操作频率为200次/min,深度在胸廓前后径1/3)。自循环复原的标准是:大鼠心律恢复为室上性,平均动脉压≥60 mmHg,且最少维持10 min。如果用以上方法连续救治10 min仍未达ROSC要求,便认为是复苏失败,结束所有操作。53只中共45只参与本研究。
1.3 分组及药物处理 假手术组(n=15)大鼠仅行气管及股动静脉插入导管,整个过程保持(37.0±0.5)℃体温,监测动态血压、心率等指标,不展开窒息诱导及后续的CA/CPR。将ROSC后抢救成功大鼠用随机数字表法分为对照组(n=15)和Ac2-26组(Ac2-26后处理,n=15)。ROSC后5 min,Ac2-26组大鼠使用微量注射泵静脉输注Ac2-26(1 mg/kg),输注速度为50 μl/min。对照组以同样速度输注等量生理盐水。
1.4 生存分析及神经功能评估 每日观察并登记其术后大鼠生命状态,持续观测3 d。根据神经功能缺损评分量表(neurological deficit score,NDS)对大鼠的脑功能进行评估。NDS是普遍运用于大鼠CA/CPR模型神经功能评测的量表,包含一般表现、脑干功能、运动评估、感觉评估、运动行为及行为学6个部分。评估时间依次为ROSC 后24、48、72 h。
1.5 血清炎性因子检测 给药后3 d抽取3组大鼠静脉血2 ml(n=4)。在室温下,让血液样本凝结2 h后,1000 r/min离心20 min,吸取上清液。采用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)检测大鼠血清中IL-1β、IL-6、TNF-α表达水平。
1.6 测定脑前额叶皮层及海马中NF-κB蛋白的相对表达量 Western blot法测定各组大鼠前额叶皮层和海马中NF-κB蛋白的表达水平(n=4),Beta-actin作为内参标记蛋白。3 d后用戊巴比妥钠麻醉大鼠后迅速断头取脑,分离出前额叶皮质及海马。十二烷基磺酸钠-聚丙烯酰胺凝胶(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)电泳分离蛋白,对应一抗标记,辣根过氧化物酶标记二抗结合后,ECL显色液显影,X射线曝光记录,扫描各条带灰度值。假手术组、对照组与Ac2-26组灰度值为与Beta-action比较的相对表达量。

2 结 果
2.1 ANXA1拟肽Ac2-26后处理对大鼠ROSC后3 d生存率的影响 假手术组的大鼠术后3 d均存活,对照组大鼠3 d生存率为53.3%(8/15),Ac2-26组大鼠3 d生存率为73.3%(11/15),对照组与Ac2-26组差异有统计学意义(P<0.05)。
2.2 Ac2-26后处理对大鼠ROSC后NDS评分的影响 三组大鼠在药物处理前后各时间点的NDS评分比较,差异有统计学意义(F时间=154.321,P=0.000);分组与检测时间之间存在交互效应(F时间*分组=50.612,P=0.000);三组之间的NDS评分差异有统计学意义(F分组=122.950,P=0.000)。三组大鼠在药物处理前NDS评分相等;给予药物处理后不同时间点,对照组的评分均低于假手术组(P<0.01),而Ac2-26组的评分均高于对照组(P<0.01,表1),而Ac2-26组与假手术组的评分稍有差别。
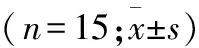
表1 三组大鼠在药物处理前后不同时间点NDS评分比较
2.3 三组大鼠术后3 d血清中炎性因子表达的变化 与假手术组相比,对照组术后3 d血清中IL-1β、IL-6、TNF-α水平升高,差异有统计学意义(P<0.01),而 Ac2-26组血清中IL-1β、IL-6、TNF-α水平略有升高;与对照组比较,Ac2-26组术后3d血清中IL-1β、IL-6、TNF-α水平降低(P<0.05,表2)。
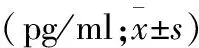
表2 三组大鼠术后3 d血清中IL-1β、IL-6、TNF-α浓度比较
2.4 三组大鼠术后3 d脑前额叶皮质和海马中NF-κB蛋白的相对表达量 Western blot法测定三组大鼠术后3 d前额叶皮质和海马中NF-κB蛋白的相对表达水平(图1)。NF-κB蛋白表达量,与假手术组相比,对照组大鼠前额叶皮质和海马中NF-κB蛋白表达量明显升高,差异有统计学意义(P<0.01),但Ac2-26组中NF-κB蛋白表达量则无明显变化(P>0.05);与对照组相比,Ac2-26组大鼠前额叶皮质和海马中NF-κB蛋白表达量降低,差异有统计学意义(P<0.01,表3)。说明Ac2-26能降低在CA/CPR诱导下升高的NF-κB表达量(P<0.01)。
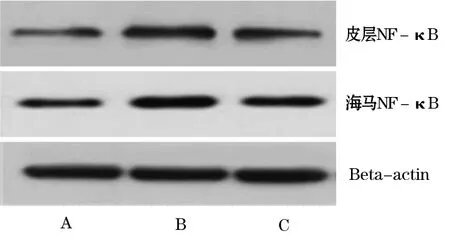
图1 三组大鼠术后皮质和海马中NF-κB蛋白表达的Westem blot结果
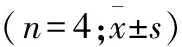
表3 三组大鼠术后3d前额叶皮质和海马中NF-κB蛋白相对表达量的比较
3 讨 论
CA是目前常见的突发心脑血管类危重疾病,多会诱发脑缺血、脑出血等疾病,对脑神经造成严重损害。CA引起脑内供血减少会导致不可逆的脑内神经细胞凋亡或损伤,破坏血脑屏障,进而诱导产生脑组织内更大范围的缺血缺氧症状的发生,使脑损伤加重[9]。Kim等[10]发现,急性脑缺血早期死亡的细胞可引起氧自由基爆发性产生及其他的相关信使激活小胶质细胞,促进NF-κB核转位,活化的NF-κB与大量致炎因子基因启动子结合,促进炎性因子如IL-1β、IL-6、TNF-α等的释放,导致并加重脑血管内皮细胞损伤。研究表明,CA患者在得到及时有效治疗可成功恢复自主循环,但短暂的脑缺血也会引发严重缺血再灌注脑损伤或者复苏后脑病[11]。
ANXA1参与多种疾病相关信号通路的调控。研究发现,ANXA1能通过内源性糖皮质激素调节途径减少白细胞浸润和加快嗜中性粒细胞凋亡,从而抑制嗜中性粒细胞在组织中的积累,参与调控炎性反应的消退,有望成为抗炎治疗的新作用靶点[12]。ANXA1的抗炎活性主要是通过干预中性粒细胞的聚集、迁移而降低其在炎性反应部位的活性。ANXA1在中性粒细胞激活时,可快速以钙离子依赖的方式靶定在细胞的浆膜上,并与黏附分子互相作用,从而抑制白细胞迁移到炎性反应部位发挥作用[3]。本研究发现,Ac2-26组大鼠NDS 评分、血清炎性反应因子、NF-κB表达与假手术组差异较小;与对照组相比,Ac2-26组大鼠神经功能评分、生存率均升高,而血清中IL-1β、IL-6、TNF-α因子和前额叶皮层及海马中NF-κB蛋白表达明显降低。这说明ANXA1拟肽Ac2-26对大鼠心肺复苏后脑损伤具有保护作用。
NF-κB信号通路是目前研究发现最重要的炎性反应通路之一。当机体受到应激刺激时,可促进NF-κBp65亚基与核内NF-κB位点结合,启动靶基因转录,启动炎性因子的表达[13]。ANXA1是一种天然的内源性抗炎蛋白,可通过减少中性粒细胞聚集减轻组织器官的炎性反应。张志泉等[5]发现ANXA1可以直接与细胞核转录因子NF-κB的p65结合从而调节500多个基因的表达。在深低温停循环导致的脑损伤中[14],ANXA1通过与早期大脑NF-κB p65结合从而抑制其转录活动,下调血清和脑组织中促炎因子TNF-α、IL-6和髓过氧化物酶(myeloperoxidase,MPO),减弱缺血再灌注相关小胶质细胞激活和神经炎性反应。Ac2-26抑制TNF-α诱导的ROSC形成并减少内皮细胞中NF-κB通路的激活[15]。因此,膜联蛋白A1拟肽Ac2-26可以通过抑制NF-kB通路,实现对大鼠心肺复苏后脑神经的保护。
