生物学变异在临床生物化学中的应用
2020-09-30周朝琼
周朝琼
生命不是静止状态,而是生物体组分的连续起伏。在实验医学中诊断人体组分的生物学变异(biological variation,BV)被描述为可预测的周期变异、个体内变异(within-subject biological coeffitient of variation,CVI)及个体间变异(between-subject biological coeffitient of variation,CVG)3 种类型[1]。可预测的周期变异在本质上可以是以日、月或季度为单位的随机变异,其与生物体的生长、老化、妊娠等固有的生理变化有关。同一个体检测结果间的差异即为CVI,不同个体检测结果之间的差异即为CVG[2]。在医学实验中所有测量都存在一定程度的固有变异,如样本采集、运输及储存、试剂准备、仪器维护、方法类型等。实验室变异可分为分析前变异(preanalytical coeffitient of variation,CVP)以及分析变异(analytical coeffitient of variation,CVA),为获得可靠结果,CVP和CVA应被降到最低。临床检测中除降低样本固有变异外,还应控制CVI和CVG直到实验完成。为分析临床实际工作中有潜在安全性和有效性的BV 估计值,欧洲临床化学和实验医学联合会(European Federation of Clinical Chemistry and Laboratory Medicine,EFLM)[3]基于目前前沿的方法学和分析技术设计并实施了欧洲生物学变异研究[4]。本文介绍该研究的主要成果,旨在为临床数据测量提供参考依据,现报告如下。
1 研究方法
Carobene 等[5]和Aarsand 等[6]收集欧洲5个国家的91 名健康个体进行2 项研究,分别检测酶类活性和电解质、脂质、尿素、尿酸、血糖等,获得的BV估计值明显低于在线数据库数据[7]。见表1。
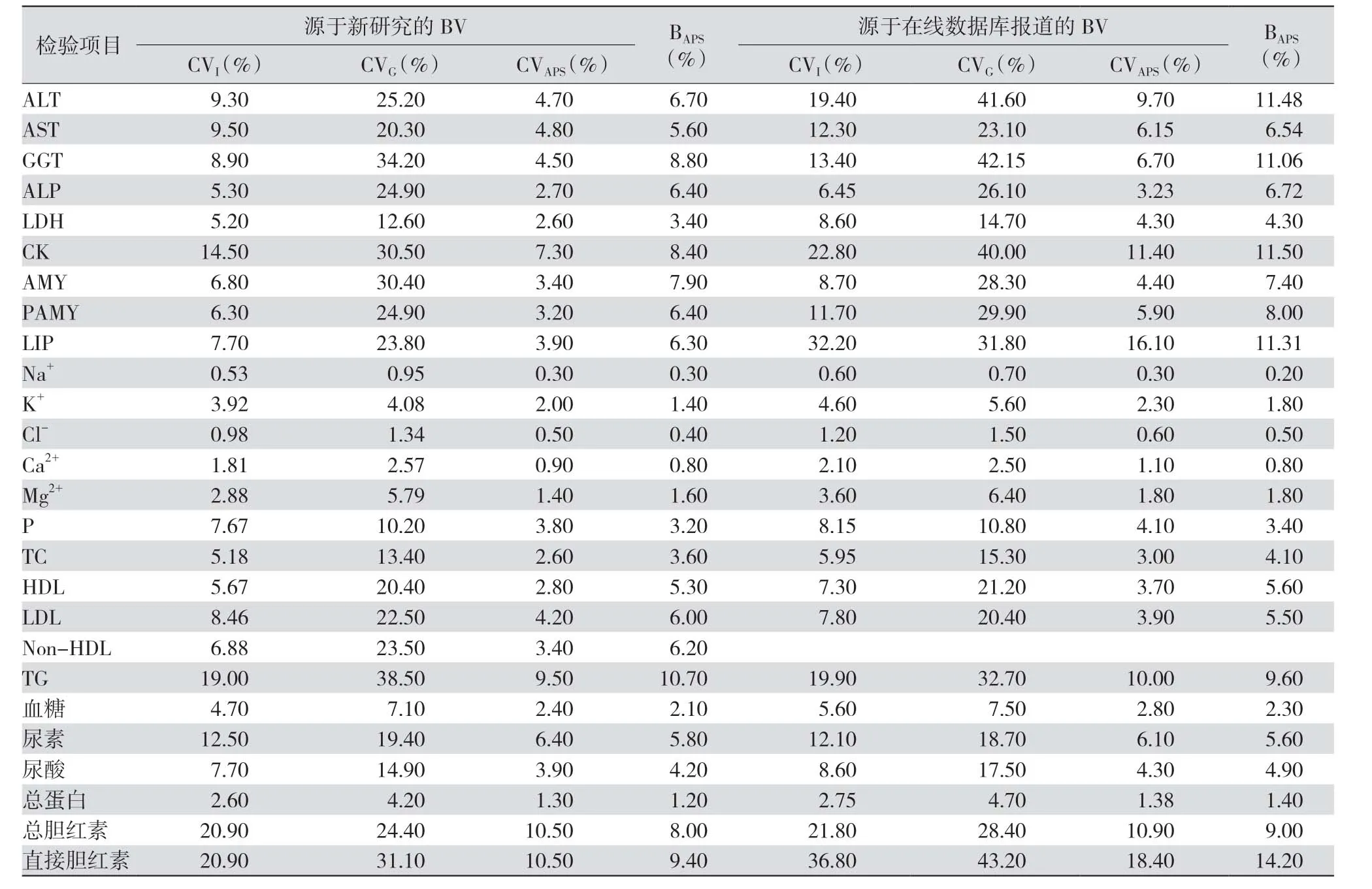
表1 ELMF 新研究BV 数据及在线数据库报道BV 数据的比较
2 实验室BV 的主要应用
① 对分析性能(analytical performance specifications,APS)设定质量标准;② 评估个体连续测量结果变化值(reference change value,RCV)的临床意义;③ 评估以人群为基础的参考值的用处[2]。
2.1 对分析性能设定质量标准 Cotlove 等[8]和Harris[9]提出群体筛查分析变异CVA<0.5诊断、监测及治疗分析变异CVA<0.5CVI。随后,Gowans 等[10]为能使用不受地理位置影响的一般参考区间,提议偏倚(bais,B)∣B∣<0.25许多学者认为,以BV 衍生公式为依据的方法较为实用[11-13],但上述观点均在方法学和技术上存在缺陷,为避免不足,Fraser 等[14]提议将不精密度、偏倚和总允许误差(total allowable error,TEa)建立的质量标准进行分级如下:满意质量标准为CVA<0.5CVI,∣B∣<0.25TEa<1.65×0.5CVI+0.25最优质量标准为CVA<0.25CVI,∣B∣<0.125TEa<1.65×0.25CVI+0.125最低质量标准为CVA<0.75CVI,∣B∣<0.375TEa<1.65×0.75CVI+0.375。通过对基于EFLM 设计并实施的欧洲BV 研究数据(表1)进行计算,得到不同的质量标准(表2),实验室可根据自身情况选择相应的质量标准。
2.2 评估个体连续测量结果间差异的临床意义 临床医师通过参考值或某一特定分析物2个连续结果间的比较解释实验结果。但因实验结果存在内在随机变异,则需通过总变异(total coefficient of variation,CVT)=比 较,CVP为 标 准 化收集,可忽略不计,故CVT=而 连续测定中检测结果的差异是否在预期中,或差异是否有意义取决于Harris 等[15]提出的RCV,RCV=双向变化中Z=1.96(P<0.05),Z=2.58(P<0.01);单向Z 值选用1.65(P<0.05)和2.33(P<0.01)。CVA可从国内质量控制资料适当决定水平(适用于所有实验室分析)中获得,CVI可从数据库文献中获得。见表3。
2.3 评估以人群为基础参考值的有用性 医学实验室检验项目后均会附上健康人群的分布区间,检测时间不同,参考区间也应有所不同[16],故可用个体差异分析检验项目参考区间应用的限制性。比较某检验项目的CVG和CVI可以看出个体变异性与参考值之间的关系,若CVI<CVG,则该检验项目有个体专一性,即患者检验结果已异常但仍在参考值范围内,在临床较常见,此类检验项目不适用于族群筛检。有学者提出将检验项目的个体专一性量化为个体专一性系数(individuality index,II),即因CVA远小于CVI,故简化为CVI/CVG。当II>1.4 时表示该检验项目个体专一性低,参考值有很大参考价值,而当II<0.6 时表示该检验项目个体专一性高,参考值的参考价值有限,反复出现检验值超出参考值范围时应计算II,较能反映此异常值对患者的临床意义[18]。如某项检验II 值太低,则应考虑按年龄、性别、种族等进行分组,或改用分析误差较小的检验方法,可提高II 使参考范围更有价值。最新研究中对于除电解质外的大多数检测项目,II≤0.6。见表3。
3 讨论
本文介绍的两项研究利用严格的实验方案分析来自欧洲5个国家健康个体的血清,获得酶活性、电解质、脂质、尿素、尿酸、总蛋白、胆红素和葡萄糖的CVI和CVG指标。除尿素和低密度脂蛋白(low density lipoprotein,LDL)外,所有被测量的CVI估计值均低于在线数据库中的数据,这里提供的检测项目测定基于良好的分析方法和标准化的测量系统,因此可解释为何获得的BV 估计值明显低于在线数据库[19]。
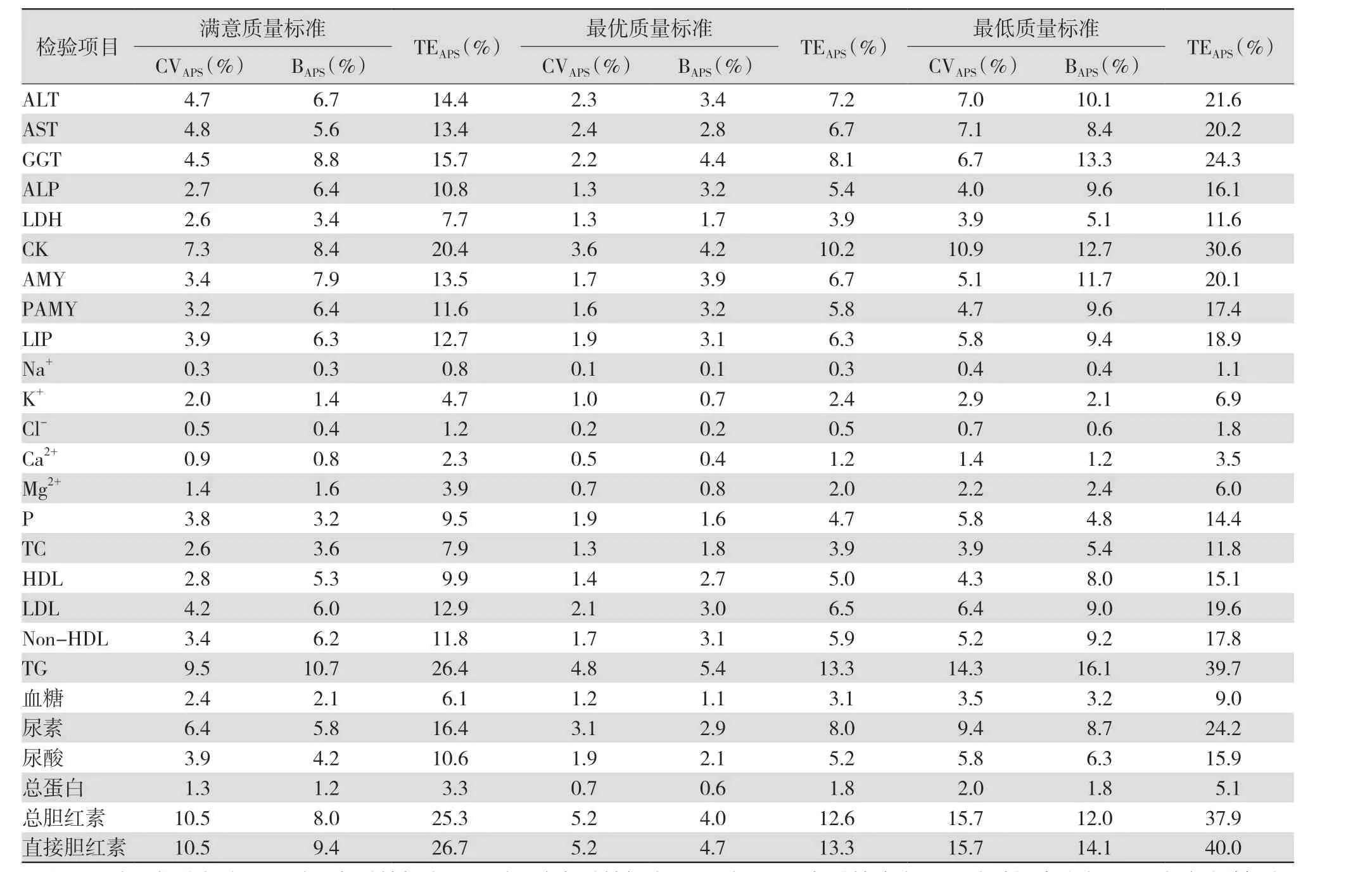
表2 基于欧洲BV 研究数据得到的不同质量标准
可靠的BV 数据对各检验指标的APS 极为重要,米兰会议提出3个模型定义APS:基于结果、基于BV 和基于最先进的技术[20]。EFLM 的APS 与在线数据相比更严格,但对实验室检测质量的提高具有重要意义。酶催化活性的测量是临床实验室最常见的检测项目之一,国际临床化学和实验室联盟(International Federation of Clinical Chemistry and Laboratory Medicine,IFCC)关注酶催化活性测定方法的标准化[21],但在最近EFLM 出版物中发现酶催化活性测定方法具有多样性[22],在线数据库中多个检验项目使用的检测方法早于IFCC 引入的标准方法[23-24],临床实验室测定的血清酶活性常作为诊断和监测肝脏、胰腺、骨骼肌和许多其他系统疾病的关键标志物[25]。已有研究报道过酶活性的BV,但其有效性有待进一步证实[23]。有研究报告,基于米兰会议提出的3个模型且采用目前较优方法学和分析技术得出的BV 数据符合EFLM 新公布BV 研究的所有要求[5,26],因此提供了更可靠的BV 数据[27],更具有参考价值。
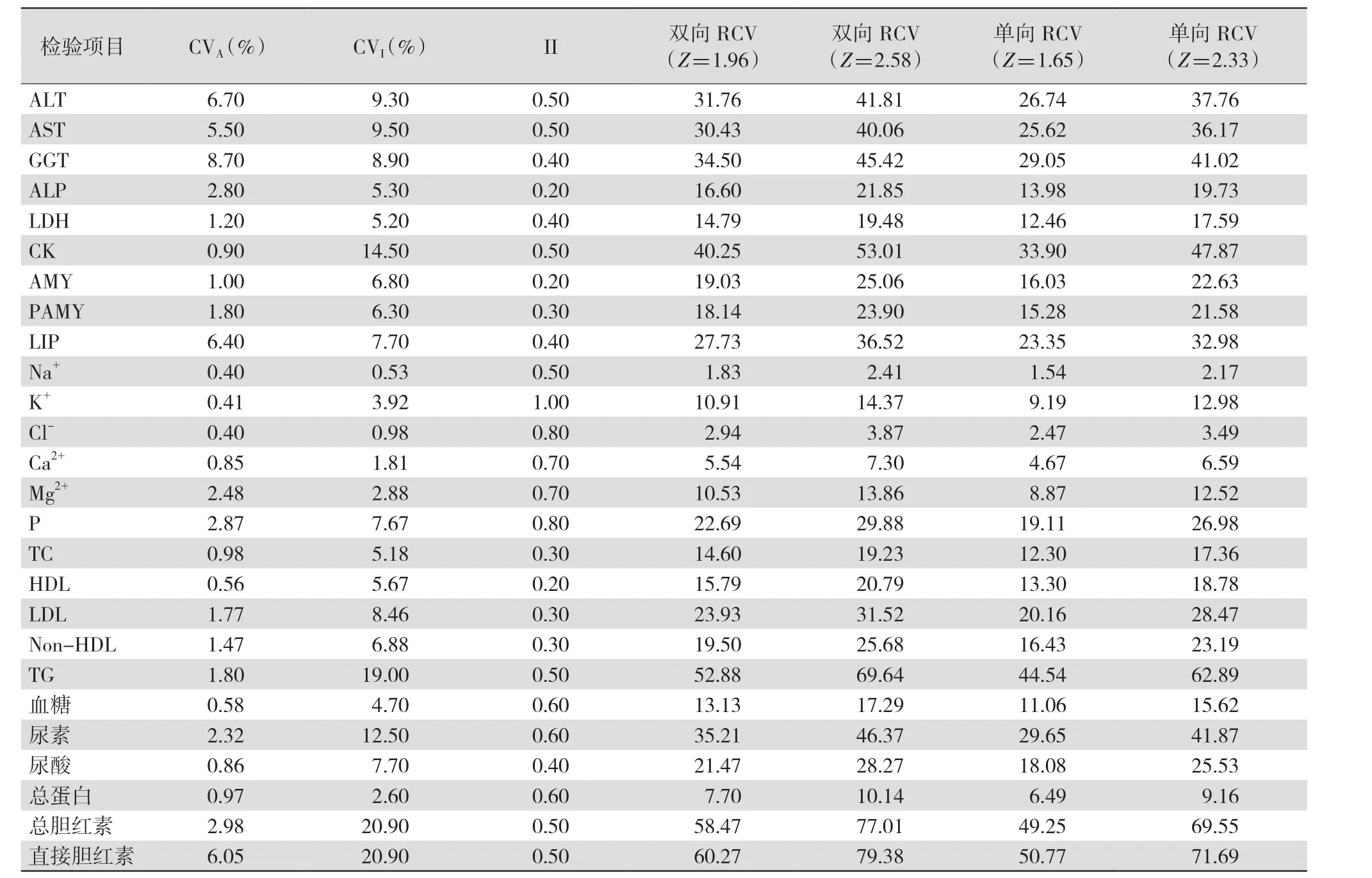
表3 检验项目参考值及其有用性评估表
理想的RCV 衍生出的数据可能在一些临床应用中敏感度过高,需要对BV 进行参考人群的替代研究。因不同实验室使用的检测方法、仪器以及人员等不同,质量指标大相径庭,故实验室可根据适用性对质量标准进行选择。将当前数据与在线数据库比较发现,丙氨酸转氨酶(alanine aminotransferase,ALT)、γ-谷氨酸转肽酶、肌酸激酶、胰淀粉酶、脂肪酶和直接胆红素在利用CVI计算其他指数时估计值差异最大。本研究中ALT 和天冬氨酸转氨酶(aspartate aminotransferase,AST)检测的CVI几乎相同,而在线数据库中ALT 的CVI高于AST,可能由数量不同引起[19]。脂肪酶和胰淀粉酶可作为急性胰腺炎的诊断指标[28]。文中胰淀粉酶及脂肪酶和在线数据库CVI存在差异的原因是在线数据库中报告的值是基于多年前的研究[27],二者方法上存在差异。对于尿素和LDL 的CVI估计值高于在线数据库,尿素可能由研究人群数量引起,LDL 浓度存在季节性变化[29]。同时最新研究中对电解质(除Na+)外的多数被测项目的II≤0.6,表明参考区间对这些被测项目的效用较低,其参考区间临床意义不大。
多种现代化验证方法的使用意味着数据传递与当前临床实践更相关[30-31]。此外,该研究人群为多国参与者群体,在年龄和性别分布上较均衡,可对分层数据集进行可变性评估。这些数据突出了两个研究[5-6]BV 估计值的适用性。故这两篇报道所获得的数据在医疗保健系统中广泛适用[5-6],并且可用于为系统提供APS 以及为临床上重要的测量数据提供正确的诊断和监测依据。
利益冲突作者声明不存在利益冲突
