荧光假单胞杆菌磷脂酶B界面催化分子机制初探
2020-09-29赵依威姜芳燕李春戴大章
赵依威,姜芳燕,李春,戴大章
(北京理工大学化学与化工学院,北京100081)
引 言
磷脂酶(phospholipase, PL)是催化磷脂水解的一类酶的总称,广泛应用于油脂精炼、磷脂改性与生物医药等领域[1]。根据PL作用位点的不同可分为PLA1、PLA2、PLB、PLC、PLD(图1)。PLA1是专一水解天然磷脂Sn−1 位酰基的酶,可以得到Sn−2 酰基溶血磷脂酰乙醇胺和溶血磷脂酰胆碱;PLA2专一催化水解磷脂Sn−2 位酰基,生成溶血磷脂和脂肪酸;PLC作用于磷脂酰胆碱,生成甘油二酯和磷脂胆碱;PLD 水解磷脂酰胆碱生成磷脂酸和胆碱,而PLB 则能同时水解磷脂Sn−1 位和Sn−2 位酰基,具有酯水解酶和溶血磷脂酶−转酰基酶的活性。PL是一类界面酶,在异相系统(油、水界面)中具有较高的催化活性,具有界面激活(interfacial activation)现象[2]。
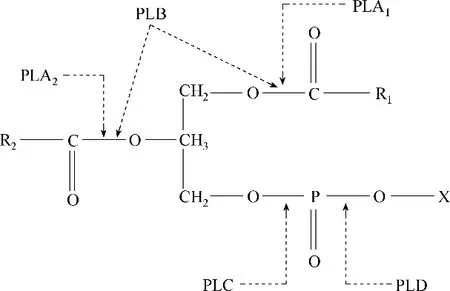
图1 PL作用于磷脂分子位点示意图(X代表氢、胆碱、乙醇胺、丝氨酸、肌醇等)Fig.1 The diagram of phospholipases acting on sites of the phosphatidylcholine
本课题组从油脂厂附近土壤中筛选到一株PLB高产菌株Pseudomonas fluorescens BIT−18[3],该菌株能产生高活性PLB(Pf−PLB),首次克隆到Pf−PLB 基因(GenBank登录号:HQ401021.1),构建了表达载体pET−28a(+)−pfplb,并将其成功转入宿主细胞E. coli BL21(DE3)中,实现了Pf−PLB 的诱导型表达[4]。利用自行构建的工程菌株发酵生产的rPf−PLB 对大豆毛油进行脱胶时,豆油磷含量由234 mg/kg 下降至4.1 mg/kg,达到了植物油精炼的国家标准(10 mg/kg)和欧州标准(5 mg/kg),显示了良好的应用前景。为进一步优化工艺参数和拓展其应用范围,本文将对Pf−PLB 界面催化的分子机制进行探讨,旨在为PLB的理性改造及其工业化推广应用提供理论依据。
1 材料与方法
1.1 试剂
Pseudomonas fluorescens BIT−18 磷 脂 酶B(Pf−PLB),本实验室发酵生产。大豆磷脂,北京美亚斯磷脂技术有限公司产品。其他试剂均为国产分析纯。
1.2 软件
多重序列比对软件ClustalX 2.0 和DNAMAN 10.0;蛋白质结构模拟软件Modeller 9.18;蛋白质结构显示工具Swiss Pdb−Viewer 4.1等。
1.3 主要分子操作及酶分离纯化
细菌总DNA 提取、回收DNA、感受态细胞的制备、连接产物转化、质粒提取、突变体构建等操作参照文献[5]进行。
1.4 氨基酸序列理化性质分析
参考文献[6]的方法,采用瑞士生物信息研究所开发的ExPASy(Expert Protein Analysis System)中的ProtParam 分析Pf−PLB 的氨基酸组成、分子量、等电点(pI)等基本理化特性。
1.5 序列同源性分析
将Pf−PLB 氨基酸序列提交NCBI 数据库,进行BLASTP 比对,搜索同源蛋白序列;将所测序列通过BLASTN 与NCBI 数据库序列进行比对,查找相似核酸序列,利用软件ClustalX 2.0 和MEGA 4.0 构建系统进化树。
1.6 Pf-PLB蛋白结构预测
采用PredictProtein[7]和SOMPA[8]分析Pf−PLB 的二级结构;采用Modeller 9.18[9]同源建模预测Pf−PLB的三级结构。
2 结果与讨论
2.1 Pf-PLB氨基酸序列理化性质分析
基于Pf−PLB 一级序列,借助于ExPASy 软件中的ProtParam 与ProtScale 模块对Pf−PLB 的理化性质进行了分析。ProtParam 分析结果表明,Pf−PLB 的GRAVY(grand average of hydropathicity)值为−0.298,说明Pf−PLB 为亲水蛋白(在2 与−2 之间,正值表明此蛋白为疏水蛋白,负值表明为亲水蛋白);ProtScale 分析结果表明,Pf−PLB 的N 末端含有较多的疏水性残基,而C 末端氨基酸序列则表现为较明显的亲水性(图2)。
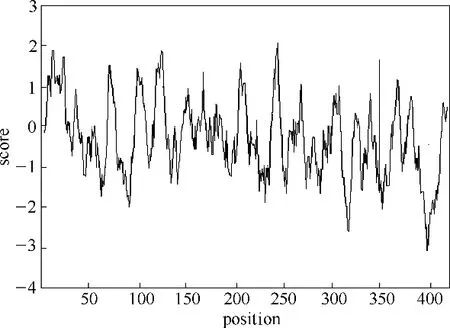
图2 ProtScale对Pf−PLB的疏水性的分析(正值为疏水,负值为亲水)Fig.2 Analysis of the hydropathicity of Pf−PLB by ProtScale
一般来说,蛋白质亲水区多位于分子表面,这种结构有利于维持其在水溶液中的稳定性。若某区域疏水性较强却位于分子表面,则会影响其在水溶液中的稳定性。例如P.aeruginosa 脂肪酶的N 端具有强疏水性且位于分子表面,因此该蛋白在水溶液中容易通过疏水作用发生聚集或吸附[10]。因此,根据ProtParam 和ProtScale 分析结果,结合其在溶液中的稳定性特征,初步判断Pf−PLB 的亲水性C 端位于酶蛋白分子表面,疏水性N端位于内部,而酶蛋白分子总体上表现为亲水性。
2.2 Pf-PLB蛋白质二级结构分析
蛋白质二级结构的预测大多以已知三维结构和二级结构的蛋白质为依据。因此,根据Pf−PLB 的氨基酸序列,采用SOMPA 来分析Pf−PLB 的二级结构(图3)。结果表明,在Pf−PLB 蛋白质二级结构中,含有较高比例的无规卷曲(54.14%),其余为β−折叠片层(24.59%)和α−螺旋(17.97%),此外还有少量的β−转角(3.31%)。此外,PredictProtein 预测Pf−PLB 为球状蛋白,其序列中不含半胱氨酸,因此不形成二硫键。
2.3 Pf-PLB界面催化机制分析
Pf−PLB 是一类能够降解磷脂的酯酶,在异相系统(油、水界面)中具有较高的催化活性。此类酶大多具有一个共同特点,即具有“舱盖(hatch)”结构域,其覆盖在活性位点,阻止底物“非请自入”[11]。经同源建模分析,Pf−PLB 结构与P.aeruginosa FadL 蛋白结构、E.coli FadL蛋白结构之间有以下共性特征(图4):整体结构为14 个Strand 组成的β−桶;Loop 3 和Loop 4在β−桶上侧,形成类似盖子(lid)结构域;第3个Strand 形成扭结(kink)结构,从而使β−桶侧面有一个侧向开口;三个α−螺旋形成hatch 结构域,作为β−桶的桶底。
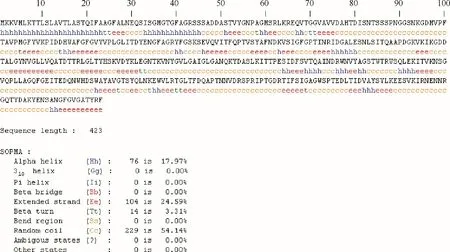
图3 SOMPA对Pf−PLB进行二级结构预测Fig.3 Prediction of secondary structure of Pf−PLB by SOMPA

图4 Pf−PLB与来源于E.coli和P.aeruginosa的FadL结构比较Fig.4 Structure comparison between Pf−PLB and FadL from E.coli and P.aeruginosa
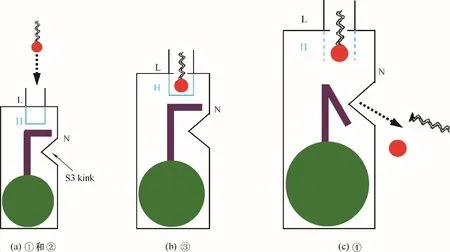
图5 Pf−PLB界面催化的可能机制Fig.5 Possible mechanism of Pf−PLB interfacial catalysis
基于Pf−PLB 结构特征,参考Berg 等[12]和Hearn等[13]在Science 和Nature 上对Pf−PLB 同源结构FadL的描述,本文提出“掀盖进入,侧向离去”假说模型(图5),以阐述Pf−PLB 界面催化的可能机制。模型假定Pf−PLB 催化底物磷脂的过程主要有以下几个步骤:①受Pf−PLB 分子的低亲和力结合位点吸引,界面上的底物磷脂逐渐靠近β−桶;②当底物磷脂接近β−桶时,Loop 3 和Loop 4 发生结构调整,敞开盖子结构域(lid)便于底物进入β−桶,即“掀盖进入”;③底物进入β−桶后,依次与低亲和力结合位点、高亲和力结合位点结合;④底物磷脂在Pf−PLB 活性中心催化基团作用下,水解生成磷酸甘油酸和游离脂肪酸,同时Pf−PLB 的N 端结构域的结构发生调整,以便产物从第3 个Strand 的扭结(kink)结构侧口离开β−桶,即“侧向离去”。
为验证上述机制,采用定点突变方法将Pf−PLB第3个Strand 上126位苯丙氨酸L(CTC)突变为精氨酸R(CGA),同时将第2 个Strand 上103 位缬氨酸V(GTA)突变为谷氨酸E(GAA),将双重突变Pf−PLB的催化特性与单重突变和未突变Pf−PLB 进行比较分析。由于精氨酸和谷氨酸分别带有正电荷和负电荷,因此可形成盐桥,形成的盐桥可关闭S3 和S2之间的侧向开口,造成产物的释放障碍,使Pf−PLB催化活性大幅降低(图6)。
结果表明,V103E 突变体Pf−PLB 和L126R 突变体Pf−PLB 的活性分别是未突变Pf−PLB 的83.9%和74.2%,而V103E/L126R 双重突变体Pf−PLB 的活性则仅为未突变Pf−PLB的7%。同时,Modeller分子模拟结果显示,未突变Pf−PLB[图7(a)]在S2 和S3 之间有明显的侧向开口,而突变Pf−PLB(V103E/L126R)[图7(b)]则没有侧向开口。这些结果较好地佐证了本文提出的“掀盖进入,侧向离去”假说机制:V103E/L126R 双重突变体Pf−PLB 的103 位谷氨酸和126位精氨酸间形成了盐桥,关闭了S3和S2之间的侧向开口,从而阻止了产物从β−桶的侧向开口离去,导致产物在β−桶内大量积聚而形成产物抑制,因此V103E/L126R双重突变体Pf−PLB 的催化活性大幅降低。
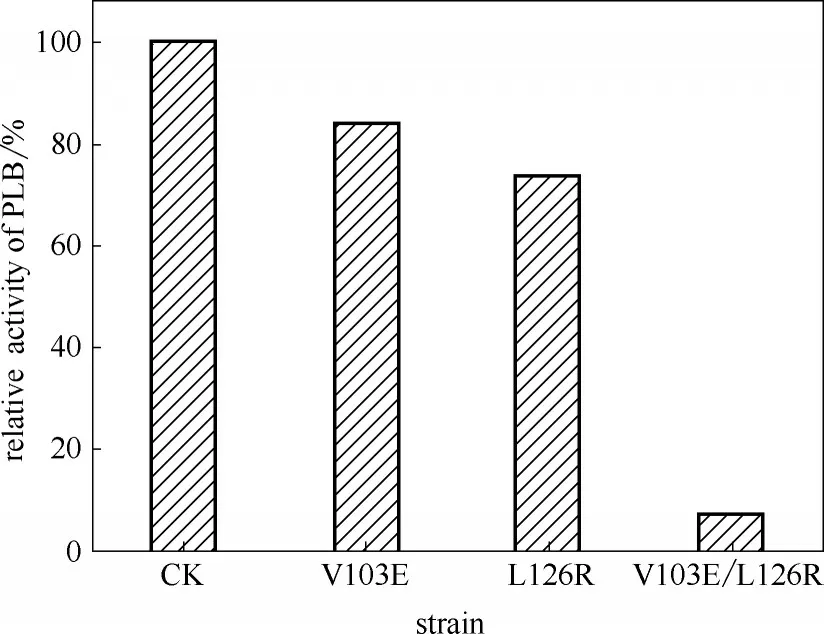
图6 不同菌株所产Pf−PLB活性分析Fig.6 Activity analysis of Pf−PLB from different strains
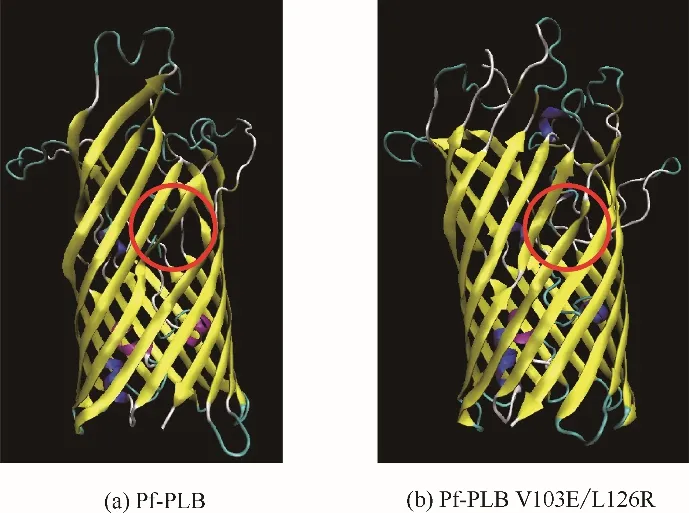
图7 Pf−PLB的Modeller模拟Fig.7 Modeller simulation of Pf−PLB
3 结 论
采用同源建模的方法研究了Pf−PLB 的三维空间结构,并基于其结构特征,在分子水平上了提出了“掀盖进入,侧向离去”假说模型,阐述了Pf−PLB界面催化的可能机制,并采用定点突变对Pf−PLB 的结构进行了改造,分别考察突变体Pf−PLB 与单重突变和未突变Pf−PLB 的催化特性,从而对所提出的机制模型进行了验证。结果表明,双重突变体Pf−PLB的103 位谷氨酸和126 位精氨酸间形成的盐桥关闭了β−桶的侧向开口,造成产物释放障碍,引起产物在β−桶内大量积聚而形成产物抑制,致使其催化活性大幅降低。磷脂酶B 界面催化分子机制的研究,对酶分子结构理性改造及其工业化推广应用具有重要的指导意义。
