芬太尼对2型糖尿病大鼠心脏的保护作用及对蛋白激酶D和内质网应激激活的调节作用①
2020-09-29王丽萍季中华芮海涛曾路路暨南大学附属珠海医院麻醉科珠海519000
王丽萍 季中华 任 莉 王 辉 芮海涛 曾路路 (暨南大学附属珠海医院麻醉科,珠海 519000)
2 型糖尿病 (type 2 diabetes mellitus,T2D) 是一种以胰岛素抵抗并伴有胰岛 β 细胞功能缺陷所致的胰岛素分泌不足而引起的以血糖水平升高、血脂异常为特征的代谢性疾病[1]。糖尿病患者易发生多种心血管并发症,包括冠心病、心肌肥厚和心力衰竭等[2]。糖尿病性心肌病是糖尿病患者死亡的主要原因,全世界流行病患者中新诊断的糖尿病性心肌病病例数逐渐上升[3]。芬太尼为阿片受体激动剂,属强效麻醉性镇痛药,临床上常用于各种疼痛及外科、妇科等手术后和手术过程中的镇痛。研究表明芬太尼能够影响心肌收缩功能,但其对T2D大鼠的作用尚不清楚[4]。蛋白激酶D(protein kinase D,PKD)是钙/钙调蛋白依赖性蛋白激酶(calcium/calmodulin dependent protein kinase,CAMK)组的丝氨酸/苏氨酸激酶的最新成员,参与多种细胞生物过程调节,包括细胞存活、迁移、分化和增殖[5]。已有研究证明PKD在心血管疾病的发生中起重要作用[6]。内质网(endoplasmic reticulum,ER)是参与细胞凋亡内在途径的细胞器,其应激介导的细胞凋亡是糖尿病心肌病发生发展的重要机制之一[7]。本文主要探讨芬太尼对T2D大鼠心脏的作用及其及对蛋白激酶D和ER应激激活的调节作用,以期为糖尿病的治疗提供理论依据。
1 材料与方法
1.1材料
1.1.1实验动物 清洁级SD大鼠120只,体质量(190±20)g,购自四川夏派森医药科技有限公司,许可证号:SYXK(川)2017-203。温度、湿度分别控制在25℃、50%左右,大鼠在实验前给予普通饲料适应性喂养1周。
1.1.2试剂 普通饲料和高脂高糖饲料(南通特洛菲饲料科技有限公司);链脲佐菌素(上海艾研生物科技有限公司);RIPA裂解缓冲液(南京海克尔生物科技有限公司);BCA试剂盒(上海易色医疗科技有限公司);caspase-3抗体、Bcl-2抗体(碧云天生物技术研究所);Bax抗体(上海酶联生物科技有限公司);PKD抗体(上海信裕生物技术有限公司);GRP78抗体(上海优宁维生物科技有限公司);IL-6、IL-18、IL-1β、TNF-α、心肌肌钙蛋白Ⅰ(cardiactroponin Ⅰ,cTnⅠ)和肌酸激酶同工酶MB(creatine kinase isoenzyme MB,CK-MB)ELISA试剂盒(上海联硕生物刻科技有限公司);FINS ELISA 试剂盒(苏州鸿信生物技术有限公司);Annexin V-FITC/PI细胞凋亡检测试剂盒(大连美轮生物技术有限公司)。
1.1.3仪器 HCC400全自动生化分析仪(山东国康生物科技有限公司);MRBP鼠无创血压计(上海玉研科学仪器有限公司);FACS Calibur流式细胞仪(美国碧迪医疗器械有限公司)。
1.2方法
1.2.1造模及给药 随机选择20只大鼠作为对照组,喂养正常饲料,剩余100只大鼠喂养高脂饲料。4周后喂养高脂饲料的大鼠腹腔注射35 mg/kg的链脲佐菌素(STZ),对照组大鼠注射等量生理盐水。1周后测定尾静脉空腹血糖(FBG),大鼠血糖水平高于11.1 mmol/L即为糖尿病模型构建成功。8周后,芬太尼低、中、高剂量组大鼠分别每天注射0.5、1.0、2.0 μg/kg的芬太尼,阳性药物对照组大鼠每天灌胃给予75 mg/kg二甲双胍,对照组和模型组分别注射等量生理盐水,连续2周。大鼠禁食1晚后,颈静脉取血,麻醉后处死,摘取心脏[8,9]。
1.2.2血清FBG、TG及TC含量测定 采集血液离心,将血清置于全自动化学分析仪检测血糖(fasting plasma glucose,FBG)、总胆固醇(total cholesterol,TG)及三酰甘油(triglycerides,TC)含量。
1.2.3大鼠HR、SBP及DBP测定 给药最后1 d晚上,用MRBP鼠无创血压计测量心率(heart rate,HR)、收缩压(systolic blood pressure,SBP)及舒张压(diastolicblood pressure,DBP)。
1.2.4HE染色观察心脏损伤 将心脏组织置于4%甲醛固定后,乙醇梯度浓度脱水,石蜡包埋切片。石蜡切片经二甲苯脱蜡、乙醇覆水、苏木精染色、乙酸分化、返蓝、伊红染色后,脱水固定装片,400倍显微镜下观察。
1.2.5流式细胞术检测心肌细胞凋亡情况 培养48 h后,胰酶消化各组心肌细胞,离心,以1×106个/ml的浓度重悬。细胞悬液中加入5 μl Annexin-V-FITC和5 μl PI,置于黑暗房间孵化15 min,流式细胞仪分析细胞凋亡情况。
1.2.6Western blot检测心肌细胞中Bax、Bcl-2、Cleaved caspase-3、PKD和GRP78蛋白表达情况 RIPA裂解液提取各组心肌细胞总蛋白,BCA试剂盒检测总蛋白浓度,经SDS-PAGE分离后,转移至PVDF膜,脱脂牛奶室温封闭2 h,加入一抗(Bax 1∶1 000、Bcl-2 1∶1 000、Cleaved caspase-3 1∶1 000、PKD 1∶500、GRP78 1∶1 000)4℃封闭过夜后,加入对应二抗室温封闭1 h,ECL曝光。
1.2.7ELISA检测血样中FINS、IL-6、TNF-α、IL-10、IL-1β含量和心肌细胞中cTnⅠ和CK-MB含量 按照各ELISA试剂盒说明书操作,检测血样中胰岛素(fasting insulin,FINS)、炎症因子IL-6、TNF-α、IL-10、IL-1β含量及心肌细胞中心肌损伤标记物cTnⅠ和CK-MB含量。
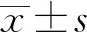
2 结果
2.1T2D大鼠模型构建成功 如表1所示,对照组大鼠造模前后24 h血糖含量变化无统计学意义,模型组大鼠造模24 h后血糖含量显著高于造模前(P<0.01),表明100只大鼠T2D模型构建成功。
表1 各组大鼠造模前后 24 h血糖含量
2.2芬太尼改善T2D大鼠糖脂代谢 与对照组相比,模型组大鼠血液中FBG、TG、TC和FINS含量明显升高(P<0.01),表明T2D大鼠出现糖脂代谢异常;与模型组相比,芬太尼低剂量组大鼠血液中FBG、TG、TC和FINS含量变化无统计学意义,中剂量组大鼠血液中FBG、TG、TC和FINS含量明显降低(P<0.05),高剂量组和阳性药物对照组大鼠血液中FBG、TG、TC和FINS含量显著降低(P<0.01),说明芬太尼同二甲双胍都能够改善T2D大鼠的糖脂代谢,见图1。
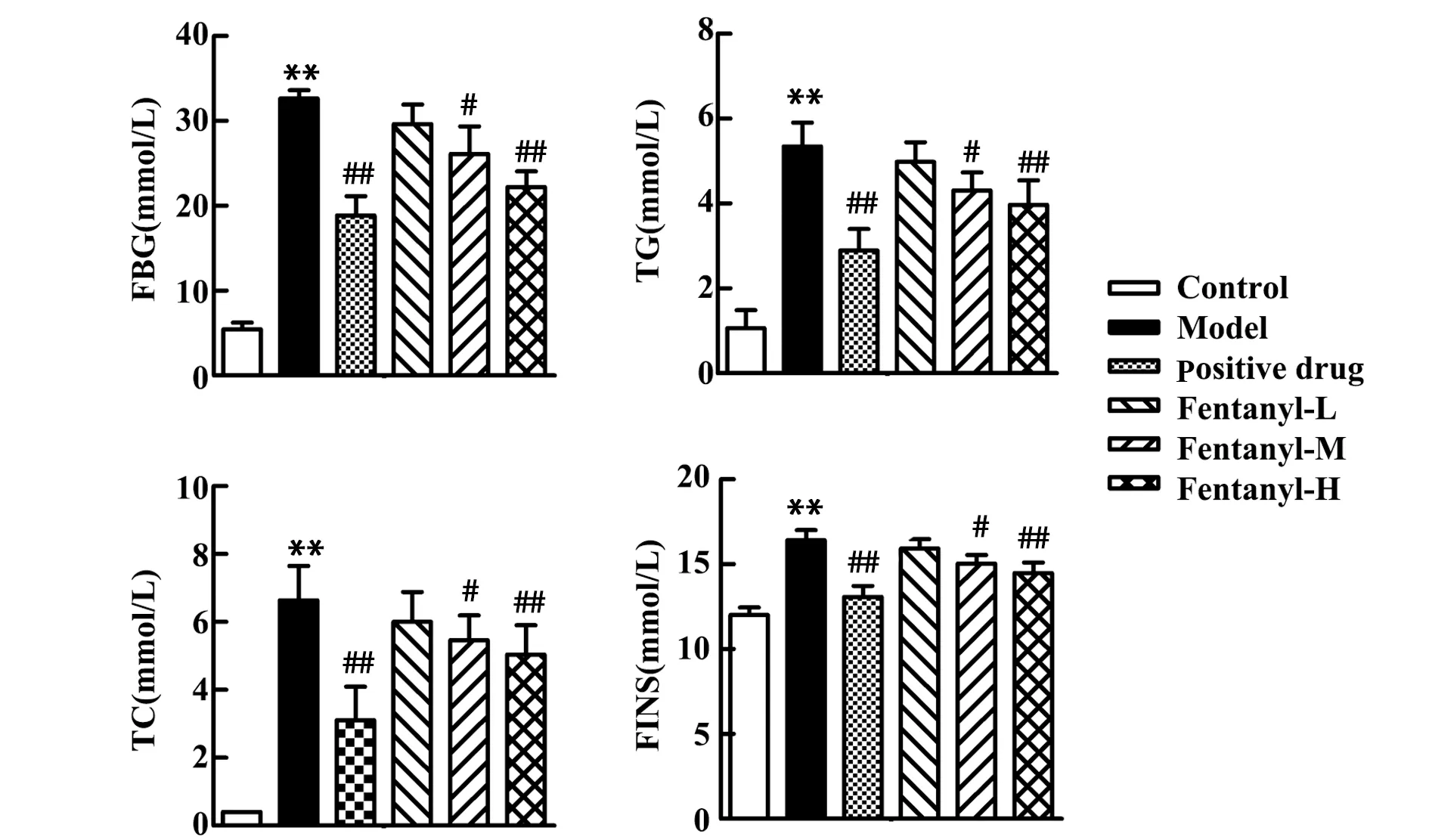
图1 各组大鼠糖脂代谢情况
2.3芬太尼改善T2D大鼠心脏功能 与对照组相比,模型组大鼠SBP和DBP变化无统计学意义,HR明显升高(P<0.05),表明T2D大鼠心脏功能减弱;与模型组相比,芬太尼低、中剂量组大鼠HR、SBP和DBP变化无统计学意义,高剂量组和阳性药物对照组大鼠SBP和DBP变化无统计学意义, HR明显降低(P<0.05),表明芬太尼同二甲双胍都能够改善T2D大鼠的心脏功能,见图2。
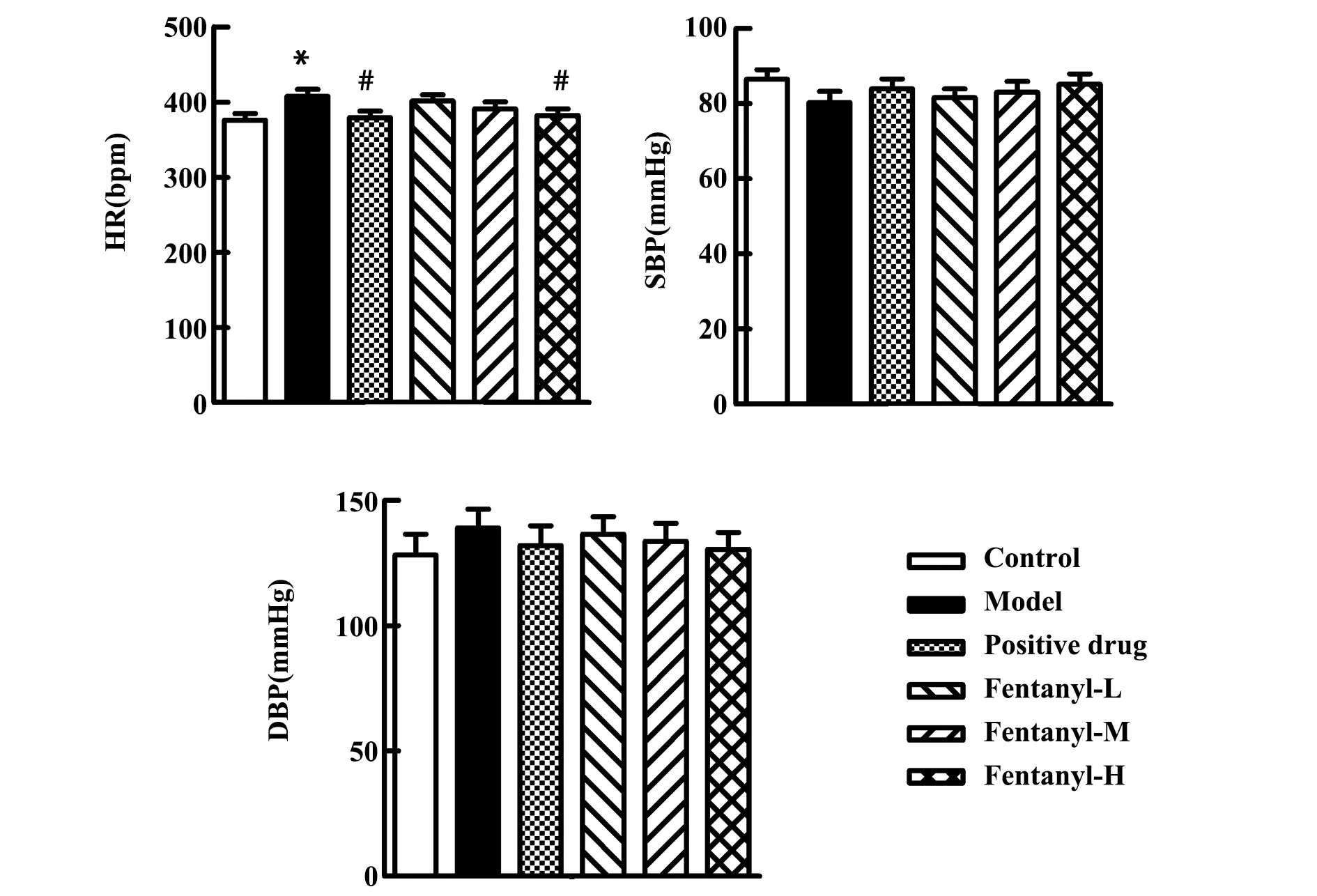
图2 MRBP鼠无创血压计测量各组大鼠HR、SBP和DBP含量
2.4芬太尼减轻T2D大鼠心肌损伤 通过HE染色观察发现,对照组大鼠心肌组织结构致密整齐,心肌纤维完整,无心肌纤维断裂;模型组与芬太尼低剂量组大鼠心肌组织出现细胞排列严重紊乱,大量心肌纤维断裂,细胞变性坏死严重;芬太尼中、高剂量组和阳性药物对照组大鼠心肌组织细胞排列紊乱程度依次减轻,心肌纤维断裂依次减少,细胞变性坏死程度依次减轻(图3A)。 ELISA检测心肌细胞中心损伤标记物表达水平发现,与对照组相比,模型组大鼠心肌细胞中CK-MB和cTnⅠ含量明显提高(P<0.01,图3B),表明T2D大鼠心肌受损;与模型组相比,芬太尼低剂量组大鼠心肌细胞中CK-MB和cTnⅠ含量无明显变化,中剂量组大鼠心肌细胞中CK-MB和cTnⅠ含量明显降低(P<0.05,图3B),高剂量组和阳性药物对照组大鼠心肌细胞中CK-MB和cTnⅠ含量显著降低(P<0.01,图3B),表明芬太尼同二甲双胍均能减轻T2D大鼠心肌损伤。流式细胞术检测心肌细胞凋亡发现,与对照组相比,模型组大鼠心肌细胞凋亡率明显升高(P<0.01,图3C),表明T2D诱导大鼠心肌细胞凋亡;与模型组相比,芬太尼低剂量组大鼠心肌细胞凋亡率变化差异无统计学意义,中剂量组大鼠心肌细胞凋亡率明显降低(P<0.05,图3C),高剂量组和阳性药物对照组大鼠心肌细胞凋亡率显著降低(P<0.01,图3C),表明芬太尼同二甲双胍均能减轻T2D大鼠心肌细胞凋亡。Western blot检测心肌细胞中Bax、 Bcl-2、Cleaved caspase-3蛋白表达水平可知,与对照组相比,模型组大鼠心肌细胞中Bax/Bcl-2、Cleaved caspase-3蛋白表达明显上调(P<0.01,图3D),提示T2D大鼠诱导心肌细胞凋亡;与模型组相比,芬太尼低剂量组大鼠心肌细胞中Bax/Bcl-2、Cleaved caspase-3蛋白表达变化差异无统计学意义,中剂量组大鼠心肌细胞中Bax/Bcl-2、Cleaved caspase-3蛋白表达明显降低(P<0.05,图3D),高剂量组和阳性药物对照组大鼠心肌细胞中Bax/Bcl-2、Cleaved caspase-3蛋白表达显著降低(P<0.01,图3D),提示芬太尼同二甲双胍均能减轻T2D大鼠心肌细胞凋亡。
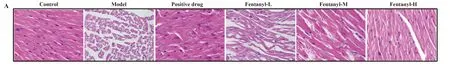
图3 各组大鼠心肌损伤情况
2.5芬太尼减轻T2D大鼠炎症反应 ELISA检测血液中IL-6、TNF-α、IL-10、IL-1β含量结果显示,与对照组相比,模型组大鼠血液中IL-6、TNF-α、IL-10、IL-1β含量明显升高(P<0.01),表明T2D引起大鼠炎症反应;与模型组相比,芬太尼低剂量组大鼠血液中炎症因子IL-6、TNF-α、IL-10、IL-1β含量变化差异无统计学意义,中剂量组大鼠血液中炎症因子IL-6、TNF-α、IL-10、IL-1β含量明显降低(P<0.05),高剂量组和阳性药物对照组大鼠血液中IL-6、TNF-α、IL-10、IL-1β含量显著降低(P<0.01),表明芬太尼同二甲双胍均可减轻T2D大鼠的炎症反应,见图4。
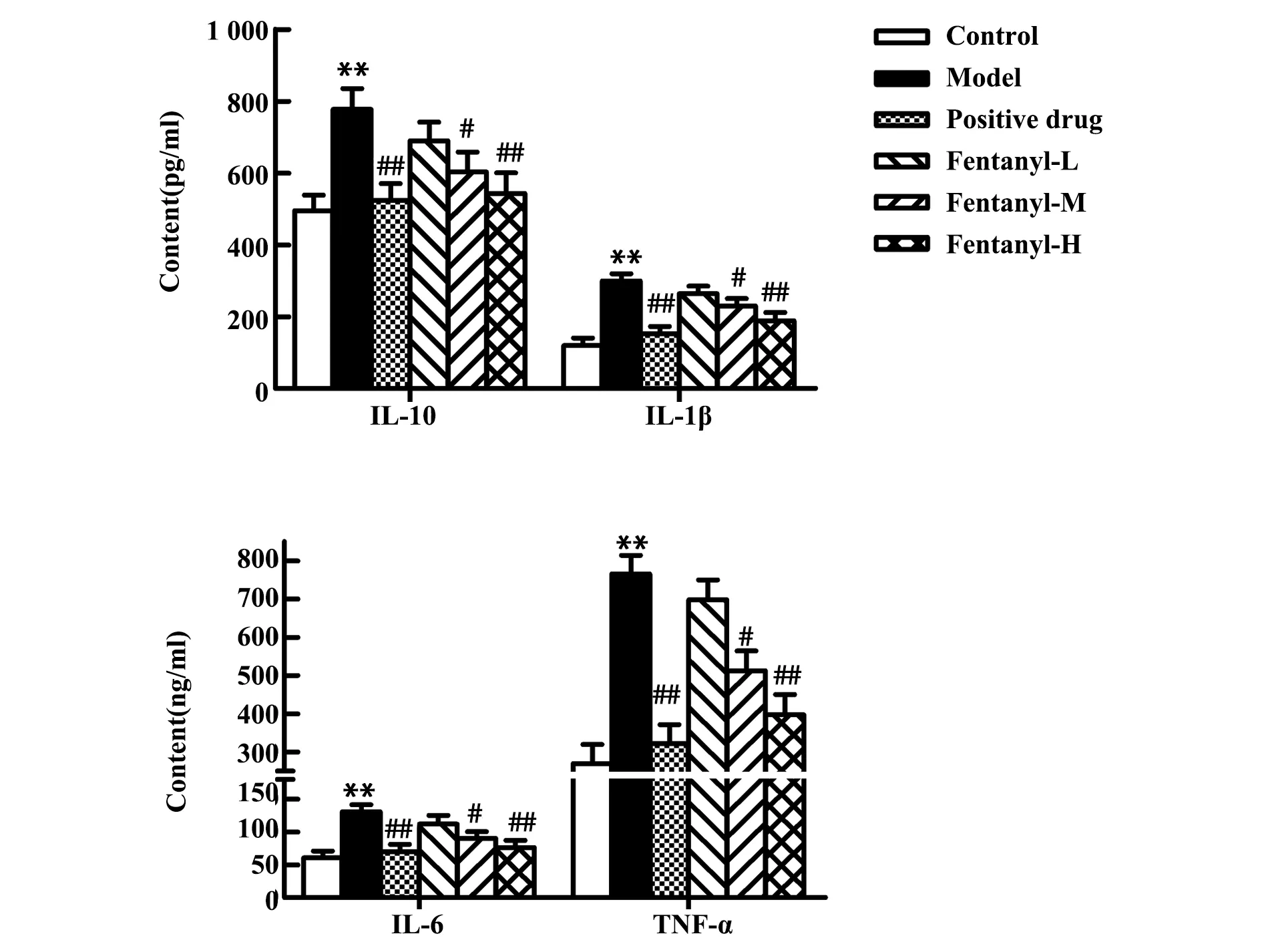
图4 ELISA检测血液中炎症因子IL-6、TNF-α、IL-10、IL-1β的含量
2.6芬太尼抑制T2D大鼠PKD和内质网应激激活 Western blot检测各组大鼠心肌细胞中PKD和GRP78蛋白表达情况发现,与对照组相比,模型组大鼠心肌细胞中磷酸化PKD和GRP78蛋白表达明显上调(P<0.01),提示T2D大鼠诱导心肌细胞PKD和内质网应激激活;与模型组相比,芬太尼低剂量组和阳性药物对照组大鼠心肌细胞中磷酸化PKD和GRP78蛋白表达无明显变化,芬太尼中剂量组大鼠心肌细胞中磷酸化PKD和GRP78蛋白表达明显降低(P<0.05),高剂量组大鼠心肌细胞中磷酸化PKD和GRP78蛋白表达显著降低(P<0.01),提示芬太尼抑制T2D大鼠蛋白激酶D和内质网应激激活,见图5。

图5 Western blot检测各组大鼠心肌细胞中PKD和GRP78蛋白表达
3 讨论
T2D是糖尿病流行的主要类型,其主要特征是高血糖,高脂血症和胰岛素抵抗[10]。本研究通过高脂饮食和低剂量链脲佐菌素注射建立T2D大鼠模型。糖尿病组中大鼠表现出严重的代谢异常,包括FBG、TG、TC及胰岛素水平升高,并发现芬太尼可明显降低T2D大鼠血液中FBG、TG、TC及胰岛素水平,改善T2D引起的大鼠糖脂代谢异常。
芬太尼又名1-苯乙基-4-(N-丙酰苯胺)哌啶,为一种高选择性与μ-阿片受体结合的阿片类强效镇痛药。已有研究表明芬太尼能够影响心肌收缩功能,而糖尿病性心肌病是T2D重要的并发症,也是导致糖尿病患者死亡的主要原因[4,11]。另有研究指出心率是T2D患者全因死亡率的独立预测因子[12]。本研究发现T2D大鼠心率明显升高,而芬太尼能够降低T2D大鼠的心率。本研究还发现T2D大鼠出现明显的心肌损伤和心肌细胞凋亡现象,而芬太尼能够抑制T2D大鼠的心肌损伤和心肌细胞凋亡,从而保护心脏。
T2D引起心肌损伤的过程与炎症反应密切相关,IL-6、TNF-α、IL-10、IL-1β等炎性介质在其中发挥重要作用[13]。心肌损伤促使机体产生炎症反应释放炎症因子,同时炎症因子又可以加剧心肌损伤[14]。已有研究表明在糖尿病状态下,炎症反应发生率明显增高,同时心肌损伤明显加重[15]。本研究发现T2D大鼠炎症因子IL-6、TNF-α、IL-10、IL-1β含量升高,表明T2D引起炎症反应,芬太尼能够降低T2D大鼠的IL-6、TNF-α、IL-10、IL-1β含量,表明芬太尼抑制T2D大鼠的炎症反应。
糖尿病性心肌病的发病是一个慢性和复杂的过程,其主要归因于细胞代谢异常和许多细胞器的缺陷,如线粒体,内质网和肌纤维膜。内质网是与细胞凋亡内在途径的细胞器[7]。内质网应激最终会导致细胞凋亡和功能丧失。已有大量研究表明内质网应激参与糖尿病性心肌病的发病有关。糖尿病性心肌病可随着细胞内Ca2+稳态和代谢紊乱诱导内质网应激[16]。 反之长期的内质网应激会影响多种心脏功能,包括能量代谢,胰岛素抵抗和心力衰竭等[17]。GRP78是一种内质网分子伴侣蛋白,在内质网应激反应中显著上调。 因此,GRP78通常作为反映内质网应激激活的生物标志物[18]。与先前研究一致,本团队发现T2D大鼠心肌细胞中GRP78显著上调,表明其在T2D激活内质网应激,而芬太尼可抑制T2D大鼠内质网应激激活。
已有证据表明,PKD是心力衰竭的中介,因此,为进一步了解芬太尼对T2D大鼠的心脏保护作用所涉及的潜在机制,研究组重点关注PKD[19]。PKC是PKD的主要上游激酶,最初认为是PKC引起的多种生物反应实际上是由PKD执行的[20]。已有研究证实糖尿病心脏的PKD活性显著增加[8]。研究组发现T2D大鼠心肌细胞中PKD活性显著增加,芬太尼能够抑制T2D大鼠心肌细胞中PKD活化。
综上所述,高剂量芬太尼能够改善T2D大鼠的糖脂代谢,并减轻心肌损伤及心肌细胞凋亡和炎症反应,同时抑制T2D大鼠蛋白激酶D和内质网应激激活,芬太尼有望用于临床糖尿病治疗,其具体分子机制还有待进一步研究。