酵母多糖作用HaCaT细胞后对Dectin-1、TLR2及IL-6、TNF-α表达的影响
2020-09-29景海霞段德鉴
罗 亭 景海霞 王 恒 段德鉴 李 敏
(十堰市太和医院(湖北医药学院附属医院)皮肤科,十堰 442000)
目前在临床上皮肤真菌感染的发病率越来越高,天然免疫作为机体抵御病原体入侵的第一道防线,对于皮肤真菌感染具有重要作用。当真菌感染机体时,天然免疫细胞上的模式识别受体(PRRs)识别入侵的真菌,与真菌成分(如酵母多糖)病原相关分子模式(PAMPs)结合,释放炎症因子TNF-α、IL-6等,起到抗真菌感染的作用[1]。目前已经发现的PRRs主要有Toll样受体(TLRs)、C型凝集素受体(CLRs)和Nod样受体[2,3]。其中与真菌感染相关的PRRs主要有TLRs和CLRs,其中Dectin-1和TLR2关系最为密切[4-6]。
酵母多糖是酿酒酵母的细胞壁制剂,由β-葡聚糖、甘露聚糖和几丁质组成,富含真菌的细胞壁成分,能识别包括Dectin-1和TLR2在内的多种配体,可用来模拟体外真菌感染,用于真菌的免疫学研究[7-9]。角质形成细胞是表皮的主要结构,具有免疫功能,还存在多种PRRs,可以识别PAMPs,启动固有免疫,分泌或表达细胞因子、抗菌肽等,在皮肤真菌感染的天然免疫机制中扮演着重要角色。因此本文拟选用HaCaT细胞(人永生化角质形成细胞,具有与角质形成细胞相同的特点),用不同浓度的酵母多糖处理HaCaT细胞,检测细胞中TLR2和Dectin-1的mRNA、蛋白的表达以及TNF-α、IL-6的浓度变化,对酵母多糖启动机体的天然免疫识别机制进行研究,使构建皮肤真菌感染的细胞模型成为可能,也为皮肤浅表真菌感染的天然免疫机制研究打下基础。
1 材料与方法
1.1材料
1.1.1细胞来源 HaCaT细胞购自上海美轩生物科技有限公司。
1.1.2主要试剂 酵母多糖购自Invivogen公司;荧光定量PCR相关试剂购自ToYoBo公司;TLR2、Dectin-1、β-actin引物由天一辉远公司合成(见表1);PE-Dectin-1抗体购自Biolegend公司;PE-TLR2抗体、PE标记的鼠IgG2a同型对照购自eBioscience公司;IL-6、TNF-α ELISA试剂盒购自达科为公司;浓缩型正常山羊血清、荧光标记羊抗兔IgG、荧光标记羊抗小鼠IgG购自武汉博士德公司;DAPI购自碧云天公司;Dectin-1一抗购自NOVUS公司;TLR2一抗购自Santa公司。
1.1.3主要仪器 细胞培养箱(美国Thermo electron公司),超净工作台(苏州集团安泰空气技术有限公司,型号SW-CJ-1FD),实时荧光定量PCR仪(ABI公司,型号Quant Studin 6),PCR仪(东胜创新生物科技有限公司,型号EDC-810),流式细胞仪(BD Biosciences,型号FACS Calibur),激光扫描共聚焦荧光显微镜(Olympus,日本),凝胶成像仪(BioRad公司,USA),自动酶标仪(Thermo scientific,USA)。
1.2方法
1.2.1HaCaT细胞培养及处理 复苏冻存的HaCaT细胞,常规方法培养。待细胞生长到70%-80%,消化收集HaCaT细胞,接种到6孔板上,1×105个/孔,细胞长满至约60%~70%孔底,分别进行如下处理:①加入酵母多糖混悬液使培养孔内酵母多糖终浓度分别为0、10、100 μg/ml(浓度设置参照文献[8,9,10],37℃培养24 h,吸取上清,置于EP管中,在保存-20℃,然后收集3组处理过的细胞提取总RNA(按试剂盒说明书操作);②加入酵母多糖混悬液浓度同①,培养24 h,进行流式细胞术检测;③加入100 μg/ml酵母多糖混悬液,制作HaCaT细胞爬片,作用24 h。以上实验均独立重复3次。
1.2.2TLR2和Dectin-1的qPCR检测 采用TRIzol法提取各分组细胞的总RNA后,参照逆转录试剂盒说明书将RNA逆转录合成单链cDNA,再以cDNA为模板,参照实时荧光定量PCR试剂盒说明书进行PCR扩增,以GAPDH为内参,采用2-ΔΔCt法计算各组细胞中TLR2和Dectin-1 mRNA的表达水平,引物如表1。逆转录反应体系:RNA 2.2506 ng,Oligo(dT)18(10 μmol/L) 2 μl,dNTP(2.5 mmol/L)4 μl,5×Hiscript Buffer 4 μl, Hiscript Reverse Transcriptase 1 μl,Ribonuclease Inhibitor 0.5 μl,ddH2O (Rnase free)加至20 μl,反应条件:25℃ 5 min,50℃ 15 min,85℃ 5 min,4℃ 10 min;实时荧光定量PCR检测反应体系:cDNA (5倍稀释)4 μl,上游引物(10 μmol/L)0.4 μl,下游引物(10 μmol/L)0.4 μl,SYBR Green Master Mix 10 μl,50×ROX Reference Dye 20.4 μl,H2O 4.8 μl,反应条件:50℃ 2 min,95℃ 10 min;95℃ 30 s,60℃ 30 s,40个循环。绘制溶解曲线。

表1 PCR引物的序列以及扩增片段长度
1.2.3流式细胞术检测TLR2和Dectin-1 ①用不含EDTA的0.25%胰酶消化细胞,终止消化后收集HaCaT细胞,1 500 r/min离心5 min,去上清,加PBS重悬;②4℃条件下2 000 r/min离心2 min,含0.5%牛血清白蛋白(BSA)的PBS清涤2遍;③流式小管分别添加相应抗体,4℃避光孵育30 min;④4℃条件下2 000 r/min离心2 min,以含0.5% BSA的PBS清涤2遍;⑤以含0.5% BSA的PBS 0.5ml重悬后流式细胞仪检测分析,检测各组细胞的平均荧光强度(mean fluorescence intensity,MFI)。
1.2.4免疫荧光实验检测TLR2和Dectin-1的表达部位 ①用预温的PBS将已爬好的细胞玻片浸洗3次,3 min/次;②固定爬片15 min(4%的多聚甲醛),PBS洗清玻片3次,3 min/次;③0.5%Triton X-100(PBS配制)室温通透20 min;④用PBS浸洗玻片3次,3 min/次,吸干后,滴正常山羊血清,室温封闭30 min;⑤吸掉玻片上的封闭液,滴加足量的稀释好的一抗并放入湿盒,4℃孵育过夜;⑥加荧光二抗:PBST浸洗爬片3次,3 min/次,吸干爬片上的液体后,滴加稀释好的荧光二抗,湿盒中20-37℃孵育1 h,PBST浸洗切片3次,每次3 min;⑦复染核:加DAPI在黑暗中孵育5 min,对标本进行染核,PBST洗涤玻片4次,每次5 min,洗去DAPI;⑧将爬片上的液体吸干,用封片液密封,在荧光显微镜下观察采集图像。
1.2.5ELISA检测炎症因子TNF-α、IL-6的表达 将收集的上清液稀释10倍,按ELISA试剂盒说明书的步骤操作,检测TNF-α、IL-6的浓度变化。
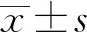
2 结果
2.1酵母多糖对HaCaT细胞TLR2 mRNA和Dectin-1 mRNA表达的影响 各浓度酵母多糖在不同程度上影响HaCaT细胞TLR2 mRNA和Dectin-1 mRNA的表达,随着酵母多糖浓度升高,TLR2 mRNA和Dectin-1 mRNA表达量升高,其中10 μg/ml组TLR2 mRNA表达明显高于对照组(t=12.62,P<0.01),Dectin-1 mRNA表达亦显著升高(t=8.223,P<0.01),比TLR2 mRNA的表达更明显。100 μg/ml组TLR2 mRNA和Dectin-1 mRNA均较10 μg/ml组表达增高,差异有统计学意义(t=6.609,P<0.05和t=3.069,P<0.05),见图1。
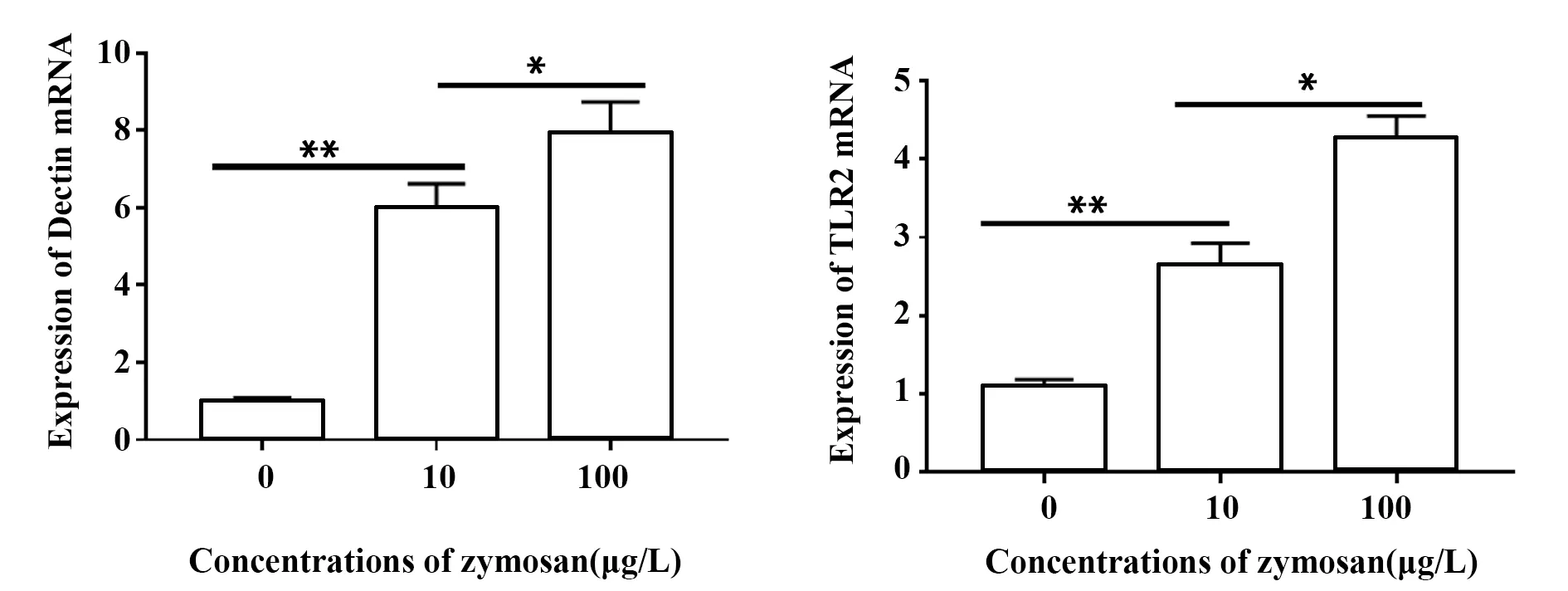
图1 不同浓度酵母多糖对HaCaT细胞的TLR2 mRNA和Dectin-1 mRNA表达的影响
2.2酵母多糖作用HaCaT细胞后对TLR2和Dectin-1蛋白表达的影响 经过处理的HaCaT细胞,流式细胞术检测发现其表面的Dectin-1和TLR2 MFI表达随着酵母多糖浓度升高逐渐升高,100 μg/ml组最为显著,明显高于对照组,有统计学意义(t=36.02,P<0.01和t=45.6,P<0.01),见图2,表2。
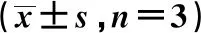
表2 酵母多糖对HaCaT细胞表达TLR2和Dectin-1蛋白MFI的影响

图2 酵母多糖诱导HaCaT细胞后TLR2和Dectin-1蛋白的影响
2.3免疫荧光检测酵母多糖作用HaCaT细胞后TLR2和Dectin-1蛋白的核内转移情况 根据采集的图像发现TLR2和Dectin-1蛋白在对照组中均在胞质表达,几乎看不到胞核内有荧光表达,但是在加入酵母多糖诱导后发现TLR2和Dectin-1蛋白在胞质和胞核内均有表达,见图3。

图3 各组细胞中TLR2和Dectin-1的免疫荧光染色(×400)
2.4酵母多糖作用HaCaT细胞后炎症因子TNF-α、IL-6的表达 酵母多糖处理HaCaT细胞后,发现TNF-α、IL-6的表达量均增高,其中10 μg/ml组与对照组相比TNF-α、IL-6的浓度显著增高,差异有统计学意义(t=16.05,P<0.01和t=58.95,P<0.01),但与10 μg/ml组与100 μg/ml组相比TNF-α的浓度差异无统计学意义,10 μg/ml组和100 μg/ml组相比IL-6的浓度有差别,有统计学意义(t=6.676,P<0.05),与酵母多糖浓度呈正相关,见表3。
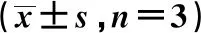
表3 不同浓度酵母多糖作用HaCaT细胞炎症因子TNF-α、IL-6的浓度
3 讨论
本文通过体外研究探讨酵母多糖对HaCaT细胞Dectin-1、TLR2 mRNA和蛋白水平表达的影响以及TNF-α、IL-6浓度的变化。发现酵母多糖作用于HaCaT细胞后具有上调Dectin-1、TLR2 mRNA和蛋白表达的作用,与对照组相比炎症细胞因子TNF-α、IL-6的浓度也增高,并且都与浓度呈正相关。说明酵母多糖可识别HaCaT细胞的PRRs,激发天然免疫识别过程。
通过查阅以往的文献发现,Dillon等[8]将酵母多糖作用于巨噬细胞和树突状细胞后发现TLR2、Dectin-1 mRNA和蛋白的表达水平增高,还可激活下游的MyD88和Syk信号通路,最终导致核转录因子活性的增强并释放大量的炎症细胞因子TNF-α,放大炎症反应,共同参与酵母多糖的免疫识别过程。毛亚男等[10]用酵母多糖刺激小鼠巨噬细胞,在早期发现,酵母多糖可显著上调受体Deetin-1、TLR2 mRNA和蛋白的表达水平,促进炎症细胞因子TNF-α的释放,最终诱导炎症反应的发生。Wu等[9]用酵母多糖处理永生化人角膜上皮细胞,发现酵母多糖可激活TLR2下游的一系列炎症因子(TNF-α、IL-6、IL-8)和核转录因子κB的表达,使用TLR2阻断剂后,上述炎症因子的表达均降低。这些研究均表明酵母多糖可激活机体的天然免疫过程,可体外模拟皮肤真菌感染模型,与本研究具有一致性。但是Dillon的研究也表明,在用酵母多糖刺激树突状细胞后,炎症因子IL-6的表达降低,甚至没有表达,这一结果与本文不一致,我们推测可能与使用的细胞模型和实验条件不同有关。
本研究中还发现,酵母多糖可致Dectin-1、TLR2蛋白的表达部位发生变化,对照组中其表达部位主要在胞质,但是在经过酵母多糖处理后发现Dectin-1、TLR2蛋白在胞质和胞核中均有表达,其中蛋白TLR2胞核表达的现象较Dectin-1明显。Reuven等[11]发现TLRs在胞外区识别PAMPs后,胞浆区的TIR结构域激活并介导信号转导,通过激活MyD88,降解NF-κB抑制蛋白α,使得释放NF-κB转位入核,从而启动相应的基因转录[12,13]。我们推测可能是酵母多糖诱导了Dectin-1、TLR2蛋白在细胞核内的合成,也可能是在酵母多糖的作用下,Dectin-1和TLR2通过激活下游的Syk和MyD88信号通路,促进了核转录因子NF-κB的活化,介导靶基因的核内转移。
综上所述,酵母多糖对HaCaT细胞表达Dectin-1、TLR2及炎症因子TNF-α、IL-6有促进的作用,可以启动机体的天然免疫,使皮肤真菌感染体外模型的构建成为可能,也为我们以后皮肤浅表真菌感染的天然免疫机制研究提供一定的方便,并且对于抗真菌药物的研究也打下基础。但是本文在信号通路的研究上有一定的不足,酵母多糖具体通过何种机制调控TLR2和Dectin-1及TNF-α、IL-6,还有待进一步论证,我们将在接下来的研究中进行更加深入的探讨。
