骨髓间充质干细胞外泌体miR-10a-5p下调紫外线抵抗相关基因(UVRAG)的表达调控系统性红斑狼疮
2020-09-29刘典锋王安凤何惠忠
刘典锋 王安凤 何惠忠
(攀枝花市中西医结合医院,攀枝花 617000)
系统性红斑狼疮(systemic lupus erythematosus,SLE)多见于女性,是一种多因素介导的自身免疫疾病[1]。免疫调节、基因、环境、荷尔蒙激素和表观遗传等异常都有可能导致SLE的发生,引起先天和后天免疫反应[2],并对单核细胞、巨噬细胞、树突细胞以及一些细胞和体液组分产生功能上的影响[3]。研究证实,外周血单个核细胞是机体重要的免疫细胞,其增殖和凋亡与SLE的发生与发展密切相关[4]。骨髓间充质干细胞(bone marrow mesenchy-mal stem cells,BMMSCs)在骨髓中具有成骨前体细胞的潜能,并拥有免疫调节,免疫抑制以及再生功能[5]。目前BMMSCs移植同样也被应用于治疗SLE[6]。在细胞间交流过程中,可由包含56个蛋白和核酸的外泌体介导形成[7],根据产生外泌体的来源细胞类型,外泌体可产生不同的功能,例如介导免疫抑制或者免疫刺激等,干细胞可应用于肿瘤和自身免疫疾病的治疗中[8]。大量研究表明,外泌体miRNA在细胞生理过程中发挥重要调控作用。miRNA同样参与到SLE的调控中[9-12]。本研究将探讨在骨髓干细胞移植中,BMMSCs外泌体调控SLE细胞增殖及凋亡的机制。
1 材料与方法
1.1材料
1.1.1细胞 人骨髓间充质干细胞(货号:PT-2501;Lonza),系统性红斑狼疮患者外周血单个核细胞取自攀枝花市中西医结合医院。
1.1.2试剂 DMEM、RPMI1640培养基和FBS购自Gibco;POROSTMHeparin 50 μm购自Thermofisher;Ficoll®400购自Sigma-Aldrich;反转录试剂盒PrimeScripTMRT reagent kit以及qRT-PCR试剂盒TB Green®Premix Ex TaqTMⅡ购自TaKaRa;外泌体RNA提取试剂盒SeraMir Exosome RNA Column Purification Kit购自System Biosciences;Trizol核酸提取试剂盒和Lipofectamine 3000购自Invitrogen;RIPA蛋白裂解液和Annexin V-FITC试剂盒购自碧云天公司;CCK-8试剂盒购自Abcam;qRT-PCR引物由上海生工生物工程有限公司合成;一抗(antibody-CD9、antibody-CD63、antibody-TSG101、antibody-UVRAG)和HRP标记二抗(山羊抗兔igG)购自Promega。
1.2方法
1.2.1细胞培养 BMMSCs细胞培养于含有1%青霉素和10% FBS(使用前100 000 g离心8 h去除血清的外泌体)DMEM培养基中,控制细胞浓度于1×106个/瓶,于37℃,5% CO2培养箱中培养。每3 d 更换一次培养基,达到80%融合度后使用胰酶消化悬浮用于后续实验。外周血单核细胞培养于含有10%FBS的RPMI1640培养基中,培养环境为37℃,5%CO2。培养24 h后用于后续实验。
1.2.2BMMSCs来源外泌体以及SLE外周血单个核细胞的分离 BMMSCs来源外泌体分离:取使用无外泌体FBS培养48 h后的BMMSCs条件培养基用于分离提取外泌体。10 000 g离心30 min除掉细胞碎片,PBS重悬后100 000 g离心70 min,重复两次。最后用30 μl PBS洗涤,保存于-80℃用于后续实验。采用透射电子显微镜和Western blot分别对所提取外泌体形态以及表面标记物CD9、CD63和TSG101进行检测。SLE外周血单个核细胞分离:肝素钠抗凝管收集SLE外周血,采用Ficoll-Paque试剂配合密度梯度离心分离SLE外周血单个核细胞。
1.2.3qRT-PCR检测SLE外周血单个核细胞和外泌体中miRNA水平 使用外泌体RNA提取试剂盒提取外泌体中总RNA,具体方法参照试剂盒说明。Trizol试剂盒提取细胞总RNA。使用反转录试剂盒得到cDNA,miRNA测定采用qRT-PCR试剂盒。RT-PCR反应体系:TB Green Premix Ex Taq Ⅱ(2×)10 μl、上下游引物各0.8 μl、ROX Reference Dye(50×)0.4 μl、cDNA模板2 μl、ddH2O 6 μl。反应参数:95℃ 30 s;95℃ 5 s,60℃ 31 s一共40个循环。各miRNA以及内参U6引物见表1。

表1 引物序列
1.2.4CCK-8检测SLE外周血单个核细胞增殖活性 将细胞接种于96孔板中,每孔100 μl无FBS的RPMI培养基,控制细胞浓度为2×103个/孔。与BMMSCs来源外泌体共培养则加入10 μg/ml外泌体于培养基中,于37℃、5% CO2培养箱中培养。在培养至第1、2、3、4天时,分别加入10 μl CCK-8试剂染色,并继续培养1 h。染色完成后在450 nm波长下检测。
1.2.5流式细胞术检测SLE外周血单个核细胞凋亡率 将实验细胞制成细胞悬液后,参照试剂盒说明对细胞进行Annexin Ⅴ-FITC/PI染色标记,流式细胞仪检测。
1.2.6双荧光素酶报告基因验证miR-10a-5p与UVRAG靶向关系 UVRAG 3′UTR中可能与miR-10a-5p具有靶向位点的序列及其突变序列分别插入到Pglo载体中,分别构建质粒Pglo-UVRAG-WT和Pglo-UVRAG-MUT。在SLE外周血单个核细胞中同时转入miR-10a-5p和UVRAG野生型质粒或突变型质粒。采用Lipofectamine 3000进行转染,具体操作参照试剂盒使用说明。转染后培养48 h后加入裂解缓冲液,最后使用双荧光素酶报告基因检测试剂盒检测荧光强度。
1.2.7Western blot检测外泌体表面标记物以及UVRAG表达水平 细胞经PBS重悬洗涤后,RIPA提取总蛋白。SDS-PAGE电泳分离蛋白后转至PVDF膜,膜经TBST洗涤,5%脱脂牛奶封闭1 h。然后加入一抗(CD9,1∶2 000;CD63,1∶2 000;TSG101,1∶2 000;UVRAG,1∶2 000)4℃过夜孵育,孵育完后除去一抗并洗涤。加入HRP标记山羊抗兔IgG二抗(1∶5 000),于37℃孵育1 h。最后加入化学显色液,成像系统拍照记录。
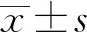
2 结果
2.1成功分离BMMSCs来源外泌体 透射电子显微镜拍摄图片显示,BMMSCs外泌体呈现圆形或不规则圆形,直径约30~100 nm,如图1A所示。Western blot结果显示,外泌体表面标记物CD9,CD63以及TSG101均表达,如图1B所示。结果表明BMMSCs外泌体分离成功。

图1 成功分离BMMSCs来源外泌体
2.2BMMSCs来源外泌体抑制SLE外周血单个核细胞增殖并促进其凋亡 CCK-8结果显示,SLE外周血单个核细胞与BMMSCs来源外泌体共培养后第3、4天,细胞增殖活力对比对照组显著下降(P<0.01),如图2A所示。流式细胞仪检测凋亡结果显示,相对于对照组,共培养后,PBMC凋亡率显著升高(P<0.01),如图2B、C所示。结果表明,BMMSCs来源外泌体会抑制SLE外周血单个核细胞增殖并促进其凋亡。

图2 BMMSCs来源外泌体抑制SLE外周血单个核细胞增殖并促进其凋亡
2.3BMMSCs来源外泌体上调SLE外周血单个核细胞内miRNA表达 qRT-PCR检测结果显示,在SLE患者外周血单个核细胞中异常低表达的miRNA:miR-155,miR-17,miR-181b和miR-10a-5p,与BMMSCs来源外泌体共培养后,这些miRNA水平均显著升高(P<0.05),并且其中miR-10a-5p表达水平上调最高(P<0.01),如图3所示。结果表明,SLE外周血单个核细胞中低表达miRNA水平可被BMMSCs外泌体上调,其中miR-10a-5p上调最为显著。
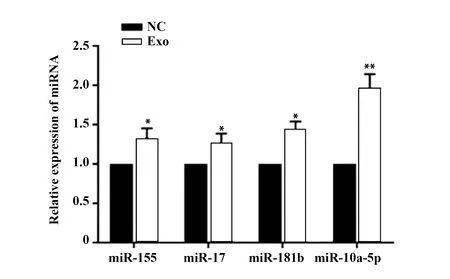
图3 BMMSCs来源外泌体显著上调SLE外周血单个核细胞中miR-10a-5p表达水平
2.4BMMSCs来源外泌体中miR-10a-5p抑制SLE外周血单个核细胞增殖并促进其凋亡 qRT-PCR结果显示,相比于对照组SLE外周血单个核细胞中转染antagomiR-10a-5p后,细胞中miR-10a-5p水平显著降低(P<0.01),如图4A所示。CCK-8检测结果显示,Exo组在第3、4天时SLE外周血单个核细胞增殖活力相比于对照组显著降低,而将Exo中miR-10a-5p敲降后第3、4天,SLE外周血单个核细胞增殖活力相比于Exo组显著升高(P<0.01),如图4B所示。流式细胞仪检测细胞凋亡结果显示,相比于对照组,Exo组凋亡率显著升高(P<0.01),但敲降外泌体中miR-10a-5p后,SLE外周血单个核细胞凋亡率相比于Exo组显著降低(P<0.01),如图4C、D所示。由此可知,抑制外泌体miR-10-5p水平可促进SLE外周血单个核细胞增殖从而抑制其凋亡。
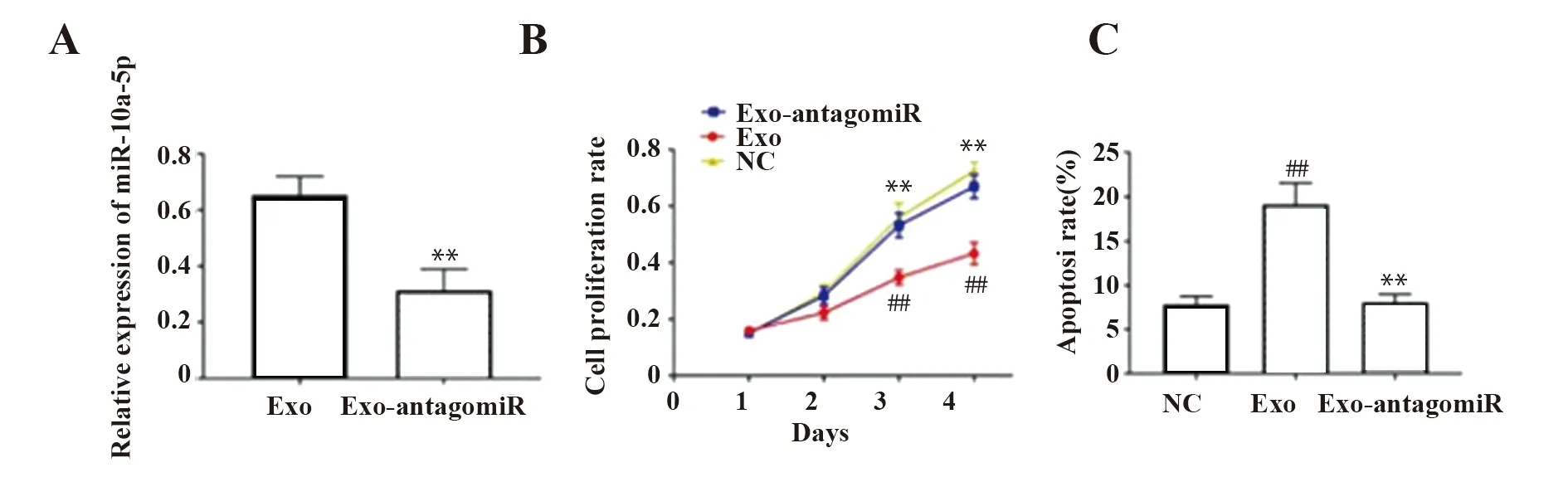
图4 敲降BMMSCs来源外泌体miR-10a-5p促进SLE外周血单个核细胞增殖并抑制其凋亡
2.5miR-10a-5p靶向下调UVRAG表达 starBase数据库预测结果显示,UVRAG 3’UTR与miR-10a-5p存在靶向结合位点,如图5A所示。双荧光素酶报告基因检测结果显示,相比于miR-NC+UVRAG WT组,miR-10a-5p+UVRAG WT组荧光强度显著降低(P<0.01),如图5B所示,并且miR-NC+UVRAG MUT组荧光强度与miR-10a-5p+UVRAG MUT组无统计学差异。Western blot检测结果显示,转染miR-10a-5p mimics后,SLE外周血单个核细胞中UVRAG表达水平相比于对照组显著降低(P<0.05),如图5C所示。由此可知,在SLE外周血单个核细胞中miR-10a-5p靶向下调UVRAG表达。
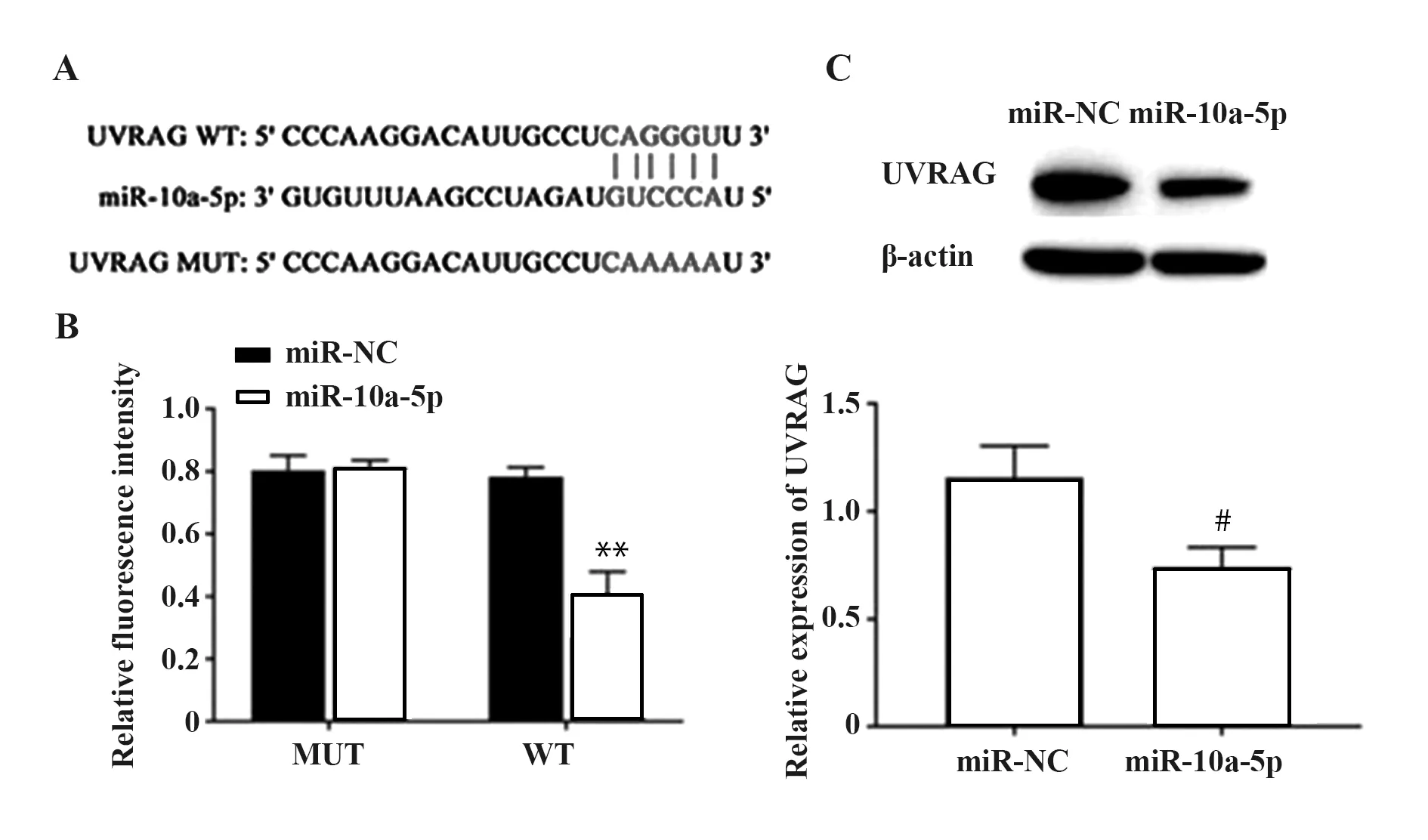
图5 miR-10a-5p靶向下调UVRAG表达水平
2.6BMMSCs外泌体miR-10a-5p下调UVRAG抑制SLE外周血单个核细胞增殖促进其凋亡 Western blot结果显示,相比于NC组,Exo组和敲降UVRAG组中UVRAG蛋白的表达水平显著下调(P<0.01),同时敲降miR-10a-5p和UVRAG组中UVRAG的表达水平与NC组相比无差异无统计学意义,如图6A所示。将Exo与SLE外周血单个核细胞共培养,用CCK-8和流式细胞术检测共培养后的SLE外周血单个核细胞,结果显示,相比较于Exo组,敲降UVRAG且与Exo共培养可明显抑制SLE外周血单个核细胞的增殖(P<0.01,如图6所示)并诱导细胞凋亡(P<0.05,如图6C所示),与Exo共培养且同时敲降miR-10a-5p和UVRAG组中细胞的增殖和凋亡水平与NC组相比无明显变化。综上可知,BMMSCs外泌体miR-10a-5p靶向下调UVRAG,抑制SLE外周血单核细胞的增殖并诱导细胞凋亡。
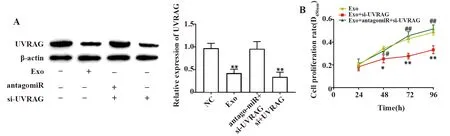
图6 BMMSCs来源外泌体miR-10a-5p下调UVRAG表达水平从而抑制SLE外周血单个核细胞增殖并促进其凋亡
3 讨论
系统性红斑狼疮是一种多因素介导的自身免疫疾病,发病率在26/100 000至52/100 000间,女性约为1/1 000[13],并影响肾脏、脑、肺和造血系统功能。可采用类固醇,环磷酰胺以及其他免疫抑制药物如霉酚酸酯对SLE进行治疗,但是治疗效果并不理想,而且这类治疗方法容易产生感染,卵巢功能衰竭,继发性肿瘤等副作用[14-16]。在对BMMSCs的研究中,发现SLE患者BMMSCs在细胞因子(如生长因子β)分泌以及白介素6/7基因的转录都异于正常BMMSCs,并且也有研究发现SLE患者BMMSCs在增殖和免疫调控中都异于正常BMMSCs,表明BMMSCs在SLE的发生发展中可能起着重要作用[17]。并且有研究表明,BMMSCs能够抑制T细胞,B细胞,自然杀伤细胞和树突细胞增殖活力[18-20]。BMMSCs也已被应用SLE的治疗,并产生良好的治疗效果[21,22]。
BMMSCs可通过将细胞中包括细胞器(如线粒体)、蛋白、基因以及miRNA等物质包裹于外泌体微泡中,从而进行细胞间交流[23,24]。而这类外泌体miRNA在许多生理过程中都发挥着重要作用,对细胞生物学功能产生影响。BMMSCs外泌体miR-29b-3p可调控2型糖尿病胰岛素耐药性[25]。在心脏疾病的治疗中,BMMSCs外泌体miR-21-5p通过调控PI3K信号通路影响肌肉收缩和钙调控[26]。同时也有研究表明,BMMSCs通过外泌体调控接收细胞中miRNA水平,并进而调控下游通路对细胞功能产生影响[27]。在本研究中,探讨了BMMSCs外泌体miR-10a-5p对SLE细胞的调控。
大量研究表明,miR-10a-5p在多种细胞中影响细胞增殖与凋亡。在宫颈癌中,miR-10a-5p通过靶向调控BDNF抑制肿瘤细胞增殖[28]。在类风湿关节中,miR-10a-5p可调控TBX5,从而对滑膜炎细胞增殖和凋亡产生影响[29]。miRNA通常通过靶向调控下游mRNA,影响其在细胞中的水平,进而调控细胞生物学功能。在本研究中,探讨了在BMMSCs移植中,外泌体miR-10a-5p通过UVRAG调控SLE细胞增殖与凋亡。
对于皮肤癌症,暴露于紫外光(UV)照射下可引起皮肤癌症的恶化,而UVRAG参与调控UV敏感性[30,31]。UVRAG同时也参与调控自噬,内吞和细胞分泌转运等过程[32,33]。UVRAG在一些细胞如结直肠癌细胞,黑素瘤细胞等中,由miRNA调控参与细胞增殖凋亡等过程[34,35]。同时也有研究表明,miR-125b通过靶向调控UVRGA并抑制SLE患者的自噬过程[36]。而在本研究中,对BMMSCs分泌miR-10a-5p进而调控UVRAG参与SLE细胞增殖和凋亡进行了阐述。
综上所述,在BMMSCs移植后,BMMSCs通过分泌外泌体miR-10a-5p下调SLE细胞中UVRGA表达,从而抑制SLE细胞增殖并促进其凋亡。为BMMSCs治疗SLE的分子机制提供了新的思路;并进一步阐述了UVRAG对SLE细胞生物学功能产生的影响,为UVRAG的功能研究提供了理论支持。结合UVRAG在SLE细胞中产生的影响,可进一步研究UVRAG在SLE细胞中的作用网络。