酒精性肝病患者血清IL-17水平变化及其197A/G位点单核苷酸多态性分析
2020-09-28尹春英侯志平王春青王艳玲李炳庆何培元
尹春英,侯志平,王春青,王艳玲,李炳庆,何培元
1承德医学院附属医院,河北承德067000;2承德医学院
酒精性肝病是由长期过量饮酒所致的肝脏损伤,嗜酒者的病死率较一般人群高1~3倍,肝脏疾病、神经系统疾病的发病率较一般人群高20%[1,2]。酒精性肝病的发展包括酒精性脂肪肝、酒精性肝硬化及酒精性肝癌不同阶段[3],其中酒精性脂肪肝的病理学改变是可逆的,如给予有效治疗,患者可能恢复健康;而酒精性肝硬化则不可逆转,治疗效果差,预后不良,约15%的酒精性肝硬化患者可发展为肝细胞癌。白细胞介素17(IL-17)是一种新型细胞因子,最早从小鼠细胞毒性T河马细胞杂交瘤中分离出来[4,5],参与体内病毒免疫反应,可激活细胞因子引发炎症因子风暴,参与多种炎性疾病的发生发展[6~8]。本研究通过观察酒精性肝病患者血清IL-17水平及其197A/G位点单核苷酸多态性(SNP)特点,分析其与酒精性肝病发生发展的关系。
1 资料与方法
1.1 临床资料 选择2016年1月~2018年6月在我院就诊的酒精性肝病患者182例,男159例、女23例,年龄(51.2±7.4)岁。其中脂肪肝32例(脂肪肝组),肝硬化68例(肝硬化组),肝癌24例(肝癌组)。纳入标准:符合中华医学会肝脏病学分会2010年修订的《酒精性肝病诊疗指南》[9]中的诊断标准:①长期大量饮酒,饮酒时间≥5年,折合乙醇量男性≥40 g/d、女性≥20 g/d,或2周内饮用乙醇量>80 g/d;②临床症状:可无明显症状,或表现为右上腹胀痛、乏力、食欲不振、体质量下降、皮肤巩膜黄染等,随病情进展,可出现蜘蛛痣、肝掌及神经精神异常等表现;③实验室检查:血清天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、谷氨酰转肽酶、平均红细胞容积升高,AST/ALT>2;④肝脏B超或CT检查有典型弥漫性脂肪肝表现。排除标准:肝脏病变进入终末期,已经行肝移植手术;酒精性脂肪性肝病合并嗜肝病毒感染;合并药物性肝病或自身免疫性肝炎;合并恶性肿瘤;合并心、肝、脑、肺等严重损伤。对照组58例来自同期健康体检者,年龄33~69岁。入选标准:长期大量饮酒;肝功能正常;肝脏B超或CT检查未见异常;无酒精性肝病家族史;无心、脑、肾等重要脏器疾病。各组性别、年龄、饮酒量具有可比性。本研究经承德医学院附属医院伦理委员会批准,患者均签署知情同意书。
1.2 血清IL-17检测方法 采集受试者外周血,离心分离血清。采用ELISA试剂盒(武汉华美生物工程有限公司)检测血清IL-17活性。设置标准品孔、样本孔和空白孔,依次加入样本、辣根过氧化物酶标记的检测抗体、37 ℃温育60 min,弃去液体,加入洗涤液,重复洗板5次,最后加入底物,37 ℃避光孵育15 min。使用荧光酶标仪在490 nm处读取IL-17吸收值,绘制标准曲线,计算IL-17的相对表达量。
1.3 IL-17 197A/G的SNP检测方法 使用DNA试剂盒提取血清总DNA,PCR扩增仪进行扩增。扩增引物:上游5′-AACAAGTAAGAATGAAAAGAGGACATGGT-3′,下游5′-CCCCCAATGAGGTCATAGAAGAATC-3′,延伸引物TACCCTTGCTAAGGCTTCTTGCCGA。反应条件:95 ℃预变性10 min;94 ℃ 变性30 s,60 ℃退火1 min,72 ℃延伸1 min,共35个循环;最后72 ℃延伸10 min。使用单核苷酸检测试剂盒(美国SNP IT试剂盒),将获得的PCR产物纯化后,模板变性、扩增,去除多余的ddNTP,采用ABI3730电泳进行SNP分析。
1.4 统计学方法 采用SPSS12.0统计软件。197A/G等位基因及基因型SNP在不同组间的分布频率用χ2检验;组间IL-17表达水平比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组血清IL-17水平比较 对照组、脂肪肝组、肝硬化组、肝癌组血清IL-17水平分别为3.78±0.45、3.96±0.62、6.23±0.88、8.77±0.93;肝癌组血清IL-17水平高于其他三组(P均<0.05),肝硬化组高于脂肪肝组和对照组(P均<0.05),脂肪肝组与对照组比较差异无统计学意义(P>0.05)。
2.2 各组IL-17 197A/G位点基因型及等位基因分布频率比较 见表1。197A/G位点有AA、AG、GG三种基因型,三种基因型的分布频率在四组间比较差异有统计学意义(χ2=46.20,P<0.01)。肝癌组、肝硬化组AA基因型分布频率均高于AG、GG型,脂肪肝组、对照组GG基因型分布频率均高于AA、AG型(P均<0.05);肝癌组、肝硬化组AA基因型分布频率高于对照组和脂肪肝组,GG基因型分布频率低于对照组和脂肪肝组(P均<0.05)。等位基因A在肝癌组分布频率最高,肝硬化组次之,两组间无统计学差异(P>0.05),但是与脂肪肝组及对照组均具有统计学差异(P均<0.05);等位基因G在脂肪肝组和对照组分布频率高于肝硬化组和肝癌组(P均<0.05)。
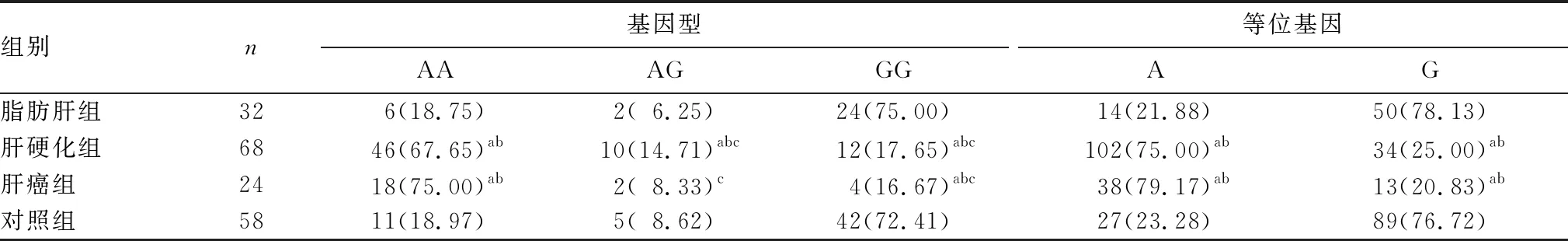
表1 各组IL-17 197A/G位点基因型及等位基因分布频率比较[例(%)]
3 讨论
酒精性肝病是由于长期过量摄入乙醇导致的肝脏慢性中毒性疾病。随着我国国民生活水平的提高及生活习惯的改变,酒精性肝病已成为导致肝硬化及肝癌的主要病因[10]。酒精性肝病的病理发展过程包括酒精性脂肪肝、酒精性肝硬化和酒精性肝癌三个阶段。其中酒精性脂肪肝是酒精性肝损伤的早期可逆性损伤阶段,一般在戒酒和治疗后多数患者预后良好;当患者进入肝硬化阶段后即称为失代偿期,对于患者只能对症治疗、改善肝功能及治疗并发症。酒精性肝病致病因素单一,但其发病机制较为复杂,从酒精性脂肪肝到酒精性肝硬化阶段,其本质是肝脏的慢性持续性损伤导致肝细胞在反复损伤及修复过程中出现的坏死、再生及间质纤维结缔组织增生引起的肝脏组织结构和功能发生的改变,这一过程可能与乙醇及其代谢产物对肝脏的毒性作用、氧化应激与脂质过氧化、免疫介导、细胞凋亡、细胞因子、内毒素、SNP、病毒的叠加效应等多种因素有关[11,12]。
CD4+T淋巴细胞依据其生物学特性,可分为调节性T细胞(Treg)、辅助性T细胞17(Th17)、Th1及Th2细胞4个亚群。Th17细胞是新发现的一类效应性T细胞,可分泌IL-17、IL-17F、TNF-α、IL-21、IL-22、IL-17B、IL-17C、IL-17E,与机体的炎症反应、自身免疫性疾病及肿瘤的发生发展密切相关。Lemmers等[13]研究认为,Th17通路在酒精性肝病中发挥重要作用,酒精中毒性肝损伤患者及酒精性肝硬化患者血浆IL-17水平明显升高,且肝脏分泌IL-17的细胞数量与肝细胞损伤程度呈正相关。目前研究认为,长期摄入乙醇导致IL-17增加,进一步刺激肝星状细胞表达TNF-α、TGF-β[14],进而促进细胞凋亡蛋白酶活化导致肝细胞凋亡[15]、抑制自然杀伤细胞的活性而减弱其抗纤维化的作用[16]。有报道显示,IL-17还可以激活其他细胞因子,引起炎症反应的级联效应,最终促进疾病进展。本研究结果显示,酒精性肝硬化、酒精性肝癌患者血清IL-17水平均高于对照组和酒精性脂肪肝组,其中肝癌组最高。表明不可逆性酒精性肝损伤可导致IL-17水平异常升高,在病情进展过程中发挥重要作用。
本研究进一步观察酒精性肝病患者IL-17 197A/G位点的基因多态性,结果显示,AA基因型频率在肝癌患者中最高,在肝硬化组中次之,在对照组和脂肪肝组中分布频率最低。这提示酒精性肝病的进展在人群中存在不同的遗传背景,AA基因型分布趋势与IL-17血清表达趋势相似,表明AA基因型和A等位基因可能是酒精性肝病患者致病的不利因素。AA基因型在对照组和脂肪肝组中表达无差异,同时在肝硬化组和肝癌组中也无差异,表明AA基因型在酒精性肝病不可逆损伤中发挥重要作用,携带AA基因型的患者更易引起肝硬化损伤。与以往文献报道[17~19]一致。何胜等[20]报道,在乙型肝炎病毒引起的肝硬化患者中,197A/G位点AA基因型和A等位基因可能增加乙肝病毒感染的不良转归,并且AA基因型可以增加慢性乙型肝炎进展为肝硬化的发生风险。但是携带该基因型的患者酒精性肝病进程尚未揭示,这类患者是饮酒后从酒精性脂肪肝逐步进展到酒精性肝硬化再到酒精性肝癌,还是大量饮酒后快速从酒精性脂肪肝发展到肝硬化或肝癌阶段,目前尚不清楚。
综上所述,IL-17 197A/G位点AA基因型和A等位基因是酒精性肝病患者的易感基因,AA基因型分布频率与肝硬化患者血清IL-17水平趋势相似,可以增加酒精性脂肪肝进展为肝硬化的发生风险。但是由于不同人群的遗传背景不同,报道也不尽一致,为了避免由于样本量不足引起的偏倚,应该在不同人种、种族和地区间增大样本量进一步深入研究。
