大蒜素对口腔鳞状细胞癌治疗作用的研究
2020-09-28李国林张雪松郭净洁
杜 超,李国林,2,张雪松,郭净洁,王 崇
近年WHO统计显示,口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC,以下简称口腔鳞癌)发病率呈逐年递增趋势,其作为颌面部最常见的恶性肿瘤,发病率位列所有癌症第六位[1-3]。临床治疗口腔鳞癌主要为手术联合放、化疗,然而由于其高侵袭性、易发生淋巴结及远处转移的特点,术后患者极易复发,使治疗仍面临巨大挑战[4-5]。因此探索一种安全有效的抑制口腔鳞癌恶性增殖、迁移及侵袭能力的方法仍是目前基础及临床研究的重要课题。
大蒜素(Allicin)提取自天然大蒜鳞茎中,具有杀菌、抗癌等多种药理学作用[6-8]。研究发现其能影响细胞周期并诱导凋亡、增加抗癌药物敏感性,对胃癌、肺癌、结肠癌等多种肿瘤细胞有明显抑制作用[9-13]。大蒜素的这些特性使其有望成为安全、有效的天然植物提纯抗肿瘤药物,但其对口腔鳞癌的治疗研究却尚不明确。本研究试图通过体外实验探讨大蒜素对口腔鳞癌细胞SCC-15增殖、迁移及侵袭性的影响,并通过运用网络药理学方法进一步探索大蒜素对口腔鳞癌治疗作用的可能机制。
1 材料与方法
1.1 材料
人舌鳞癌细胞株SCC-15(哈尔滨医科大学北方医学转化中心实验室细胞库赠予);大蒜素(Solarbio,中国,纯度≥98%),DMEM(Hyclone,美国);胎牛血清(Biowest,美国);青/链双抗(Invitrogen,美国);胰蛋白酶(Solarbio,中国);CCK-8(Boster,中国);Transwell小室(Corning,美国);二甲基亚砜(DMSO,Bioroxx公司,德国);酶标仪(Biotek公司,美国)。
1.2 方法
1.2.1 细胞培养 制备DMEM完全培养基(含10%胎牛血清,100 U/mL青霉素及100 mg/L链霉素)培养SCC-15细胞,并置于常规培养箱(为含有5% CO2,37 ℃培养箱,以下省略)中培养。
1.2.2 CCK-8实验 将SCC-15以每孔5×103个细胞密度接种于96孔板,并置于培养箱中培养24 h。24 h后吸除培养液,并将不同浓度的大蒜素溶液(0、5、20、40、100、200、300、400、500、600 μmol/L)分别加入96孔板中,继续培养24 h、48 h和72 h。待检测时按照说明书步骤,将每孔的培养液更换为含有CCK-8的完全培养基。在培养箱内继续培养2 h后使用酶标仪检测吸光度,根据所得OD值计算细胞增殖抑制率和半抑制率(IC50)。后续实验的实验组药物浓度均根据CCK-8计算的IC50浓度来选择。
1.2.3 细胞划痕实验 将细胞接种于6孔板中培养,待细胞全部贴壁达到完全融合后,使用移液器枪头垂直于孔板的底部进行划痕。用无菌PBS缓慢冲洗去除脱落细胞。对照组细胞加入不含药物的无血清培养基,实验组加入以无血清培养基配成的大蒜素溶液继续培养(浓度分别为200、400、600 μmol/L)。分别于0、24、48及72 h在光镜下观察,记录各组细胞向划痕中央迁移的情况并计算细胞迁移率。
1.2.4 Transwell实验 将Matrigel胶置于4 ℃中溶解过夜,取40 μL稀释至4倍后的Matrigel胶缓慢均匀的铺入到Transwell上室中,并在常规培养箱中孵育4 h。以无血清培养基制备细胞悬液,将Transwell小室放入24孔板内,在上室中加入200 μL含有2.5×105个/mL细胞的细胞悬液,下室加入600 μL含血清完全培养基。对照组上室内仅有无血清培养基,实验组上室分别加入含有400、600 μmol/L大蒜素溶液的无血清培养基。培养箱内孵育48 h后取出小室,并用PBS浸润后的棉签擦去上室内未穿过膜的细胞。待4%多聚甲醛固定后,滤膜的下表面用结晶紫染色10 min。中性树脂封片,在光镜下观察并拍照计算胞数。
1.2.5 大蒜素潜在作用靶点预测 选择SwissTargetPrediction在线分析工具,根据大蒜素的二维和三维结构特点来预测其潜在靶点。标准化筛选出的数据:限制筛选出的基因物种为人,使用UniProt Knowledgebase(UniProtKB)数据库,将筛选出的蛋白质名称转换为基因名称并消除重复数据。
1.2.6 获取的口腔鳞癌相关发病靶点 在GEO(Gene Expression Omnibus)数据库输入关键词“OSCC”,检索并整理口腔鳞癌患者的基因芯片表达数据集(GSE138206),选择所取组织为位于舌部的对照患者和口腔鳞癌患者数据,并通过GEO2R(在线R语言分析工具)深入分析该数据集的表达特异性及特点。选取大蒜素的潜在作用靶点和口腔鳞癌的发病相关靶点的数据交集进行下一步分析。
1.2.7 PPI网络建设及功能富集分析 通过蛋白质互作检索数据库STRING-DB构建大蒜素靶作用口腔鳞癌靶点蛋白互作网络网络(protein protein interaction network,PPI)。选取置信区间大于0.90,将筛选出的核心交集进一步的构建PPI网络,并使用Cytoscape(版本:3.7.1)构建并可视化交互网络。为确定交集的核心功能,对大蒜素和口腔鳞癌的数据交集进行京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路和基因本体(Gene Ontology,GO)功能分析。
1.2.8 统计学分析 组间数据比较使用SPSS 21.0统计分析软件进行方差分析。P<0.05检验结果为具有统计学差异意义。
2 结 果
2.1 大蒜素对SCC-15细胞具有增殖抑制作用
CCK-8实验显示用不同浓度的大蒜素处理细胞:24 h对细胞增殖抑制作用不显著;48、72 h对细胞增殖抑制作用显著(P<0.01),且抑制作用呈浓度依赖性。经计算在48、72 h时大蒜素对SCC-15细胞作用的半数生长抑制浓度(IC50)为200 μmol/L(图1)。选取200 μmol/L为最小实验浓度进行后续实验。
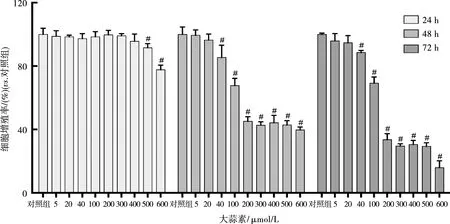
图1 大蒜素对SCC-15细胞增殖的抑制作用(#P<0.01)
2.2 大蒜素降低SCC-15细胞迁移能力
划痕实验提示:给予不同浓度大蒜素培养SCC-15细胞,24 h时仅在600 μmol/L大蒜素药物组间差异具有统计学意义(P<0.05),200、400 μmol/L组间与对照组相比差异无统计学意义(P>0.05);大蒜素作用时间增加为48及72 h时,400、600 μmol/L组间差异均具有统计学意义(P<0.01,图2~3)。

图2 不同浓度大蒜素对SCC-15细胞迁移能力的影响( ×100)
2.3 大蒜素抑制SCC-15细胞侵袭活力
根据CCK-8及细胞划痕实验的结果选取400、600 μmol/L浓度大蒜素培养SCC-15细胞进行Transwell实验。48 h后,两个药物实验组与对照组相比,穿过滤膜的细胞数量明显减少。对比两个实验组,600 μmol/L浓度组比400 μmol/L浓度组穿过滤膜的细胞数进一步降低(图4)。
2.4 大蒜素治疗口腔鳞癌的潜在靶点基因
去除重复后,保留了大蒜素104个潜在靶点。与获得的口腔鳞癌相关基因进行交集后获得12个基因(ALDH1A1, ADORA3, CDC25B, MGLL, CYP3A4, CTSS, CTSC, MAOB, AURKA, CES2, HSD11B1, PDE7A)(图5)。通过进一步应用STRING-DB分析靶点蛋白间的相互作用,在去除重复后得到60个相关作用靶点,对其交互作用进行可视化分析,构建互作网络(图6)。
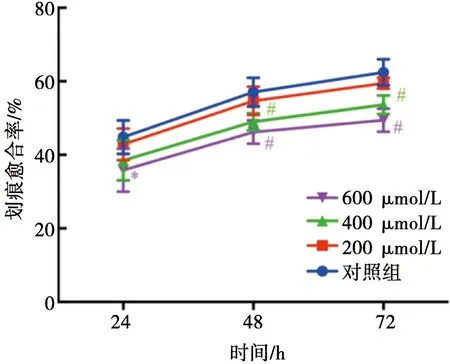
紫色*和#符号代表600 μmol/L处理组在24 h、48 h和72 h时间点分别与对照组比*P<0.05和#P<0.01,绿色#符号代表400 μmol/L处理组在48 h和72 h时间点分别和对照组比#P<0.01
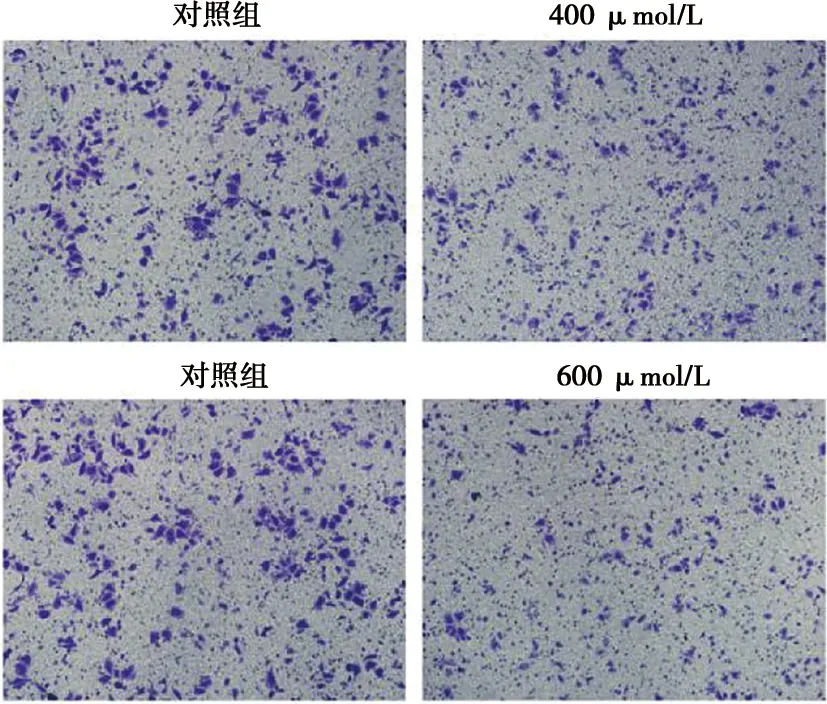
图4 大蒜素对SCC-15细胞侵袭活力的影响 ( ×100)
2.5 靶基因交集的KEGG和GO功能分析
为了确定60个相关作用靶点对口腔鳞癌作用的潜在机制,通过KEGG对其进行通路富集分析,筛选出前10个相关通路。其中P≤0.05且FDR≤0.05的相关通路为:细胞周期信号通路、p53信号通路、FoxO信号通路、类固醇激素生物合成、人T细胞白血病病毒1型感染及铂类药物耐药性相关通路等(表1)。GO功能分析结果显示:大蒜素主要通过调控DNA及蛋白质的功能或活性来影响口腔鳞癌的生物调控、代谢过程、定位、增殖和生长等生物过程(图7)。
3 讨 论
口腔颌面部恶性肿瘤具有极强的增殖及侵袭能力,易向局部组织浸润和发生早期转移[14]。有统计表明约60%的口腔鳞癌病人在就诊检查时病程已达到中晚期,增加了治疗难度,对患者的生存造成严重威胁[15]。单纯的手术治疗已经难以达到满意的治疗效果,常需根据患者实际病情设计出特定的治疗序列,个体化治疗口腔鳞癌[16]。化疗在治疗恶性肿瘤过程中扮演着重要角色,但化疗药物所带来的副作用等问题同样令人担忧,这些问题一直制约着口腔鳞癌的治疗效果。因此寻找一种安全有效的药物就成为了当下治疗口腔鳞癌的重要研究方向。
作为一种天然植物提取物,大蒜素因其生物特性在抗癌治疗方面有广阔的应用前景。有研究证实大蒜素能破坏恶性肿瘤的细胞结构,调控肿瘤细胞内促凋亡信号通路上相关基因及蛋白的表达,诱导肿瘤细胞凋亡[17]。大蒜素还可以增加体内免疫细胞对癌细胞的敏感性,提高免疫细胞对癌细胞的杀伤能力[18]。Tao等[19]研究了大蒜素抑制人胃癌SGC-7901细胞增殖的作用,研究结果表明相较其他化疗药,大蒜素对SGC-7901细胞具有明显的抑制作用。本研究中,为探索大蒜素对SCC-15细胞增殖的影响,我们通过CCK-8实验用不同浓度的大蒜素溶液处理SCC-15细胞,经过24 h后观察到细胞的生长受到了抑制,且这种抑制作用随着药物浓度的提高和作用时间的延长而更加明显。说明大蒜素具有抑制SCC-15细胞增殖的能力,且抑制能力具有浓度和时间依赖性。Jabalee等[20]研究证实,口腔鳞癌的发展与转移同癌细胞超常的细胞迁移能力和侵袭能力密切相关。Zhang等[21]通过实验证明大蒜素能有效抑制人宫颈癌细胞的迁移,降低肿瘤转移的风险。我们通过划痕实验发现,经大蒜素溶液处理后SCC-15细胞的划痕愈合率较未处理组明显降低,在处理后的48 h和72 h,大蒜素显著降低了划痕两侧细胞向中央迁移的趋势。基质金属蛋白酶类(matrixmetalloproteinases,MMPs)可以降解细胞外基质成分(extracellular matrix,ECM),ECM被破坏后组织受肿瘤侵袭的风险大大提高。有研究报道称大蒜素对人结肠癌205细胞作用后,其侵袭性明显下降,测得细胞内MMP-2、MMP-7和MMP-9的表达降低[22]。在本课题的Transwell侵袭实验中,Transwell小室底部滤膜上铺满的Matrigel胶模拟了细胞外基质成分,通过观察穿过滤膜细胞数的多少来判断细胞侵袭能力的强弱。实验结果显示,在实验进行48 h后,400 μmol/L和600 μmol/L大蒜素组细胞穿过滤膜的数量较未用大蒜素处理组明显减少,且600 μmol/L浓度治疗组较400 μmol/L组穿过滤膜的细胞数进一步降低,这说明大蒜素可以抑制口腔鳞癌细胞的侵袭能力。
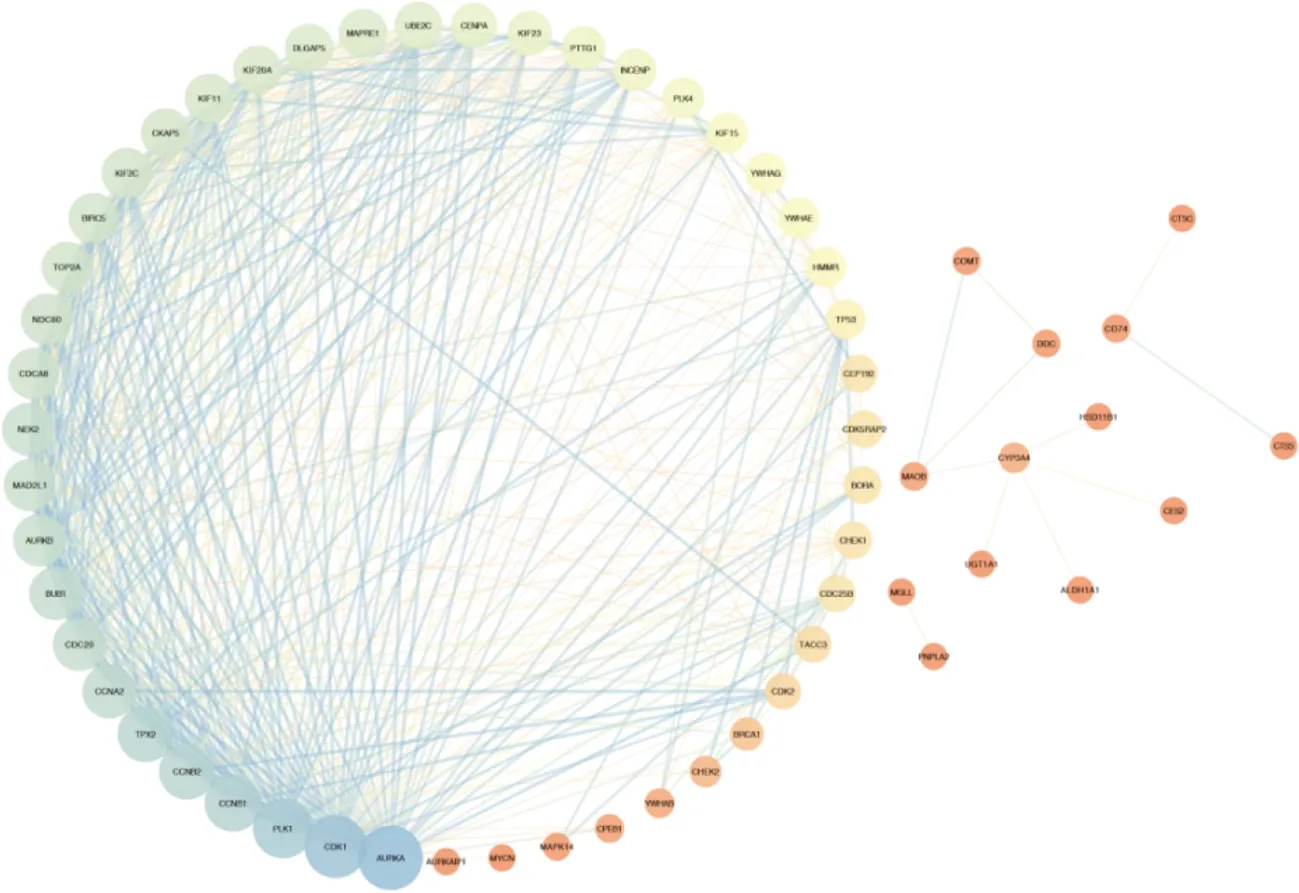
图6 大蒜素相关作用靶点的蛋白网络构建
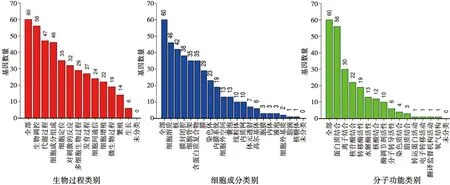
图7 大蒜素相关作用靶基因的GO功能分析
上述研究通过CCK-8实验、细胞划痕实验和Transwell侵袭实验证明了大蒜素能够呈浓度和时间依赖性的抑制口腔鳞癌细胞SCC-15的增殖、迁移和侵袭能力。在此基础上,我们选择网络药理学方法进一步探索大蒜素抑制口腔鳞癌发展的可能机制。网络药理学通过大数据对生物系统进行筛选和分析,能阐明药物与作用靶点间的相互作用关系,成为目前探索药物多靶点作用的有效手段。本研究首先从大蒜素的结构出发探索了大蒜素发挥生物活性作用的潜在靶点,继而又通过大数据筛选、分析出了大蒜素的作用靶点和口腔鳞癌发病基因的交集。将交集相互作用筛选后,我们得到了我们得到了ALDH1A1, ADORA3, CDC25B, MGLL, CYP3A4, CTSS, CTSC, MAOB, AURKA, CES2, HSD11B1, PDE7A这12个大蒜素作用于口腔鳞癌的核心靶基因。这12个核心靶点基因对肿瘤形成和发展过程中的细胞周期、酶活性等重要节点发挥调控作用,它们出现异常往往会导致肿瘤的发生[23-26],这其中已有临床及基础研究表明ALDH1A1和AURKA与口腔鳞癌的发生发展有关。ALDH1A1阳性的口腔鳞癌患者其预后和生存率表现均较阴性患者差[27]。 AURKA高表达的患者总体生存率较对照组患者低,且体外实验中敲除AURKA基因后口腔鳞癌细胞增殖、迁移和侵袭均被显著抑制并诱导了口腔鳞癌细胞凋亡[28]。相关文献报道体内CDC25B、MGLL、CYP3A4、 MAOB、CES2、 HSD11B1异常是肾癌、胃癌、乳腺癌、肺癌、肠癌、前列腺癌发生的相关危险因素[29-34],但目前尚未有试验研究这些基因在口腔鳞癌中的致病作用,因此本课题也为其他的学科的基础和临床研究提供了新的方向。通过构建PPI网络,我们发现了60个与核心靶点相关的作用靶点。通过KEGG和GO方法对这60个作用靶点富集的通路和功能进行了深入分析。结果显示,大蒜素对于口腔鳞癌的作用主要富集在调控细胞周期、p53信号通路、FoxO凋亡通路等信号通路以及对肿瘤生物调控、代谢过程、细胞定位、细胞成分和分子成分等方面,通过影响上述通路和生物过程来抑制口腔鳞癌的发生与发展,这些可能是大蒜素治疗口腔鳞癌的机制。从KEGG和GO分析结果来看,调控口腔鳞癌细胞周期和影响p53通路的表达在分析中的显著程度较高。
既往研究证明大蒜素对细胞周期有较强的特异性,有报道称大蒜素能通过阻滞人骨肉瘤细胞Saos-2的细胞周期来干扰该细胞的正常增殖[35]。经过大蒜素作用后Saos-2细胞停滞在G0/G1期的比例明显增高,且随着大蒜素浓度的提高和作用时间的延长,细胞停滞的比例也随之升高。影响细胞周期有益于减少肿瘤细胞的增殖,结合我们的实验结果和预测结果,表明大蒜素可能是通过干预细胞周期来影响口腔鳞癌细胞的增殖。野生型p53基因是体内重要的抑癌基因,对DNA修复、细胞的增殖、分化等起到调控作用。但当细野生型p53基因出现突变或其他缺陷时,其将失去对细胞监视和调控等功能,突变为促癌基因。一项有关口腔鳞癌患者术后复发的回顾性分析发现,p53基因是口腔鳞癌术后复发的独立危险因素[36]。另一项研究发现,突变型p53基因的高表达提示了口腔鳞状上皮有高度恶化的倾向[37]。这些结果表明,p53基因的表达与口腔鳞癌的发生密切相关,靶向调控p53基因有益于口腔鳞癌的治疗。我们的研究发现大蒜素可以调控口腔鳞癌中p53信号通路的表达,虽然尚未进行实验验证,但Arora等[38]在研究中发现大蒜素通过增加野生型p53表达水平、下调突变型p53表达,抑制了皮肤鳞状细胞癌的进展,这也再次印证了大蒜素靶向调控p53基因可能是抑制肿瘤发展的原因。
我们的研究以生物学实验为起点,首先探索出了大蒜素对口腔鳞癌SCC-15细胞增殖的抑制作用,并探索出经过大蒜素作用后的SCC-15细胞在体外的迁移能力和侵袭能力显著下降。通过网络药理学方法从宏观信息学的角度探索了大蒜素对口腔鳞癌治疗潜在的作用靶点及可能影响的通路及细胞功能。这些研究不仅为大蒜素应用于临床个体化治疗口腔鳞癌患者提供了新的研究方向,也为进一步阐明大蒜素抑制口腔鳞癌发生发展的机制提供了新的理论依据和思路。
