BMP2和BMP4对牙釉质基质蛋白酶表达的调控
2020-09-28刘向晖耿硕硕罗晓娜许莹莹袁浩泽王秀梅谢晓华
刘向晖,耿硕硕,吴 迪,李 莹,罗晓娜,许莹莹,袁浩泽,王秀梅,谢晓华
骨形态发生蛋白(bone morphogenetic protein,BMP)是一类调节多种发育过程的生长因子,属于转化生长因子β(transforming growth factor-β,TGF-β)超家族中最大的亚群[1]。BMPs最初是1965年被发现并从脱钙骨基质中分离出的,它能够诱导异位骨的形成。随着研究的深入,目前已知BMPs会影响许多生物系统的形成和功能,包括铁代谢、癌症、骨和肌肉的发育等[2-4]。牙齿发育过程中的细胞分化是由牙齿上皮细胞和间充质细胞之间相互作用所产生的[5],而BMPs在牙齿发育过程中可以调节上皮-间质的相互作用,并在早期矿化过程中发挥作用[6]。在这个过程中,BMP2在上皮细胞和间质细胞中均有表达[7]。牙齿中的BMP2能够诱导成釉细胞的分化和调节釉质相关基因的表达,并能够在早期牙矿化过程中协调成牙本质细胞和成釉细胞的分化[8]。在早期牙齿发育过程中,BMP4的表达从牙上皮细胞向间充质细胞转移,BMP4在牙形态发生的上皮-间质相互作用中起主要作用[9-10]。BMP4还可以在体外培养的条件下激活成釉细胞和成牙本质细胞[11]。已有研究发现使用Osx-Cre条件性敲除BMP2可以导致小鼠出现釉质发育异常,使用Wnt1-Cre条件性敲除BMP4可以导致小鼠的牙齿出现不同程度的损害[12-13]。我们的前期研究发现BMP2和BMP4上皮条件性基因敲除鼠会表现出釉质生成不良(amelogenesis imperfecta,AI)的症状,同时基因敲除鼠成釉上皮也表现出MMP20和KLK4基因转录水平的下降[14]。本实验研究了体外情况下BMP2和BMP4对牙釉质基质蛋白酶表达的影响,以期进一步阐明BMP2和BMP4蛋白对牙釉质发育的作用机制。
1 资料与方法
1.1 主要仪器和试剂
7500型实时荧光定量PCR仪(Thermo,美国);Western blot显影仪(天能,中国);低温高速离心机(Thermo,美国);电子显微镜(Nikon,日本);细胞培养箱(Thermo,美国);FBS(Gibco,美国);青霉素(Sigma,美国);链霉素(Sigma,美国);DMEM培养基(Hyclone,美国);重组小鼠BMP2蛋白(R&D,美国);重组小鼠BMP4蛋白(R&D,美国);Dorsomorphin(Sigma,美国);逆转录试剂盒(Takara,日本);SYBR荧光定量聚核酶链反应试剂盒(TaKaRa,日本);MMP20、KLK4、GAPDH引物(Invitrogen,美国);组织总蛋白提取试剂盒(Sigma,美国);蛋白BCA定量试剂盒(碧云天,中国);本实验所用一抗:MMP20(abcam,美国);KLK4(abcam,美国);GAPDH(CST,美国);P-Smad1/5/8(CST,美国);pan-Smad1/5/8(abcam,美国);P-p38(CST,美国);pan-p38(CST,美国);二抗(索莱宝,中国)。
1.2 方法
1.2.1 细胞及培养条件 小鼠成釉细胞系ALC由滨州医学院所赠,细胞系采用含10%FBS、100 U/mL青霉素和100 μg/mL链霉素的DMEM培养基培养,置于5% CO2、饱和湿度的37 ℃恒温孵箱中进行培养。待细胞贴壁后,每3 d换液一次,待细胞生长至80%汇合时常规传代培养或给药处理。重组小鼠BMP2蛋白和BMP4蛋白的使用浓度为100 ng/mL,BMP通路抑制剂Dorsomorphin溶于DMSO,使用浓度为20 μmol/L。
1.2.2 实时荧光定量PCR 检测采用RT-PCR技术。ALC细胞经处理后使用Trizol法提取RNA。通过逆转录试剂盒将提取的RNA逆转成cDNA。定量PCR反应总体积为20 μL,具体组成如下:逆转录cDNA 1 μL,上下游引物各1 μL,2×TB Green Premix(Takara)10 μL,无酶水7 μL。PCR引物序列如下,KLK4:5′-AACCTAAGGGACAGGGCAGT-3′,5′-GACAGTATCGGCCTCAGGAA-3′;MMP20:5′TGTCTAAGCTCAAGGTGCCCTGTT-3′,5′-TAAGTTGTCCATGTGGGTGCTGGA-3′;GAPDH:5′-TCCAGAACATC-ATCCCTGCCTCTA-3′,5′-ACAAAGTGGTCGTTGAG-GGCAATG-3′。扩增流程如下:94 ℃ 1 min,95 ℃ 15 s,60 ℃ 30 s,共40个循环。每个样品重复3次,结果采用2-ΔΔCT方法进行比较。
1.2.3 Western blot检测蛋白 根据组织总蛋白提取试剂盒操作说明提取细胞系样品组织蛋白,使用蛋白BCA定量试剂盒测定样品蛋白浓度,向样品中加入还原性loading buffer煮沸变性,配制10% SDS-PAGE凝胶,每孔上30 μg样品,跑胶后电转至PVDF膜上,采用5%脱脂奶封闭1 h,之后放入抗体中进行孵育,PBST洗涤后加入HRP标记的山羊抗小鼠二抗(1∶5 000)中孵育,洗涤后进行曝光。
1.3 统计学处理
数据采用GraphPad Prism8.0软件分析,所有数据均以“平均值±标准误”形式报告,组间比较用t检验,检验水准α=0.05,P<0.05为差异有统计学意义。
2 结 果
2.1 BMP信号通路的变化
Western blot结果显示,与未加入蛋白刺激的对照组相比,BMP蛋白作用30 min后,Smad1/5/8及p38磷酸化水平明显增加(图1A),其差异有统计学意义(P<0.001,图1B)。这表明BMP2和BMP4蛋白联合干预可以明显激活BMP通路的活性,包括Smad依赖性通路(经典通路)和Smad非依赖性通路(非经典通路)。另一组样本中加入BMP通路抑制剂(Dorsomorphin),对照组加入等量的DMSO,处理3 h后取材。Western blot结果显示和对照组相比Smad1/5/8的磷酸化水平显著下降,差异有统计学意义(P<0.001,图2),而p38磷酸化的变化不明显。该结果表明在BMP抑制剂的作用下,Smad依赖性通路(Smad1/5/8通路)的表达被抑制,而Smad非依赖性通路(p38通路)则不受影响。
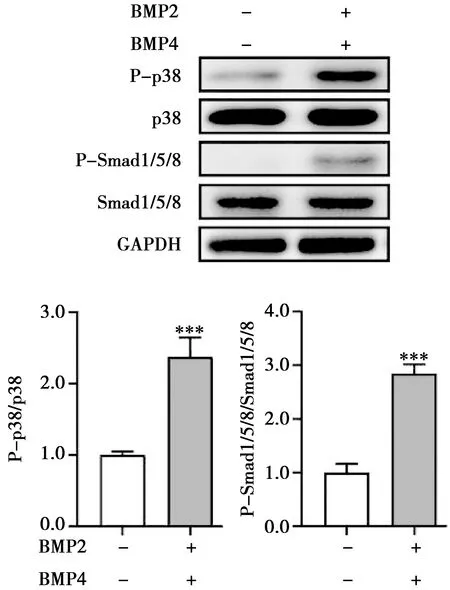
与对照组比较,***P<0.001(n=3)

与对照组比较,***P<0.001(n=3)
2.2 牙釉质基质蛋白酶MMP20和KLK4的变化
Real-time PCR的结果显示,与对照组相比,BMP蛋白刺激12 h后,MMP20和KLK4的基因表达明显升高(P<0.01,图3);与对照组相比,抑制剂处理12 h后,Real-time PCR的结果显示MMP20和KLK4的基因表达明显下降,差异具有统计学意义(P<0.01,图3)。该结果表明BMP2和BMP4重组蛋白能够正向调控MMP20、KLK4基因的表达,抑制剂Dorsomorphin可以负向调控MMP20、KLK4基因的表达,据此我们可以认为:BMP通路,尤其是Smad依赖性通路对MMP20、KLK4基因的表达具有至关重要的作用。

与对照组相比,**P<0.01,***P<0.001(n=3)
2.3 BMP蛋白的挽救作用
Western blot结果显示,与未作处理的对照组相比,Dorsomorphin作用12 h后,MMP20和KLK4的蛋白表达明显下降(P<0.001,图4)。而BMP蛋白刺激12 h后,MMP20和KLK4的蛋白表达变化不大(图4B)。同时存在Dorsomorphin和BMP蛋白的挽救组相较于抑制剂Dorsomorphin组,MMP20和KLK4的蛋白表达水平明显上升,差异有统计学意义(P<0.001,图4B)。该结果显示BMP抑制剂Dorsomorphin抑制了MMP20和KLK4蛋白水平的表达;BMP2、BMP4蛋白对MMP20和KLK4蛋白水平表达的影响不大;在BMP抑制剂存在的情况下,再加入BMP2、BMP4蛋白进行刺激的结果显示MMP20和KLK4的蛋白表达水平有了明显的改善。BMP蛋白可以上调由于抑制剂Dorsomorphin导致的MMP20和KLK4蛋白水平的下降。
3 讨 论
AI是钙化障碍和釉质形成缺陷的一组遗传性疾病,严重影响了牙齿的美观和人们的生活质量。AI可以分为矿化不全型和形成不全型,但所有的类型都存在钙化和釉质基质形成的障碍。成熟的牙釉质主要由无机物和极少量的有机成分和水组成。无机物为高度矿化、有序排列的羟基磷灰石晶体。有机成分主要是成釉细胞分泌的基质蛋白和蛋白酶,釉质基质蛋白包括釉原蛋白(amelogenin,AMEL),成釉蛋白(ameloblastin,AMBN),釉蛋白(enamelin,ENAM),釉成熟蛋白(amelotin,AMTN)和牙成釉细胞相关蛋白(odontogenic ameloblast-associated protein,ODAM)等;釉基质蛋白酶主要有MMP20和KLK4。在釉质基质蛋白相关基因中AMEL、AMBN和ENAM基因突变或缺失会引起人和小鼠牙釉质生成不良[15-17]。同时釉质基质蛋白酶中MMP20和KLK4基因的缺失也会导致釉质发育异常[18-21]。

与对照组相比,*P<0.05,***P<0.001;与抑制剂组相比,#P<0.001(n=3)
胞外配体BMP2和BMP4可以与BMPRⅡ形成二聚体,使得BMPRⅡ受体磷酸化。Ⅱ型受体能够激活Ⅰ型受体,进一步磷酸化Smad1/5/8,然后磷酸化的Smad1/5/8在细胞核内与Smad4结合形成异质二聚体复合物。这种Smad复合物可以直接或者在其他DNA结合蛋白的参与下调控相关靶基因的转录[22]。BMP主要通过依赖Smad途径和p38-MAPK途径两条信号通路发挥作用,且信号转导过程受细胞外拮抗剂、膜受体、细胞质微环境和转录水平4个层次的调节控制。据研究显示,条件性敲除Smad4小鼠也会表现出釉质和牙本质的发育不良,可以预见BMP-SMAD途径对釉质发育至关重要[23]。
本课题组实验结果显示,BMP2、BMP4蛋白促进了ALC细胞Smad1/5/8和p38磷酸化蛋白的表达,而在加入BMP抑制剂Dorsomorphin后,Smad1/5/8磷酸化蛋白减少,p38磷酸化蛋白变化不大,说明Dorsomorphin阻断了Smad1/5/8蛋白的磷酸化。现有研究显示Dorsomorphin可以抑制ALK2、ALK3和ALK6-BMP Ⅰ型受体,而这些受体又可阻断BMP介导的Smad1/5/8磷酸化和成骨分化[24]。同时课题组证明了使用一定浓度的BMP2、BMP4蛋白可以部分恢复Dorsomorphin阻断的MMP20和KLK4蛋白的表达。综上可见,BMP2和BMP4蛋白能够通过影响BMP通路介导下游靶基因MMP20和KLK4的表达,而Smad依赖性通路在此调节中起主导作用,而Smad非依赖性通路对釉质发育的影响还需进一步探究。
AI作为一种干扰牙釉质形成或矿化的遗传性疾病,临床上尚缺乏有效且特异的干预治疗手段,目前主要采用修复治疗来改善外观和功能,而最近的临床研究表明BMP2和BMP4基因缺失可以导致病人出现牙齿发育不良的临床症状[25]。这揭示了BMP2和BMP4可能是釉质生成不良疾病的潜在致病基因,对其进行的靶向预防和治疗,可能为我们防治此类疾病提供新的想法和思路。
