食管鳞癌患者EGFR蛋白表达及基因扩增特点的临床病理学研究
2020-09-28丹尼尔多里坤伊地力斯阿吾提卡吾力居买张力为买地尼也提尼亚孜
丹尼尔·多里坤, 伊地力斯·阿吾提, 卡吾力·居买, 杨 宁, 张力为, 买地尼也提·尼亚孜
(新疆医科大学第一附属医院1临床医学研究院; 2胸外科, 乌鲁木齐 830054)
食管癌是一种常见的消化道肿瘤,我国食管癌的发病率和死亡率居世界第一[1-3],新疆是我国食管癌的集中高发区[4,5]。目前临床上对食管癌的治疗方法包括手术或放疗为主、化疗为辅的治疗模式,但患者预后较差,尤其是晚期食管癌,患者总体5年生存率仅为8~25%[6,7]。近年来随着分子肿瘤学的发展,分子靶向治疗为食管癌的治疗提供了另一种的有效途径,分子靶向治疗是以肿瘤细胞为靶点的治疗方法,目前在部分恶性肿瘤治疗中替代了一线化疗[8-11]。在多种肿瘤中均可以观察到表皮生长因子受体(Epidermal growth factor receptor, EGFR)的过表达,有时伴有基因扩增,因此EGFR是目前主要的肿瘤治疗靶点[12-13]。靶向治疗的一个关键问题就是找到最佳的治疗对象,荧光原位杂交(Fluorescence in situ hybridization,FISH)技术检测基因扩增为筛选靶向药物的适用者提供了新的途径[14]。本研究采用免疫组织化学(Immunohistochemistry, IHC)结合FISH技术确定食管癌EGFR表达和基因扩增情况,探究蛋白表达与基因扩增的关系,进一步分析 EGFR基因与肿瘤的临床病理特征以及预后的相关性,现报道如下。
1 资料与方法
1.1 一般资料收集2009年11月-2012年12月新疆医科大学第一附属医院胸外科收治的71例食管癌患者癌组织及相应癌旁正常组织标本,均为鳞状细胞癌。其中男性52例,女性19例,年龄38~79岁,中位年龄58岁。根据AJCC癌症分期手册进行术后病理学分期[15]。细胞分化程度:高分化23例,中分化28例,低分化20例。淋巴结转移28例,无淋巴结转移43例。肿瘤T分期:T1期 4例,T2 期30例,T3 期33例,T4 期4例。本研究通过新疆医科大学第一附属医院伦理委员会审核,对患者和家属介绍研究意义得到同意后均签署知情同意书。
1.2 免疫组织化学方法采用免疫组织化学链霉菌抗生物素蛋白-过氧化物酶(SP)法。EGFR 兔抗多克隆抗体购自美国Abcam 公司,测定步骤按试剂盒说明书操作:常规脱蜡水化,用3% H2O2消除内源性过氧化物酶的活性,经高压加热法抗原修复,滴加正常山羊血清工作液孵育30 min,滴加EGFR抗体(1∶100) 4℃放置过夜,用PBS 冲洗,滴加二抗后,置于恒温箱37℃下孵育30 min,用PBS 冲洗,经DAB显色,用蒸馏水冲洗,苏木素复染,封片。以0.01 mol/L PBS液替代一抗作阴性对照。
1.3 免疫组织化学结果判断免疫组织化学结果采取双盲法观察切片并诊断,使用细胞染色强度计分法及阳性细胞面积率计分法比较蛋白表达水平差异[16]。EGFR的阳性细胞染色定位于细胞膜及细胞质,以浅黄、棕黄或更深的棕褐色的细小颗粒作为阳性细胞。依照细胞阳性着色程度,可分为无着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。光镜下每张切片随机观察5个高倍视野(×20),计数阳性细胞百分比,0%为0分, 1%~25%为1分, 26%-~50%为2分, 51%~75%为3分,>75%为4分。细胞着色强度计分与阳性面积率计分之积为最后分:0分:(-),1~2分:(+),3~4分:(2+),>4分:(3+)。
1.4 EGFR扩增情况的测定采用FISH技术检测食管癌组织标本中EGFR基因扩增,用橘红色荧光标记EGFR基因,绿色荧光标记7号染色体着丝粒区域。标本用(73±1)℃的甲酰胺液(70%甲酰胺液:20×SSC溶液4 mL, 甲酰胺28 mL,蒸馏水8 mL)分解变性处理2 min后,依次置于70%、85%和100%的乙醇中各2 min进行梯度脱水。玻片干燥后,置于45℃电热板上预热5 min,用(73±1)℃恒温水浴槽中加热5 min的探针吸取10 μL滴于切片杂交区域放入湿盒,在37℃恒温孵育箱中杂交16 h,用(73±1)℃的2×SSC溶液洗涤2 min,再放入同样缓冲液在室温下洗涤1 min。用DAPI II复染液复染,封片,用荧光显微镜和激光共聚焦仪测定。
1.5 FISH阳性判别标准[17](1)≥4个红色信号的细胞数占细胞总数的40%以上;(2)统计Ratio值,若Ratio>2为阳性结果(Ratio值=100个细胞核中红信号总数/100个细胞核中绿信号总数);(3)≥15个红色信号的细胞数占细胞总数的10%以上;(4)成簇扩增的细胞≥10%以上。以上均为阳性结果,提示样本中EGFR基因发生扩增。
1.6 统计学处理采用SPSS 24.0统计学软件进行统计分析,计数资料以例(%)表示,组间比较采用非参数独立样本检验,两个指标间的比较采用卡方检验。单因素分析采用Kaplan-Meier 法,多因素分析采用COX回归模型,检验水准α=0.05。
2 结果
2.1 EGFR蛋白表达的免疫组化分析EGFR阳性细胞染色定位于肿瘤细胞膜以及细胞质,癌旁正常食管粘膜上皮( 距肿瘤边缘>5 cm ) 仅见上皮基底细胞低水平染色(+/-),基底以上的上皮细胞均呈 EGFR 阴性表达(图1, B)。71例食管癌患者中 51 例(71.83%)发现有EGFR过表达,其中 29 例为 3+,22 例为 2+,判定为阳性;12 例(16.9%)呈现较弱(1+)的免疫反应,判定阴性;8 例(11.26%)没有检测到 EGFR 表达。癌旁正常组织没有检测到 EGFR阳性表达,食管癌组织相对于癌旁正常组织,EGFR蛋白表达强度明显增强,见图1。
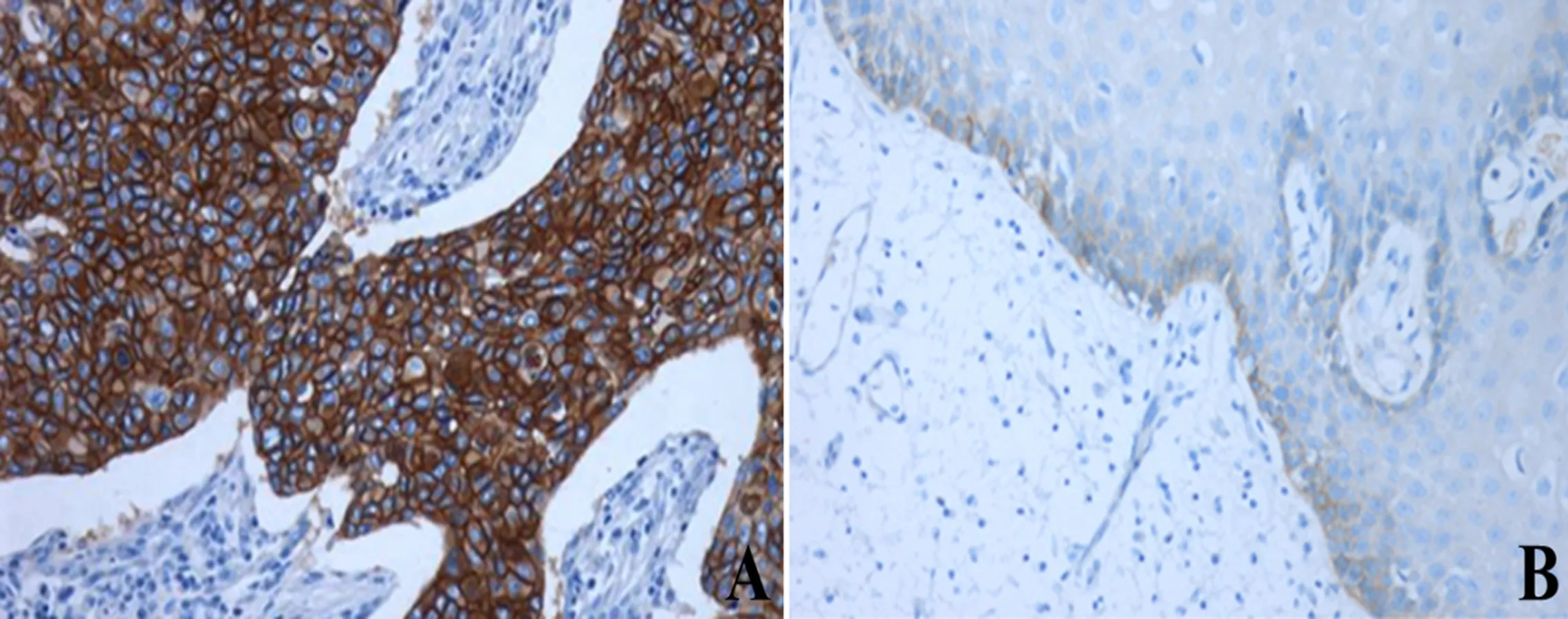
图1 EGFR 蛋白表达的免疫组化分析
2.2 EGFR 蛋白表达与临床病理因素的关系不同性别组、不同年龄组、不同肿瘤分化程度组、淋巴结转移有无组以及不同浸润深度组之间比较,EGFR蛋白表达差异无统计学意义(P>0.05),见表1。
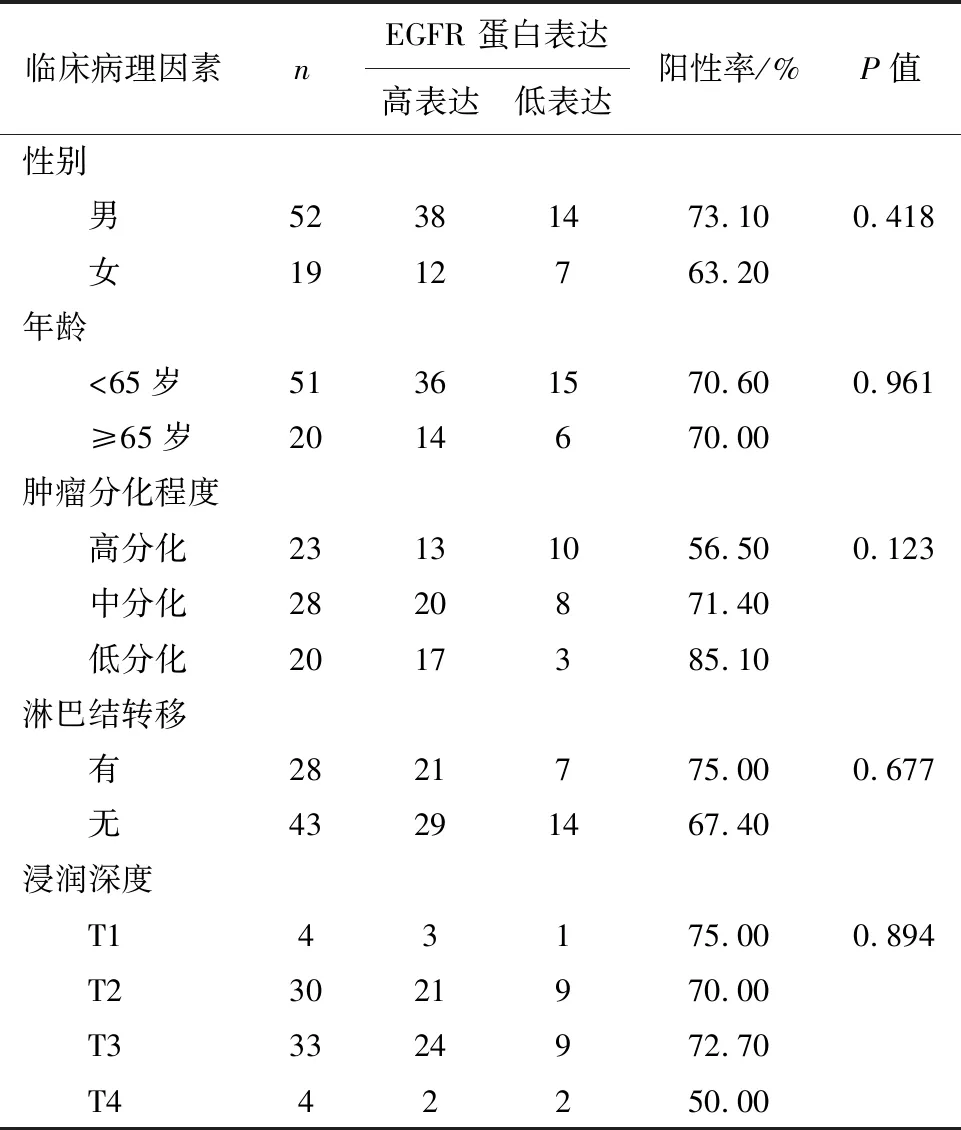
表1 食管癌患者不同临床病理因素条件下EGFR蛋白表达状态
2.3 EGFR FISH检测结果正常上皮细胞和非肿瘤基质或炎症细胞呈2个红色信号(EGFR基因)和2个绿色信号(7号染色体着丝粒)。被检测的40例食管癌中17例(42.5%)有EGFR基因扩增, 10%以上的肿瘤细胞可见15个以上的红色信号和2个以上绿色信号的成簇扩增(图2,A),40%以上的肿瘤细胞内可见4个或更多的红色和绿色信号的多倍体扩增(图 2,B)。

图2 EGFR 基因扩增FISH图
2.4 EGFR 基因扩增与临床病理因素的关系不同性别、不同年龄、不同浸润深度患者之间比较,EGFR 基因扩增差异无统计学意义(P>0.05)。不同肿瘤分化程度和有无淋巴结转移患者之间比较,EGFR 基因扩增差异有统计学意义(P<0.05),见表2。

表2 食管癌 EGFR 基因扩增情况与临床病理因素的关系
2.5 食管癌 EGFR 基因扩增与蛋白表达的相关性EGFR蛋白表达与基因扩增相关,尤其是高表达(2/3+)与基因扩增密切相关(P<0.05),见表3。

表3 食管癌 EGFR蛋白表达与基因扩增的相关性
2.6EGFR基因扩增与食管癌预后的关系Kaplan-Meier单因素分析显示,EGFR蛋白表达阴性及阳性组,中位生存时间(95%CI)分别是21个月(10.999~31.001)和16个月(12.984~19.016),见表4。两组患者生存曲线如图3所示,EGFR蛋白不同表达与患者生存率无关(P>0.05)。EGFR基因扩增阴性和阳性组,中位生存时间(95%CI)分别是27个月(21.181~32.819)和17个月(13.425~20.575)。两组患者生存曲线如图4所示,EGFR不同扩增状态与患者生存率相关,即EGFR扩增阳性患者生存期较扩增阴性患者显著要长(P<0.05)。进一步多因素COX回归分析结果显示,EGFR基因扩增是食管鳞癌患者不良预后的独立危险因素(P<0.05),见表5。
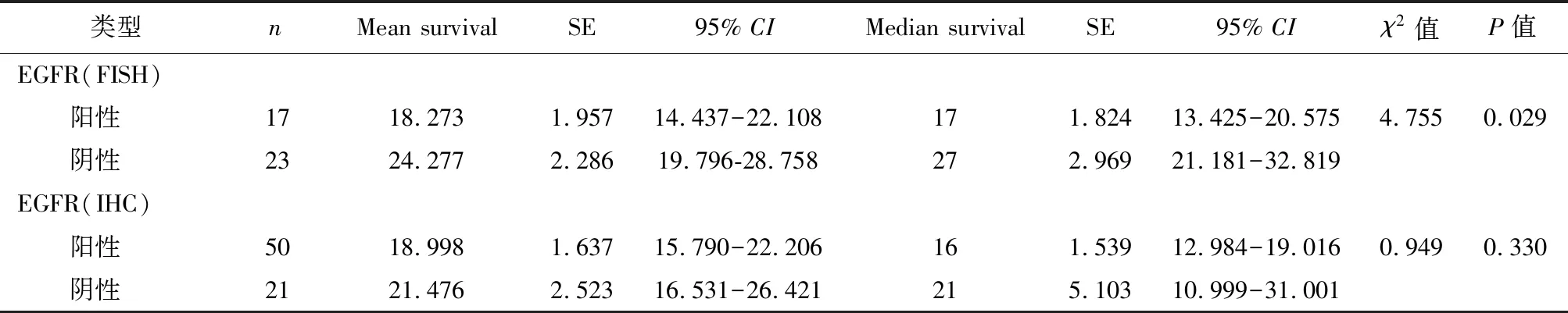
表4 EGFR蛋白表达及基因扩增对食管癌患者预后影响的单因素分析

图3 EGFR蛋白表达生存曲线图

图4 EGFR基因扩增生存曲线图

表5 EGFR蛋白表达及基因扩增对食管癌患者预后影响的多因素分析
3 讨论
目前手术切除仍是食管癌的主要治疗方法,由于早期症状不典型,患者就诊时多半已属中晚期或转移无法根治切除[18],食管癌是一种侵袭力较强的恶性肿瘤,术后复发和转移是预后差的另一主要原因[19]。因此改善患者预后、延长生存期和改善生存质量成为食管癌治疗的关键。原癌基因EGFR在食管癌的发生发展中起着重要的作用,EGFR被异常活化后,通过作用于细胞信号传导、细胞增殖、凋亡调控以及血管生成而促进肿瘤的发生和增殖。Mimura等[20]报道EGFR 抑制剂能明显抑制 EGFR 及Her-2 过表达,从而抑制食管癌细胞系的增殖。本研究中71.83% 的食管癌患者病例检测到 EGFR 蛋白过表达,结果与惠州客家人群食管癌[21]以及Carneiro等[22]报道的结果相近。Gibault等[23]发现EGFR过度表达与脉管侵犯、局部复发和较低的生存率显著相关,另有研究发现EGFR的过表达率与食管癌的预后因素没有关联[24]。本研究发现 EGFR 过表达与肿瘤分化程度、淋巴结转移及浸润深度等预后因素没有相关性,与Gotoh等[24]研究结果一致 。本研究中低分化食管癌EGFR表达以强阳性(3+)为主,而高分化食管癌 EGFR 以中等度或弱阳性(2+~+)为主,虽然没有统计学意义,但是提示EGFR过表达与食管癌恶性表型有关。
肿瘤组织中可以观察到EGFR 过表达,其原因是基因扩增[25-27],随着FISH技术发展,该方法在肺癌等肿瘤中已成为检测EGFR基因扩增的金标准[28]。本研究同时采用FISH技术检测食管癌组织EGFR基因扩增情况,发现EGFR蛋白表达与基因扩增相关,尤其是高表达(2/3+)与基因扩增密切相关,与Hanawa等[25]报告的研究结果相似。EGFR 基因扩增的患者生存时间小于EGFR无扩增的患者,这也进一步证明EGFR基因扩增是一个有价值的预后预测因子[29]。
综上所述,EGFR基因可能参与了食管癌的发生,在肿瘤进展、预后等方面也有一定的作用。EGFR蛋白表达及基因扩增的联合检测可作为判断食管癌预后和指导靶向药物治疗的重要指标。
