北极狐Wnt3a基因CDS区克隆及生物信息学分析
2020-09-27王瑞宁周瑞红赵子雅冯硕李可强彭永东李祥龙
王瑞宁,周瑞红,赵子雅,冯硕,李可强,彭永东,李祥龙
(河北科技师范学院动物科技学院,河北 秦皇岛 066004)
北极狐(Vulpeslagopus)绒毛稠密丰厚,针毛挺拔柔软,毛皮板质薄而结实并富有弹性,御寒力强,雍容高雅,号称“软黄金”。狐皮目前已经成为国际裘皮贸易的三大支柱产品之一,是制裘工业的高档原料,在毛皮动物产业中占有举足轻重的地位。北极狐作为重要的毛皮动物,其毛色丰富,是开展动物毛色研究的最佳材料,其中毛色作为影响狐皮品质最重要的性状之一,是狐皮经济价值关键因素[1]。
Wnt家族成员3a(wingless-type MMTV integration site family, member 3a,Wnt3a)是Wnt家族的重要成员之一,通过经典的Wnt/β-catenin信号通路参与细胞的增殖、分化、凋亡以及控制细胞的定位等过程[2]。Wnt3a在黑素细胞的发育中起着重要的作用,它可以促进神经嵴细胞向色素细胞发育,如果缺乏Wnt3a和Wnt1这2种蛋白,神经嵴细胞就会发育成神经元细胞而不是黑素细胞[3]。Wnt3a对黑色素细胞的分化也起到了调控作用,它可以促进小眼畸形相关转录因子(MITF)的表达,进而促进黑素母细胞分化成黑色素细胞[4]。Guo等[5]也发现,Wnt3a通过上调MITF及其下游基因酪氨酸酶和酪氨酸相关蛋白1(TRP1),在降低黑色素细胞增殖的同时,增加黑色素合成。Wnt蛋白对黑色素的调控作用一般是通过结合细胞膜上的脂蛋白受体相关蛋白5/6(LRP-5/6)和卷曲蛋白(frizzled)受体来实现的。它们形成的复合物活化胞内的散乱蛋白(dishevelled),进而抑制糖原合成酶激酶-β(GSK-β)的活性,增加胞浆内具有稳定结构的β-catenin的量,β-catenin聚集后结合TCF/LEF家族蛋白形成转录复合物,再与MITF基因的启动子结合,从而激活MITF基因的表达,参与黑色素细胞的分化、黑色素生成等[6-7]。在不同毛色的羊驼皮肤组织中,Wnt3a的表达量也具有显著差异[8]。除此之外,Wnt3a基因及其相关信号通路与多种疾病的发生相关,如先天性巨结肠病、结肠癌、肝癌、慢性牙周炎等[9-12]。因此对于Wnt3a基因及其相关信号通路的研究近几年成为热点。
关于北极狐Wnt3a基因和Wnt3a基因的生物信息学分析有关的研究尚未见报道,而本研究利用反转录PCR技术(RT-PCR),成功扩增了北极狐Wnt3a基因CDS区序列,然后构建到了pMD 18-T载体中,并对北极狐Wnt3a基因CDS区进行了生物信息学分析,为今后北极狐毛色调控机制和Wnt3a基因及相关信号通路的研究奠定了理论基础。
1 材料与方法
1.1 试验材料与试剂
北极狐为河北科技师范学院动物科技学院饲养,240日龄时,选择雄性北极狐屠宰后迅速取背部皮肤组织,液氮冻存30 min后,存放于-80 ℃冰箱中。
试验用到的反转录试剂盒、pMDTM18-T Vector Cloning Kit、PrimeSTAR Max DNA Polymerase、DNA Marker、氨苄青霉素购自TaKaRa公司;感受态细胞DH5α购自博迈德生物有限公司;胰蛋白胨、酵母粉、琼脂糖、TRIzol试剂购自Thermo Fisher Scientific公司;2×EsTaqMasterMix(Dye)购于康为世纪生物有限公司;DNA胶回收试剂盒购自OMEGA公司;质粒小提试剂盒购自上海生工生物工程有限公司。
1.2 试验方法
1.2.1 北极狐皮肤组织总RNA的提取及反转录
取北极狐皮肤组织,按照TRIzol法提取总RNA,用1.5%的琼脂糖凝胶电泳检测RNA质量,并用超微量分光光度计检测其浓度。参照反转录试剂盒说明书,以Oligo(dT)为引物,将RNA反转录为cDNA,然后存放于-70 ℃冰箱保存。
1.2.2 Wnt3a基因CDS区的扩增
从NCBI中找到了与北极狐同为犬科的澳洲野狗Wnt3a基因cDNA的序列(登录号XM_025454916.1),利用Primer 5.0软件进行引物设计。上游引物(F)为:5′-CGGTGCTCTCGGGGTGGAC-3′,下游引物(R)为:5′-CGCGCTACTTGCAGGTGT-3′,预计扩增片段大小为1 112 bp。引物交由北京华大基因有限公司合成。PCR反应体系为50 μL:PrimeSTAR Max DNA Premix(2×)25 μL,上、下游引物各1 μL,cDNA模板1 μL,ddH2O 22 μL。PCR反应条件为:95 ℃预变性5 min;98 ℃变性10 s,58 ℃退火8 s,72 ℃延伸10 s,共33个循环;72 ℃终延伸5 min;12 ℃保存。之后将所有PCR产物用1.5%的琼脂糖凝胶电泳,回收目的片段。
1.2.3 目的片段的克隆与鉴定
由于PCR扩增片段为平末端,构建至pMD18-T载体时,需要先对片段末端加A,具体方法为:取PCR回收产物24.9 μL,加入TaqDNA聚合酶0.6 μL,dNTPs 1.5 μL,10×PCR Buffer 3 μL,放在PCR仪中72 ℃修饰15 min。然后将产物用1.5%的琼脂糖凝胶电泳,回收目的片段。将目的片段与pMD18-T载体于PCR仪中16 ℃连接1 h。将连接产物转化至DH5α感受态细胞中,37 ℃摇床培养1.5 h。之后,取100 μL菌液涂在含有Amp的LB平板上,37 ℃培养12 h。挑取白色单菌落于1.5 mL离心管中,加入1 mL LB液体培养基(含Amp),37 ℃摇床培养5 h后,进行PCR鉴定。PCR反应体系为20 μL:2×EsTaqMasterMix 10 μL,上、下游引物各0.5 μL,菌液1 μL,ddH2O 8 μL。PCR反应条件为:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,共33个循环;72 ℃终延伸5 min;12 ℃保存。扩增产物用1%琼脂糖凝胶电泳检测,阳性菌液送北京华大基因有限公司测序。
1.3 生物信息学分析
利用NCBI中OFR Finder程序(https://www.ncbi.nlm.nih.gov/orffinder/)对北极狐Wnt3a基因核苷酸序列进行开放阅读框分析;利用Protparam(http://www.expasy.org/tools/protparam.html)、Protscale(http://web.expasy.org/protscale/)分析蛋白质理化性质;利用GOR4(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)、SWISS-MODEL(https://swissmodel.expasy.org/interactive)对蛋白质二级结构和三级结构进行分析;使用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析蛋白质跨膜结构;利用PSORT Ⅱ(https://psort.hgc.jp/form2.html)分析蛋白质亚细胞定位;利用NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)对蛋白质磷酸化位点进行预测;使用SignalP4.1(http://www.cbs.dtu.dk/services/SignalP/)对蛋白质信号肽进行分析;除了澳洲野犬外,又从NCBI中找到了家犬(XM_539327.5)、绵羊(XM_027969327.1)、人(XM_011544319.3)、小鼠(NM_009522.2)、马(XM_023618338.1)、鸡(NM_001171601.1)、雪貂(XM_003123621.4)的Wnt3a基因序列,利用MegAlign和MEGA 7软件进行同源性分析和系统进化树的构建。
2 结果与分析
2.1 Wnt3a基因克隆载体的构建
取北极狐Wnt3a基因PCR产物,用1%的琼脂糖凝胶电泳检测后,发现目的条带大小与之前预测的1 112 bp的大小相吻合(图1A)。通过切胶回收和末端修饰后,构建至pMD18-T载体,经过转化后挑取单菌落进行PCR,然后用1%的琼脂糖凝胶电泳检测(图1B),选择阳性菌液送公司进行测序。将测序结果进行拼接校正后,获得了北极狐Wnt3a基因完整的CDS区序列(图2)。
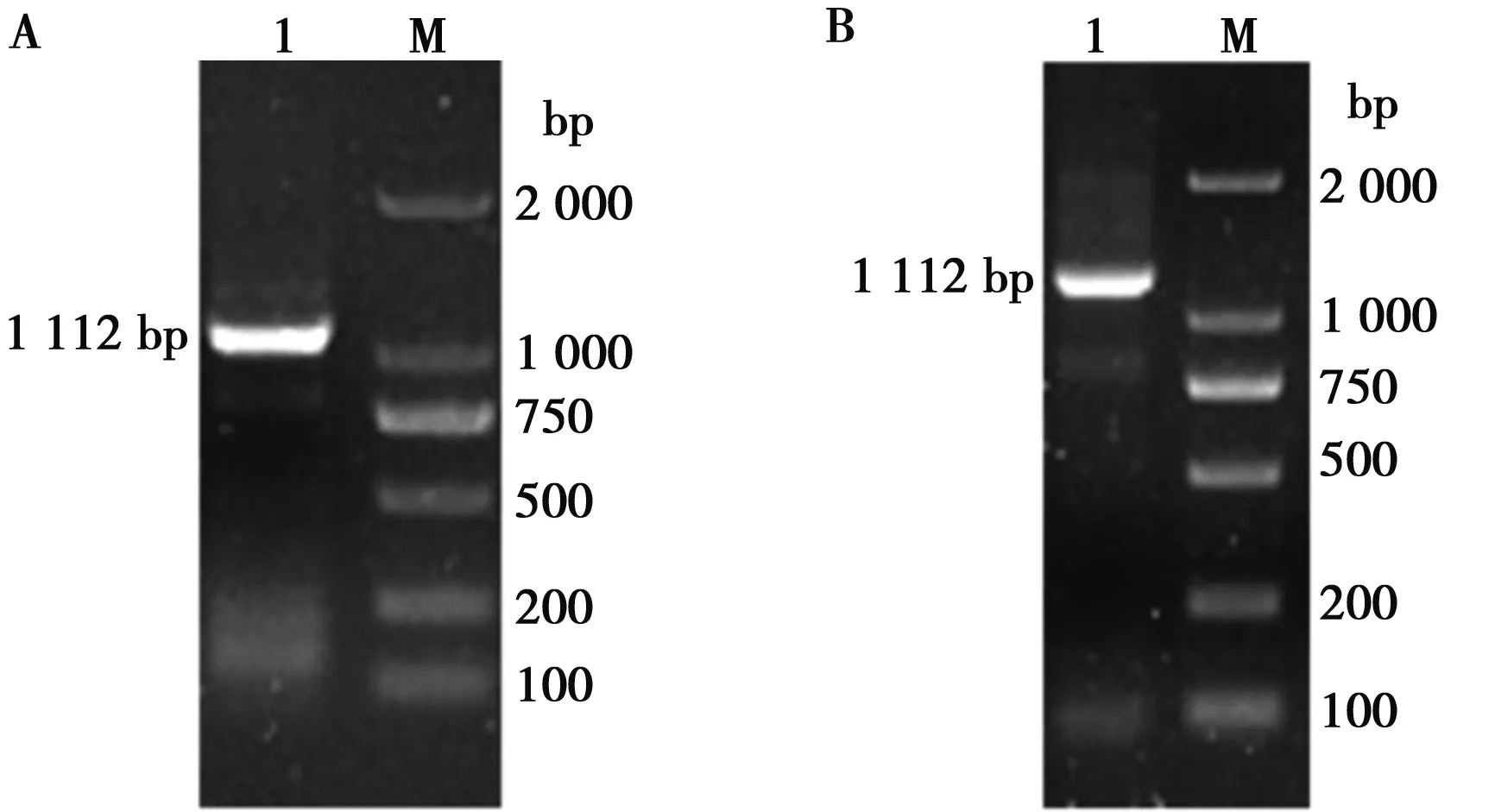
M.DL2000 DNA Marker;1.Wnt3a基因

图2 北极狐Wnt3a基因核酸及氨基酸序列
2.2 北极狐Wnt3a基因核苷酸序列及氨基酸序列分析
利用NCBI中的ORF Finder对测序得到的北极狐Wnt3a基因核苷酸序列进行了开放阅读框分析,得到了1条1 059 bp的ORF,其起始密码子位于第49位,终止密码子位于1 107位,共计编码352个氨基酸。通过DNAman对序列分析发现,其核苷酸序列A、T、C、G含量分别为17.9%、16.4%、33.8%、31.8%。其编码氨基酸组成及比例如表1所示,北极狐Wnt3a基因编码蛋白由20种氨基酸组成,其中丝氨酸含量最高,达到9.09%。

表1 北极狐Wnt3a基因编码蛋白氨基酸组成
2.3 北极狐Wnt3a基因编码蛋白理化性质分析
利用ProtParam在线工具对北极狐Wnt3a基因编码蛋白进行分析,得出其分子式为C1714H2626N506O506S31,相对分子质量为39 410.65,等电点为8.26,说明该蛋白为碱性蛋白质。当该蛋白所有的半胱氨酸残基形成半胱氨酸时,其消光系数为68 880 mol/mL,对应的吸光值为1.748;当该蛋白所有的半胱氨酸残基不能形成半胱氨酸时,其消光系数为67 380 mol/mL,对应的吸光值为1.710。在哺乳动物的网状红细胞中,该蛋白的半衰期为30 h。不稳定系数为50.26,说明该蛋白不稳定。脂溶指数为61.53,总平均亲水性(GRAVY)为-0.385,说明该蛋白为亲水性蛋白。该蛋白亲水性分析如图3所示,北极狐Wnt3a蛋白大部分氨基酸均属于亲水性氨基酸,因此总体显示出亲水性。
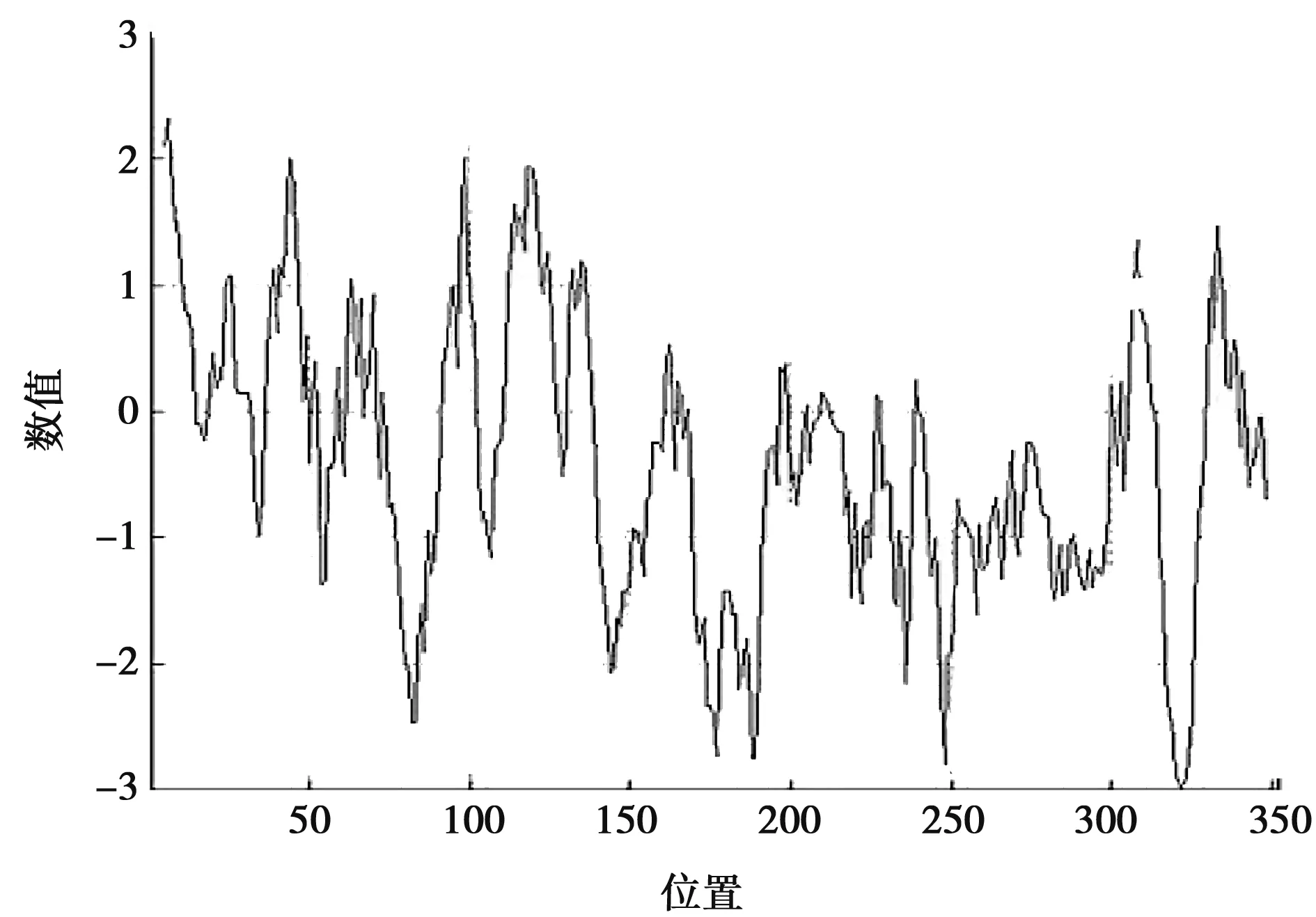
图3 北极狐Wnt3a基因编码蛋白亲水性分析
2.4 北极狐Wnt3a基因编码蛋白二级结构和三级结构的预测
利用GOR4在线分析工具对北极狐Wnt3a基因编码蛋白的二级结构进行分析,得出其二级结构中大部分为无规卷曲,占比为51.7%,其次为β-片层和α-折叠,占比分别为27.56%和20.74%,且不存在其他二级结构(图略)。使用SWISS-MODEL在线建模工具对北极狐Wnt3a蛋白进行三级结构预测,其主体结构较为复杂,与二级结构中预测到的存在大量的无规卷曲结果相一致(图略)。
2.5 北极狐Wnt3a基因编码蛋白跨膜结构与亚细胞定位分析
利用TMHMM在线分析工具对北极狐Wnt3a基因编码蛋白跨膜结构分析发现,该蛋白所有氨基酸均位于膜外(图4),所以推测该蛋白属于膜外蛋白。通过使用PSORTⅡ对北极狐Wnt3a基因编码蛋白进行亚细胞定位分析,预测出该蛋白定位于细胞质、细胞核、线粒体、细胞膜外、内质网和细胞骨架中,其占比分别为:30.4%、21.7%、21.7%、8.7%、8.7%、8.7%。

图4 北极狐Wnt3a基因编码蛋白跨膜结构分析
2.6 北极狐Wnt3a基因编码蛋白磷酸化和信号肽分析
通过使用NetPhos 3.1 Server在线工具对北极狐Wnt3a基因氨基酸序列进行蛋白质磷酸化位点分析(图5),发现其中有22个丝氨酸、6个苏氨酸、5个酪氨酸位点的预测值超过了临界值。
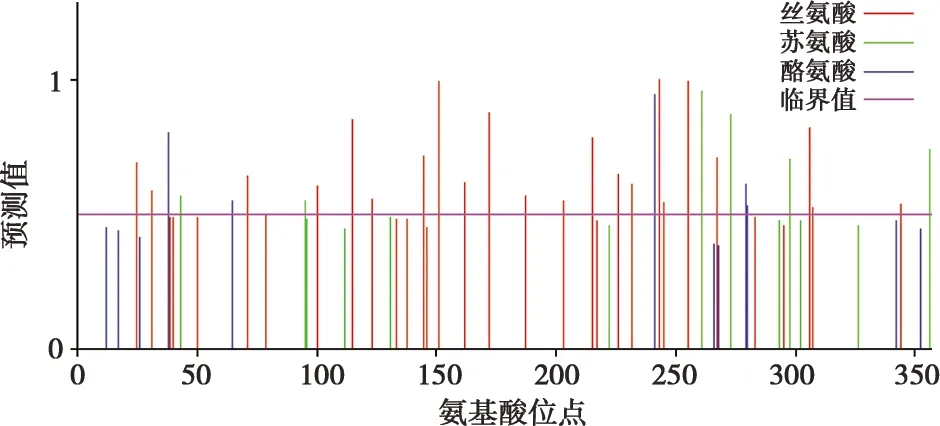
图5 北极狐Wnt3a基因编码蛋白磷酸化位点分析
利用SignalP 4.1在线工具对北极狐Wnt3a基因编码蛋白的信号肽进行了分析(图6),从第19个氨基酸位点开始,之后的氨基酸的C值、Y值、S值突然降低,然后趋于平缓,推测该蛋白可能存在信号肽,且信号肽位于1~19位氨基酸位点,其切割位点位于第19个氨基酸处。
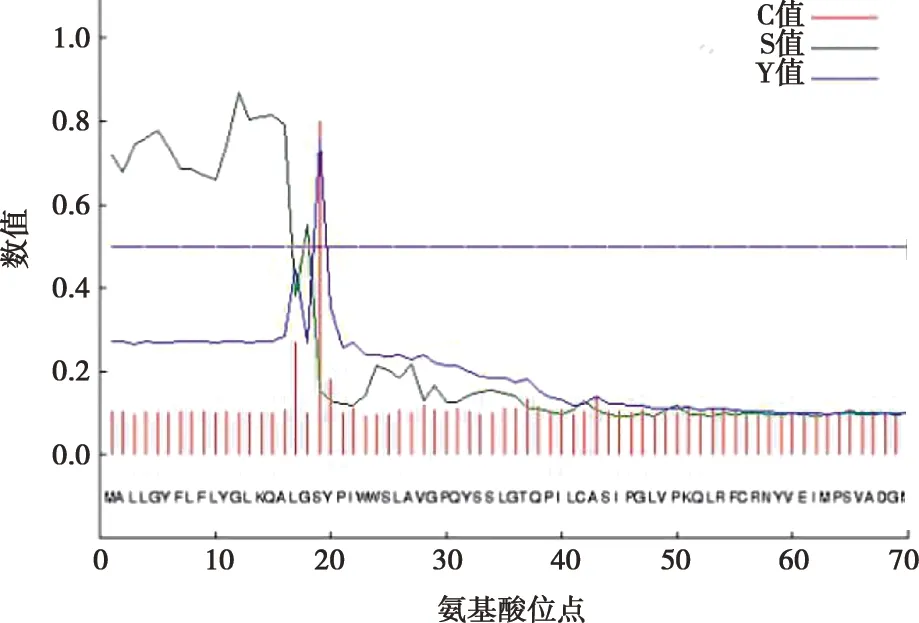
图6 北极狐Wnt3a基因编码蛋白信号肽分析
2.7 北极狐Wnt3a基因编码蛋白同源性与系统发育分析
从NCBI数据库中下载了澳洲野犬、家犬、绵羊、人等9个物种的Wnt3a基因的mRNA序列,利用MegAlign和MEGA 7软件对北极狐和这9个物种进行了Wnt3a基因的同源性分析(表2)和系统发育树的构建(图7)。从同源性分析来看,在这9个物种中,与北极狐亲缘关系最近的是澳洲野犬,其相似度达到了99.7%,亲缘关系最远的是原鸡,其相似度为75.2%。除此之外,家犬、绵羊、人、小鼠、马、野猪、雪貂与北极狐的Wnt3a基因的相似度都在85%以上,由此可以得出Wnt3a基因具有较好的保守性。从系统发育树来看,各物种间的亲缘关系与物种分类基本一致,与北极狐进化关系最近的为澳洲野犬,其次为家犬,且它们同属犬科;它们又与雪貂、野猪、绵羊、马、人、小鼠同为一类,它们同属于哺乳动物;而原鸡作为卵生动物,与北极狐的进化关系最远。
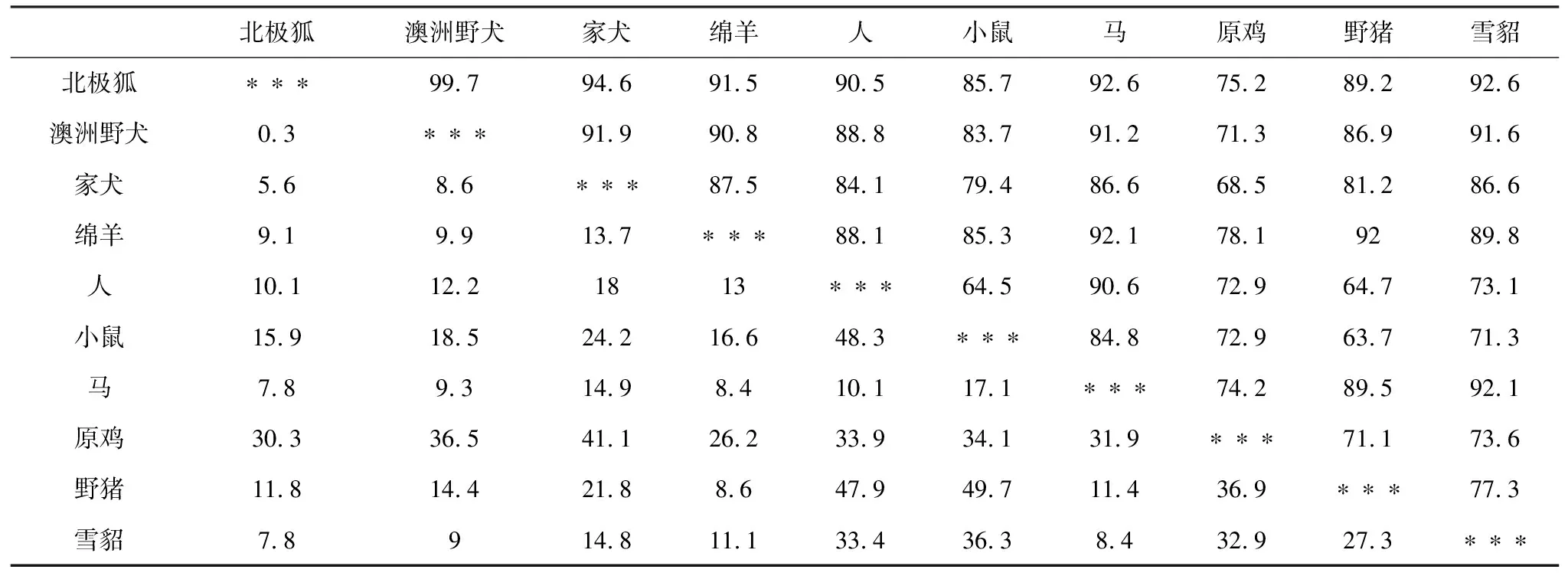
表2 10个物种Wnt3a基因同源性分析
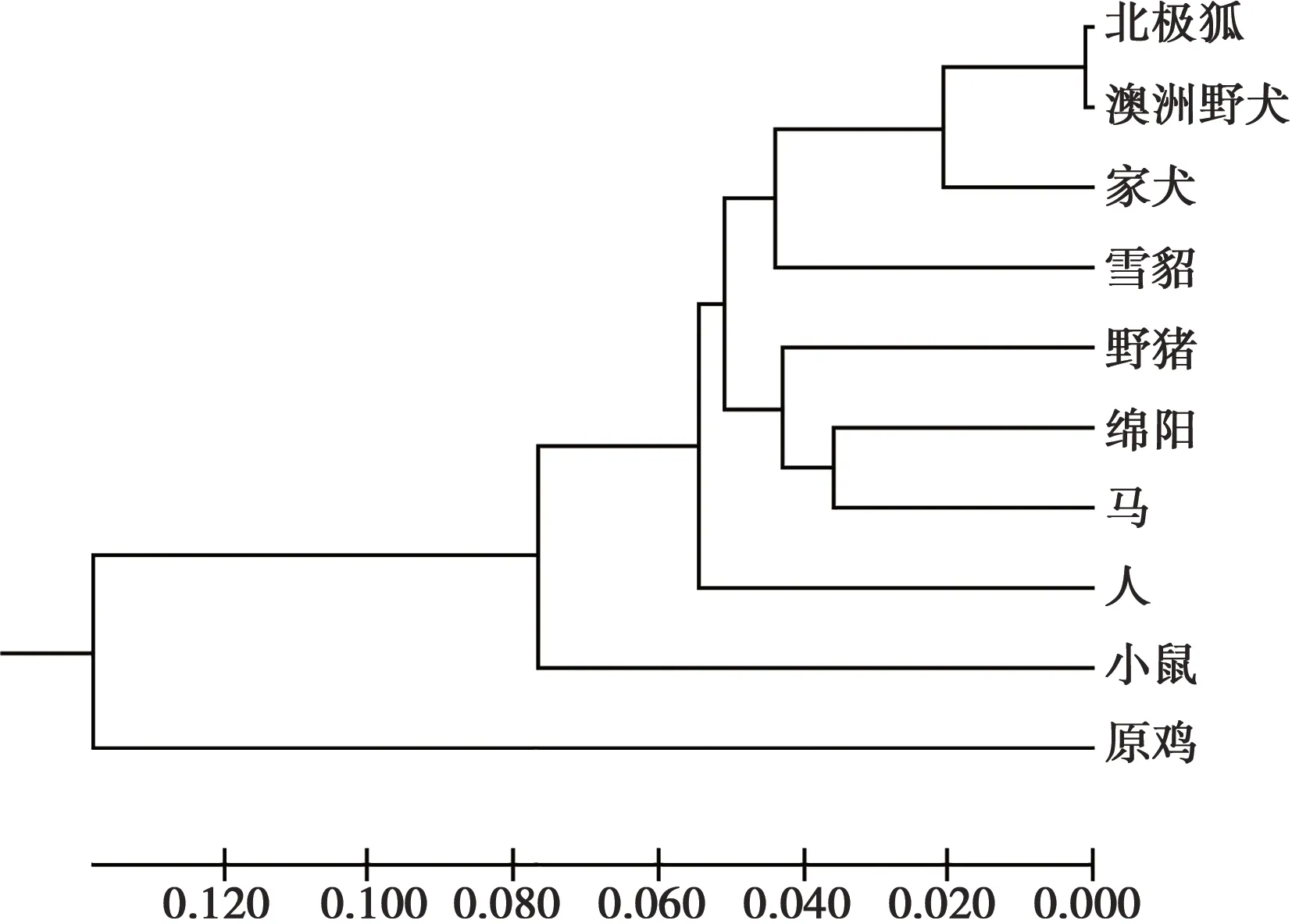
图7 10个物种Wnt3a基因系统发育树
3 讨论
近年来关于Wnt信号通路的研究成为一个热门,其中的Wnt家族是一类富含半胱氨酸的分泌性糖蛋白,目前在人类中已经发现了该家族的成员19种,它们通过与细胞质基质及其特异性受体卷曲蛋白相互作用,激活下游的Wnt信号转导通路[13]。Wnt3a所在的Wnt/β-catenin通路是经典的Wnt信号通路,是目前为止研究最多的Wnt信号通路[14]。Wnt3a除了与黑色素的生成有关外,还与包括癌症在内的许多疾病的病因学和病理学密切相关[15-16]。目前关于Wnt3a基因的结构和功能的研究还未见报道。
本试验通过利用RT-PCR的方法,成功克隆了北极狐Wnt3a基因,并经过测序分析得到了其完整的CDS区序列,其包含1 059个碱基,编码352个氨基酸,其数量与NCBI中家犬和人的Wnt3a蛋白氨基酸含量存在差异。对其理化性质分析发现,该蛋白为碱性且不稳定的亲水性蛋白。对北极狐Wnt3a蛋白的二级结构和三级结构分析发现,其中间存在着大量的无规卷曲,占比达到了51.7%,使得其三级结构呈现出复杂的立体结构。
通过进一步的分析发现,北极狐Wnt3a蛋白属于膜外蛋白,其主要定位于细胞质、细胞核和线粒体中,与已往研究发现的Wnt3a蛋白作为一种分泌蛋白可以调控多种基因表达的说法一致[17]。磷酸化是蛋白质功能调节的重要机制,在蛋白质功能和活力的控制和调节中具有重要作用[18]。北极狐Wnt3a蛋白中存在33个蛋白磷酸化位点超过临界值,说明这些位点可能会成为蛋白激酶磷酸化位点[8]。信号肽序列的作用是把蛋白质引导到细胞含不同膜结构的亚细胞器内[19]。在利用SignalP进行信号肽分析时,C值越高表示剪切位点的可能性越大,Y值最高点常作为最佳剪切位点,S值的低分和高分位置分别表示氨基酸位于成熟蛋白部位和信号肽部位[20]。北极狐Wnt3a蛋白蛋白存在信号肽结构,位于1~19位氨基酸位点,切割位点位于第19个氨基酸处。从同源性和系统发育分析来看,在北极狐与澳洲野犬、家犬、绵羊、人等9个物种的Wnt3a基因序列比较中,同样作为犬科的澳洲野犬和家犬与北极狐亲缘关系较近,且与其他几个哺乳动物的同源性均达到了85%以上,而与卵生动物原鸡亲缘关系最远,但也存在75.2%的同源性,由此说明了Wnt3a基因保守性较好,但是在哺乳动物和卵生动物之间可能存在较大的差异。
综上所述,本研究成功克隆了北极狐Wnt3a基因的CDS区序列,并对其核苷酸和编码氨基酸序列成分、理化性质进行了分析,同时还利用生物信息学的方法对北极狐Wnt3a基因编码蛋白进行了二级结构、三级结构、跨膜结构、亚细胞定位、磷酸化位点、信号肽以及与其他8个物种间同源性和系统发育分析,为今后研究Wnt3a基因及相关通路提供了重要参考。
