禽腺病毒血清4型纤突蛋白1(Fiber 1)多克隆抗体的制备
2020-09-27曹洁刘萌陈雨晴闫丽萍
曹洁,刘萌,陈雨晴,闫丽萍
(教育部动物健康与食品安全国际联合试验室/江苏省动物免疫工程试验室/江苏省陆生野生动物疫源疫病检测中心/南京农业大学免疫研究所/南京农业大学动物医学院,江苏 南京 210095)
禽腺病毒(fowl adenovirus,FAdV)是严重影响养禽业发展的重要病毒之一,依据不同的抗原结构可将FAdV分成3个群,其中Ⅰ群FAdV根据其结构中L1~L4 4个高变环的特点和限制性内切酶片段长度不同可分成5个基因型(A~E),通过血清中和试验可将其划为12个血清型(1~7、8a、8b、9~11)[1]。FAdV自1987年在巴基斯坦首次报道[2],随后蔓延至墨西哥、俄罗斯、日本、韩国、印度、智利、伊拉克、孟加拉国和南美洲等多个国家[3-10]。2012年,韩国Choi等[7]发现FAdV在鸡群中暴发,病原检测主要为FAdV血清4型(FAdV-4)和血清8型(FAdV-8),此外大部分发病鸡伴随其他免疫抑制性疾病。2013年,Kajan等[11]报道了匈牙利东部地区暴发以FAdV-D和FAdV-E为主,并伴随FAdV-B感染的FAdV病,发病鸡群的特征症状主要表现为沙囊糜烂和包涵体肝炎。2015年Zhao等[12]通过病毒的分离鉴定,从患有包涵体肝炎和心包积液综合征的病鸡组织中检测出FAdV-C和FAdV-D,这是有关FAdV在中国地区内流行与传播扩散的首次报道。2015年以来,FAdV-4因其发病率高且既可水平传播又可垂直传播的特点,在中国地区内扩散迅猛并大范围流行[13]。病鸡主要表现为心包淡黄色积液、肝脏肿胀、肺脏水肿并伴有尿酸盐沉积等症状,给我国养禽业带来巨大经济损失[14]。
FAdV是二十面体对称的无囊膜双链DNA病毒,基因组总长度约为45 kb,病毒衣壳主要由3种结构蛋白包括六邻体蛋白(Hexon)、纤突蛋白(Fiber)和五邻体蛋白(Penton base)构成。其中Hexon蛋白是含量最高的结构蛋白,能够有效刺激机体产生中和抗体,与病毒的免疫原性密切相关;Penton base蛋白分布于每个二十面体的顶端,具有类似毒素的活性,可引起宿主细胞的细胞病变现象,在病原体入侵的全过程具有极为重要的功能[15];Fiber蛋白可分为 Fiber 1和Fiber 2,它与病毒中和、细胞受体结合、组织趋向性和毒力的变化有关,Fiber 1和Fiber 2蛋白与Penton base相连伸出[16-17]。Fiber的长短不一,可直接调节宿主细胞表面具有识别和黏附细胞外基质功能的整联蛋白对病毒与细胞相结合的过程,在病原体侵入宿主细胞及与相关特异性蛋白结合等环节发挥重要的调控功能。目前国内研究工作多为针对FAdV的Fiber 2蛋白抗体的制备及检验方法的建立,缺乏对Fiber 1相关抗体的研究。因此,本试验制备了国内C型FAdV-4流行毒株的Fiber 1的多克隆抗体,为研发FAdV-4相关诊断试剂及疫苗提供基础。
1 材料与方法
1.1 材料
1.1.1 细胞、质粒及试验动物
FAdV-4、原核表达载体pCold I、鸡肝癌细胞LMH及大肠杆菌Rosetta(DE3)感受态细胞均为本实验室保存;2月龄体重2.5 kg左右的新西兰大白兔购自南京卡文斯生物技术有限公司。
1.1.2 主要试剂
XhoⅠ和HindⅢ限制性内切酶购自NEB公司;Phanta Max Super-Fidelity DNA polymerase、ClonExpress Ⅱ one step cloning kit均购自诺唯赞生物科技有限公司;弗氏完全佐剂、弗氏不完全佐剂、多聚赖氨酸均购自Sigma公司;异硫氰酸荧光素(FITC)标记的羊抗兔二抗、辣根过氧化物酶(HRP)标记羊抗兔二抗均购自KPL公司;NI-NTA填料购自QIAGEN公司;化学发光(ECL)显色液购自Biosharp公司;高糖DMEM培养基购自Hyclone公司;胎牛血清为Life Technologies公司产品;病毒DNA提取试剂盒购自南京擎科生物有限公司;引物合成以及测序均由上海生工生物工程有限公司完成。
1.2 pCold Ⅰ-Fiber 1原核表达载体的构建和表达纯化
收集病毒培养液上清,用病毒DNA提取试剂盒提取病毒基因组DNA,作为FAdV-4 Fiber 1基因的扩增模板。从NCBI上下载FAdV-4 Fiber 1基因全长,并用Primers 5.0软件根据参考序列(GeneBank登录号:MF595801)设计特异性引物,F:5′-CATATGGAGCTCGGTACCctcgagATGTCGGCCCTAAT-CGCCTCCGCAG-3′(小写字母为XhoⅠ酶切位点),R:5′-AGACTGCAGGTCGACaagcttTTAGGGGCCCGG-AGCATTGTTC-3′(小写字母为HindⅢ酶切位点),扩增得到含同源臂的PCR产物全长1 341 bp。用同源重组酶将PCR产物与XhoⅠ和HindⅢ位点双酶切后的pColdⅠ载体连接,继而转化入DH5α感受态细胞中。涂布于氨苄固体培养基37 ℃ 温箱过夜培养后,挑选单克隆菌株扩大培养然后采用菌液PCR鉴定和测序分析,得到重组阳性质粒,命名为pCold Ⅰ-Fiber 1。将阳性菌接种于含氨苄的LB液体培养基中,活化培养约2 h至菌液呈云雾状,用1 mmol/L IPTG 16 ℃ 过夜诱导或37 ℃ 诱导4 h。然后将培养液12 000 r/min 4 ℃ 离心10 min,用少量PBS吹打重悬菌体,而后进行超声破碎,离心取上清和沉淀。用SDS-PAGE检测目的蛋白在沉淀和上清中的表达情况后,取超声破碎后的包涵体,加入8 mol/L的尿素使其充分溶解,再按照NI-NTA试剂盒说明书将融合蛋白进行纯化,通过SDS-PAGE方法鉴定纯化效果,再将高浓度的纯化蛋白储存于-80 ℃冰箱中备用。
1.3 Fiber 1多克隆抗体的制备
首次免疫时,将上述已验证纯化效果良好的融合蛋白与弗氏完全佐剂1∶1混合,4 ℃ 环境中过夜震荡使蛋白充分混匀乳化,然后对2只新西兰白兔通过背部皮下多点注射的方式进行第1次免疫(1 mg/只)。初免后每隔2周进行加强免疫,使用相同方式将弗氏不完全佐剂与纯化蛋白混匀,充分乳化后进行皮下多点注射(1 mg/只),共加强免疫2次。期间检测ELISA抗体效价达到105以上,即可心脏采血收集血清,作为一抗置于-80 ℃ 保存备用,若抗体效价较低可选择再加强免疫1次。
1.4 ELISA测定抗体效价
将纯化鉴定好的pCold Ⅰ-Fiber 1蛋白作为包被原,用包被液稀释至2 μg/mL,100 μL/孔添加至ELISA板中,置于4 ℃ 过夜或37 ℃ 作用2 h。然后用PBST洗涤3次,拍干酶标板后加入5% 脱脂奶37 ℃ 封闭30 min。再用PBST溶液洗3次,将待检验的兔血清与阴性兔血清分别10倍倍比稀释加入ELISA板中,100 μL/孔,37 ℃ 孵育1 h后用PBST洗涤3次并拍干,用5% 脱脂奶溶液1∶5 000倍稀释辣根过氧化物酶标记的羊抗兔IgG(HRP-YKT)并加至ELISA板中,37 ℃作用45 min。孵育结束后洗涤3次并拍干,避光加入显色液,100 μL/孔,充分反应约10 min后,每孔加入50 μL终止液终止显色。将终止显色的ELISA板放入多功能酶标仪,测量OD450。P作为待检样品值,N作为阴性对照值,当P/N>2.1时待检样品被判定为阳性,否则为阴性。
1.5 Western blot鉴定多抗反应性
将FAdV-4以感染复数(MOI)为0.01接种于LMH细胞中,接毒36 h后收集细胞样品;同时取pCold Ⅰ与pCold Ⅰ-Fiber 1超声破碎前全菌以及破碎后的上清和沉淀菌液加入适量4×的SDS-PAGE 蛋白上样缓冲液煮沸10 min。配制10%的分离胶和5%的浓缩胶,按顺序加样(上样前样品需1 200 r/min 离心5 min)用80 V电压电泳40 min,再调至120 V电压电泳1 h。然后用半干转法将胶转印到硝酸纤维膜素上,转印完成后5%脱脂奶常温封闭1 h,PBST常温振荡洗涤3~5次,每次5 min。然后使用1∶1 000倍稀释的兔抗Fiber 1 的多克隆抗体作为一抗4 ℃ 摇床过夜孵育膜,5%脱脂奶1∶15 000倍稀释HRP-YKT作为二抗 37 ℃ 孵育1 h,PBS洗涤3~5次,每次5 min,后用ECL显色观察结果。
1.6 间接免疫荧光检测多克隆抗体特异性
将LMH细胞平铺于多聚赖氨酸处理后的96孔培养板上,使用含10%胎牛血清的高糖DMEM培养液培养至细胞量约占培养皿的80%时,用无菌PBS洗涤细胞3次。再用无血清培养基将FAdV-4分离株稀释至每孔接毒量为MOI = 0.01,37 ℃ 吸附1.5 h后,弃掉培养液并用2%胎牛血清DMEM培养基代替,随后置于37 ℃ 细胞培养箱中培养36 h。观察到感染细胞回缩变圆,发生明显且典型的细胞病变并脱落时,用4%多聚甲醛溶液常温固定细胞15 min;PBS洗涤3次,然后加Fiber 1兔多抗血清或兔阴性血清,用5%脱脂奶按不同稀释倍数进行稀释,37 ℃ 孵育1.5 h;PBS洗涤3次,加400倍稀释FITC 标记的羊抗兔 IgG,37 ℃ 孵育45 min;PBS洗3次后,每孔加入50 μL PBS溶液,置荧光显微镜下观察结果(注意孵育二抗及显色过程需避光)。
2 结果与分析
2.1 FAdV-4 Fiber 1 基因的扩增
收集接毒的LMH细胞,提取基因组,用设计的带有同源臂的引物进行Fiber 1基因全长的扩增。如图1所示,扩增产物经1%琼脂糖凝胶电泳,在1 341 bp处有单一的扩增条带。带有同源臂的PCR产物与XhoⅠ和HindⅢ双酶切的pCold Ⅰ载体通过同源重组酶连接后,转化入DH5α感受态细胞中,挑取单克隆菌株送公司测序,通过Megalign软件比对测序结果,确定pCold Ⅰ-Fiber 1重组载体构建成功。
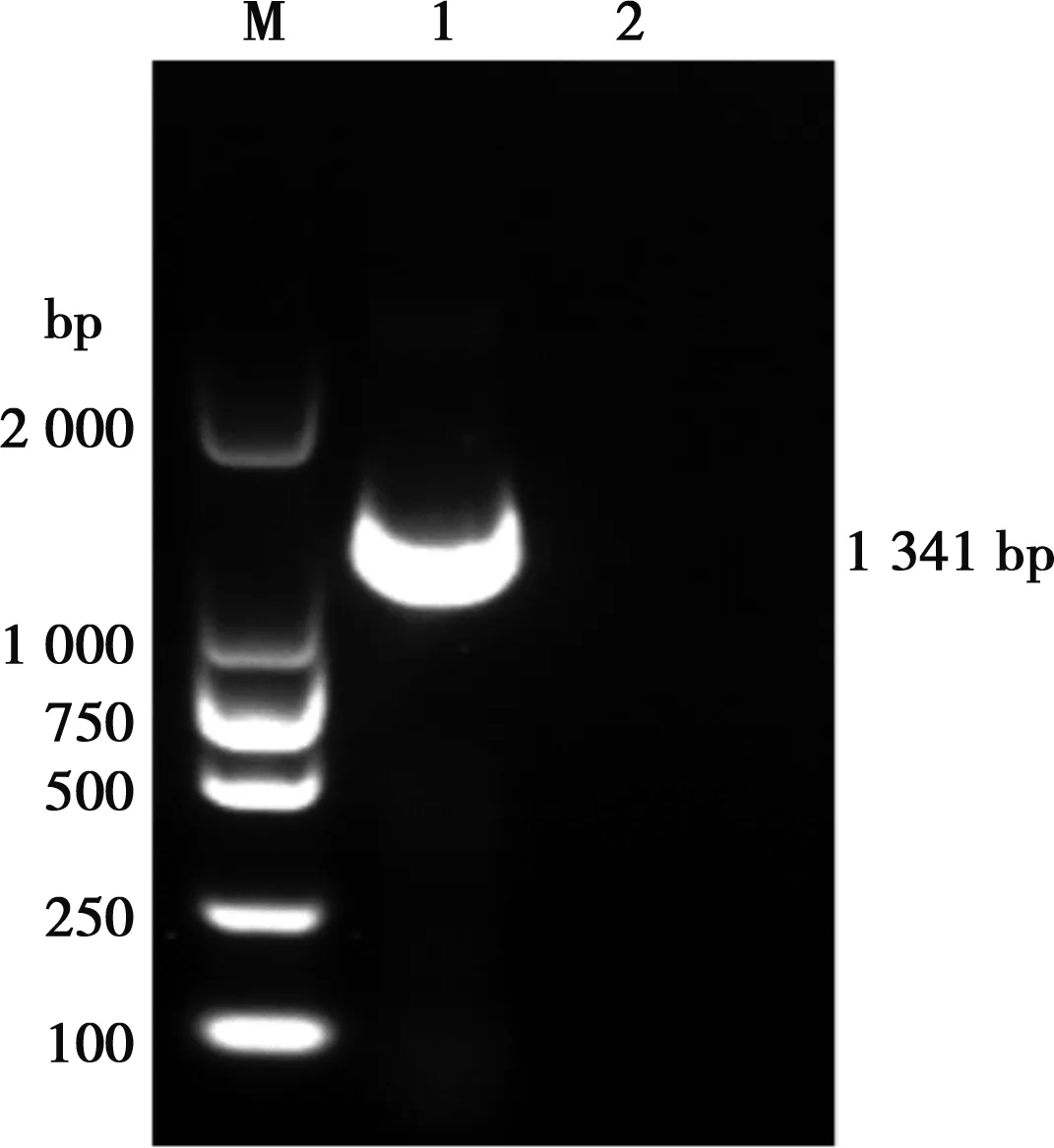
M.DL2000 DNA Maker;1.Fiber 1基因;2.阴性对照
2.2 融合蛋白在Rosetta感受态细胞中的诱导表达及纯化
SDS-PAGE结果表明无论在16 ℃过夜还是37 ℃ 4 h诱导表达条件下,Fiber 1融合蛋白均以包涵体的形式存在,分子质量约53 kDa,与预期大小一致(图2)。采用镍柱纯化重组蛋白,SDS-PAGE结果显示纯化的蛋白条带单一,纯化效果良好(图3)。各管测定蛋白浓度后,取高于0.5 mg/mL的蛋白进行后续的乳化免疫程序。
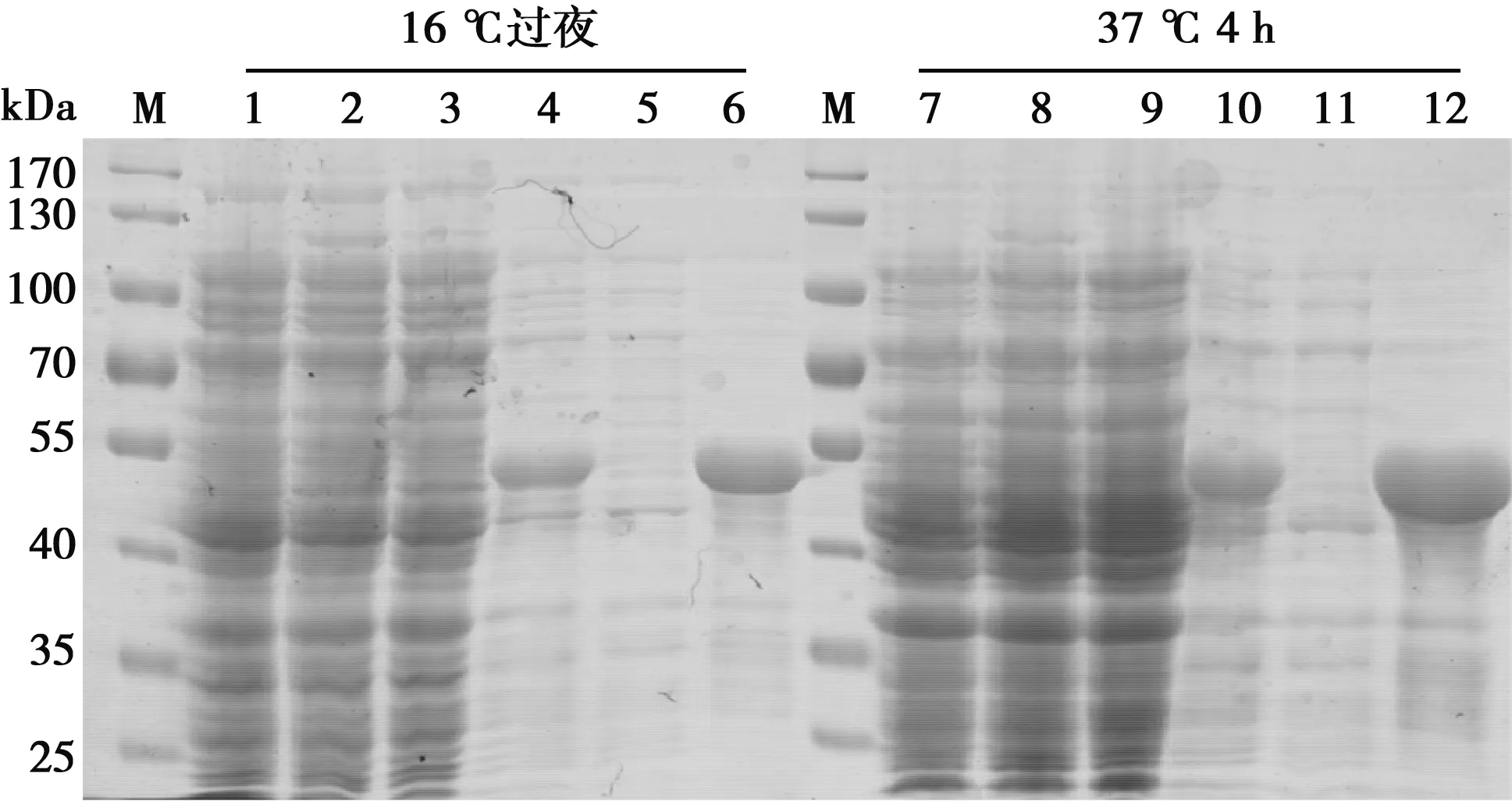
M.蛋白Marker;1、7.pCold Ⅰ诱导前;2、8.pCold Ⅰ诱导后;3、9.pCold Ⅰ-Fiber 1诱导前;4、10.pCold Ⅰ-Fiber 1诱导后全菌;5、11.pCold Ⅰ-Fiber 1诱导上清;6、12.pCold Ⅰ-Fiber 1诱导沉淀

M.蛋白Marker;1~5.16 ℃过夜诱导后表达蛋白纯化的洗脱液;6~10.37 ℃ 4 h诱导表达蛋白纯化的洗脱液
2.3 ELISA检测二免、三免后血清抗体水平
第2次免疫1周内和第3次免疫1周内,分别通过兔耳缘静脉采血方法收集兔血4 mL并分离血清。ELISA检测血清抗体效价,如表1所示,二免后血清抗体效价达到104,故选择继续免疫1次,三免后测得抗体效价达到105以上,心脏采血收集阳性血清。

表1 ELISA检测二免、三免后血清抗体效价水平
2.4 Western blot验证多克隆抗体的反应性
用FAdV-4感染LMH细胞,3 d后细胞产生明显病变时收样,与诱导、未诱导的pCold Ⅰ空载以及重组蛋白pCold Ⅰ-Fiber 1全菌进行Western blot,验证多克隆抗体的特异性。如图4所示,在约53 kDa处Fiber 1多克隆抗体能够与Fiber 1蛋白以及全病毒感染的细胞产生明显的反应,而相同位置的空载对照组无明显条带,说明试验所得的Fiber 1多克隆抗体特异性良好。
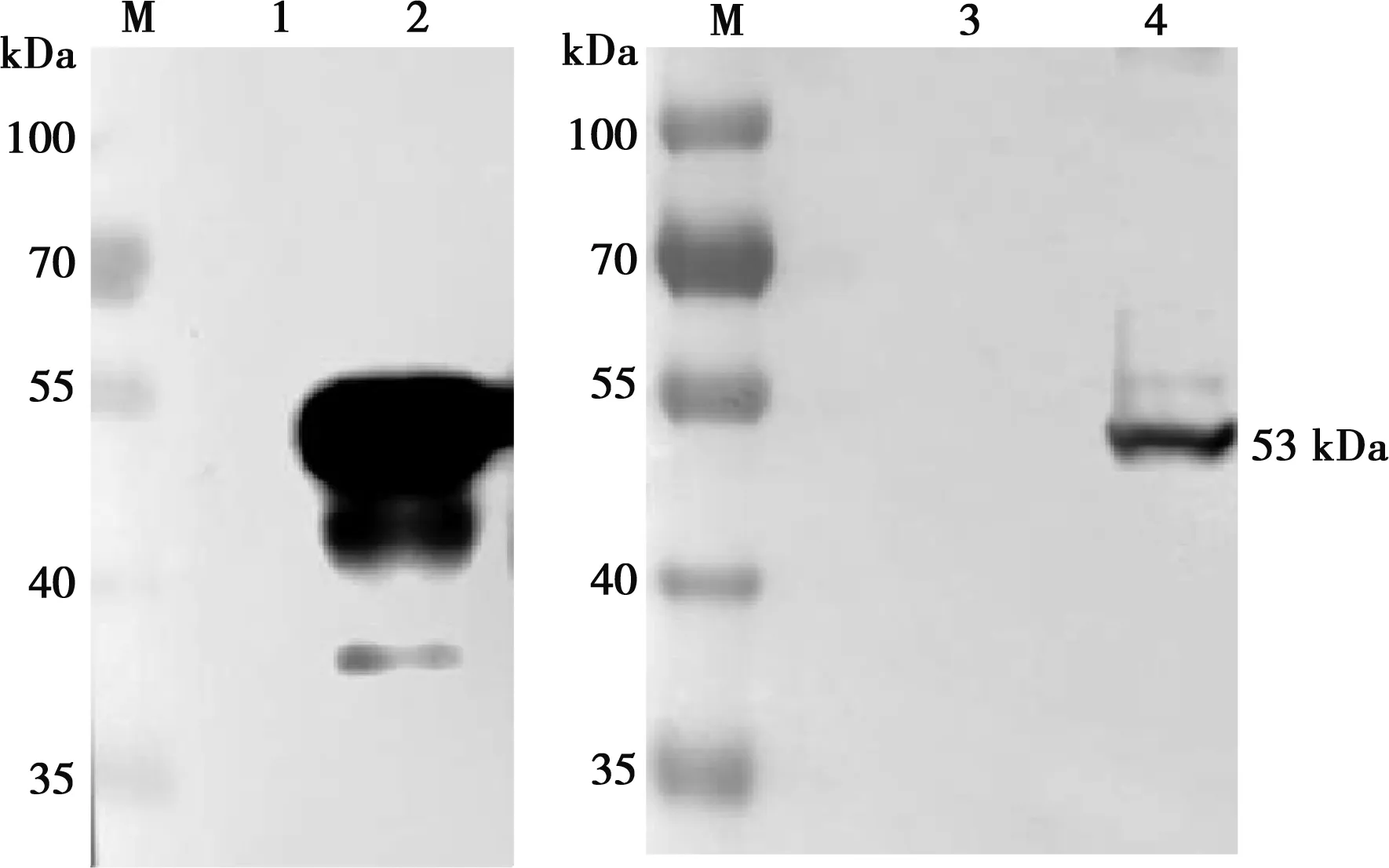
M.蛋白Marker;1.pCold Ⅰ空载体对照;2.pCold Ⅰ-Fiber 1蛋白;3.未感染的LMH细胞;4.FAdV-4感染LMH细胞
2.5 间接免疫荧光鉴定多克隆抗体
FAdV-4感染LMH细胞,用4%多聚甲醛固定细胞板,将Fiber 1多抗血清以及阴性血清按不同比例进行稀释,37 ℃ 孵育1.5 h后,FITC标记的羊抗兔IgG(1∶400倍)二抗37 ℃避光孵育45 min,而后在荧光显微镜下观察。如图5所示,阴性血清1∶200稀释时无非特异性背景,阴性对照成立,Fiber 1多抗阳性血清稀释至1∶3 000时仍可观测到荧光,且特异性良好。

A.一抗1∶200;B.一抗1∶1 500;C.一抗1∶3 000;D.阴性对照1∶200
3 讨论
FAdV-4自2015年在中国暴发以来,迅速扩散至新疆、湖北、河南、山东、黑龙江、江苏、陕西等各个地区[18]。在2015年至2016年在中国各地区显示包涵体肝炎(IBH)和心包积液综合征(HPS)家禽中分离到105株FAdV,FAdV-4感染率高达93%,其中64.8%为FAdV-4单独感染,表明FAdV-4是中国目前造成不同品种鸡高死亡率的优势血清型[19]。Pan等[20]通过序列比对发现,中国分离到的高致病性FAdV-4基因组区域与非致病性毒株相比,存在独特的1 966 bp核苷酸缺失,并在Fiber 1、Fiber 2、Penton和Hexon上也发现多种不同的氨基酸取代。因此,对病毒主要结构蛋白进行深入研究,对了解FAdV-4的流行情况和致病机制具有重要意义。
国内外有关FAdV-4致病机制研究和病原检测以及抗体的制备主要针对Hexon与Fiber 2蛋白。有文献构建和拯救一系列致病或非致病的FAdV-4的嵌合病毒,结果表明Fiber 2与Hexon蛋白可能与病毒毒力密切相关[21]。Steer等[22]通过检测FAdV-Hexon基因P1和L1区域的差异,从而对不同种FAdV进行检测,可精确区分12种FAdV血清型。与此同时,Fiber 2蛋白在原核表达系统中成功表达并纯化,以重组蛋白为基础的间接ELISA等检测方法也成功建立[23]。但目前有关Fiber 1感染病毒的具体作用机制研究较少,相关的快速血清学诊断方法尚未开发。
本研究通过同源重组方法成功构建了pCold Ⅰ-Fiber 1原核表达载体,证实在37和16 ℃条件下Fiber1蛋白均可高效表达在包涵体中。免疫纯化蛋白后的兔血清,ELISA效价达1∶100 000,Western blot检验结果显示该血清抗体既能够识别重组载体pCold Ⅰ-Fiber 1中的Fiber 1 蛋白也可识别FAdV-4全病毒中的Fiber 1蛋白,但原核表达Fiber 1蛋白的大小比全病毒的略大,分析其原因是在Fiber 1的ATG起始密码子前面第69位核苷酸处,pCold Ⅰ载体自身有蛋白表达的起始密码子,所以与FAdV-4病毒中的Fiber 1大小略有不同。为进一步验证Fiber 1多克隆抗体的可靠性,间接免疫荧光检测了FAdV-4全病毒与Fiber 1多克隆抗体的反应,结果发现兔多抗血清稀释3 000倍后依然具有较高的活性,证明制备所得的多克隆抗体反应性与特异性良好。本研究制备的Fiber 1多克隆抗体可为进一步研究FAdV的主要结构蛋白在病毒感染过程中发挥的作用机制提供物质基础。
