痘苗病毒致炎兔皮提取物对脑缺血再灌注脑损伤大鼠凋亡和神经炎症的影响
2020-09-27陈小平王明洋马登磊龚诗立张丽李雅莉李林胡朝英张兰
陈小平,王明洋,马登磊,龚诗立,张丽,李雅莉,李林,胡朝英,张兰
首都医科大学宣武医院药学部,国家老年疾病临床医学研究中心,神经变性病教育部重点实验室,北京市神经药物工程研究中心,北京市100053
缺血性脑卒中是一种复杂的脑血管疾病,是目前危害人类健康的主要疾病之一[1]。中国是脑卒中发病率最高的国家之一[2]。缺血性脑卒中涉及多个病理过程,如炎症反应、细胞凋亡、兴奋性毒性和氧化应激等。其中细胞凋亡导致神经元数量减少,大脑功能受损[3‑4];在脑组织恢复血流灌注时,也将产生过多的活性物质和炎症因子,引发炎症反应,加剧梗死中心损伤,并导致脑缺血再灌注损伤[5‑7]。通过抑制炎症诱导的细胞凋亡,对该病治疗有重要意义。
痘苗病毒致炎兔皮提取物(analgecine,AGC)是从牛痘病毒致炎的日本大耳白兔皮肤提取的一种生物活性制剂,含有多种多肽、氨基酸、核苷酸等物质[8],用于颈肩腕综合征[9]、腰痛[10]、冷感、麻木等症状的缓解和症状性神经痛[11],临床应用已近70 年[12]。最近研究表明,AGC 有抗炎镇痛[12]、神经营养和保护作用[13‑14]。本研究采用Sprague‑Dawley 大鼠大脑中动脉缺血(middle cerebral artery occlusion,MCAO)再灌注模型,探索AGC的治疗作用以及其可能的药理机制。
1 材料与方法
1.1 实验动物
SPF 级Sprague‑Dawley大鼠61只,体质量260~300 g,购自维通利华有限公司,饲养于首都医科大学宣武医院实验动物室屏障楼,室温20~24 ℃,湿度50%~70%,12 h光照,自由进食、进水。
所有操作符合保护动物福利伦理标准。
1.2 主要试剂和仪器
AGC:批号Y20180505,威世药业(如皋)有限公司。MCAO 线栓:西浓公司。热休克蛋白70 (heat shock proteins 70,HSP70)和Bcl‑2 一 抗:ABCAM 公司。Bax 一抗:CST 公司。辣根酶标记山羊抗兔IgG、辣根酶标记山羊抗小鼠IgG、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、离子钙结合蛋白(ion‑ized calcium binding adapter molecule 1,Iba1)、二步法检测试剂盒、一抗山羊血清(货号ZLI‑9021)、DAB 显色试剂盒:北京中杉金桥生物技术有限公司。乙二醇:上海麦克林生化科技有限公司。丙三醇:北京化工厂有限责任公司。
BH‑2光学显微镜: 日本OLYMPUS公司。BS210S 电子天平:北京赛多利斯天平有限公司。CM1950冰冻切片机:德国LECIA公司。
1.3 动物分组、造模和给药
大鼠分为假手术组11 只,假手术给药组11 只,模型组20只和模型给药组19只。
模型组和模型给药组称重后,10%水合氯醛3.3~3.5 ml/kg 腹腔注射麻醉,仰卧位固定,备皮,颈部正中切口,分离右颈总动脉;于颈总动脉分叉处插入线拴至大脑前动脉近端,结扎大脑中动脉,并用黑色记号笔在线栓上标记;固定线栓和颈内动脉,缝合切口。假手术组和假手术给药组分离右颈总动脉后直接缝合切口。
大鼠术后置于放有棉花的鼠笼中保温,1.5 h后拔出线栓,解开结扎手术线。大鼠清醒后出现左侧肢体瘫痪,站立不稳,提尾时向一侧转圈,判定为造模成功。模型组和模型给药组各有2 只造模不成功,予以剔除。
再灌注3 h 后,各给药组尾静脉注射AGC 20 U/kg,假手术组和模型组尾静脉注射等体积生理盐水,以后每天1 次。再灌注48 h 后,每组4 只大鼠取材,其余继续给药至第7天。
1.4 抓握牵引实验[15]
给药第7 天,在距离地面40 cm 左右放置直径1 mm、长60 cm的钢丝绳,钢丝绳下放置泡沫垫避免跌伤。将大鼠前爪置于钢丝绳上,记录松手后至大鼠跌落的时间。评分标准:0 分,无法抓握;1 分,抓握≤10 s;2 分,10 <~20 s;3 分,20 <~30 s;4 分:30 <~60 s;5分,60 <~90 s;6分,90 <~120 s。
1.5 Western blotting
再灌注48 h,每组取4只,同法麻醉,断头取脑。冰上分离左右皮质,冻存管中液氮冻存,储存于-80 ℃冰箱。提取各组皮质缺血半暗带区组织蛋白,BCA 定量,等体积加入5×蛋白上样缓冲液,95 ℃5 min 备用或-20 ℃储存。蛋白样本电泳、电转,5%脱脂奶粉摇床室温封闭1 h,加入HSP70 (1∶1000)、Bcl‑2(1∶1000)、Bax(1∶1000)和β‑actin(1∶2000)一抗,4 ℃过夜。TBST洗3次,加入辣根酶标记山羊抗兔IgG (1∶2000)、辣根酶标记山羊抗小鼠IgG (1∶2000)二抗,室温孵育1 h,TBST 洗3 次。暗室内滴加发光液,化学发光凝胶成像系统扫描并分析目标条带净光密度值,用AlphaView SA 软件计算目的蛋白条带灰度值,并计算与β‑actin的比值。
1.6 免疫组化染色
完成抓握牵引实验后,每组取4 只大鼠,同法麻醉,开胸,完全暴露心脏,注射器针头插入左心室心尖,在心脏右心耳处剪一小口;缓慢推动注射器注入蒸馏水,待右心耳流出的液体不再有血液时,换4%多聚甲醛(pH=7.4)继续灌注至大鼠四肢僵直。开颅取脑,4%多聚甲醛固定,4 ℃暂存;固定24 h后,冰冻切片,厚30 μm,冻存液(0.01 mol/L 磷酸盐缓冲液∶乙二醇∶丙三醇=2∶1∶1)中-20 ℃储存。
取出脑片,置PBS 中平衡30 min,自然冷却至室温,PBS 洗3 遍;3%H2O2室温避光孵育10 min;PBS洗3 遍;滴加10%山羊血清封闭液37 ℃孵育1 h。加GFAP(1∶500)和Iba1 (1∶200)一抗,4 ℃过夜。PBS洗3 遍,滴加试剂2,37 ℃孵育20 min;PBS 洗3 遍,滴加试剂3,37 ℃孵育20 min;PBS 洗3 遍。DAB 显色1 min,自来水终止;裱片,晾干,梯度酒精脱水,二甲苯透明,中性树胶封片。Image‑J 软件计算Iba1和GFAP阳性面积。
1.7 统计学分析
采用GraphPad Prism 8.0 软件进行数据分析。计量资料用()表示,多组间样本比较采用单因素方差分析。显著性水平α=0.05。
2 结果
2.1 抓握牵引实验
与假手术组相比,模型组抓握牵引时间显著降低(P<0.001);与模型组相比,模型给药组抓握牵引时间明显升高(P<0.01)。见表1。
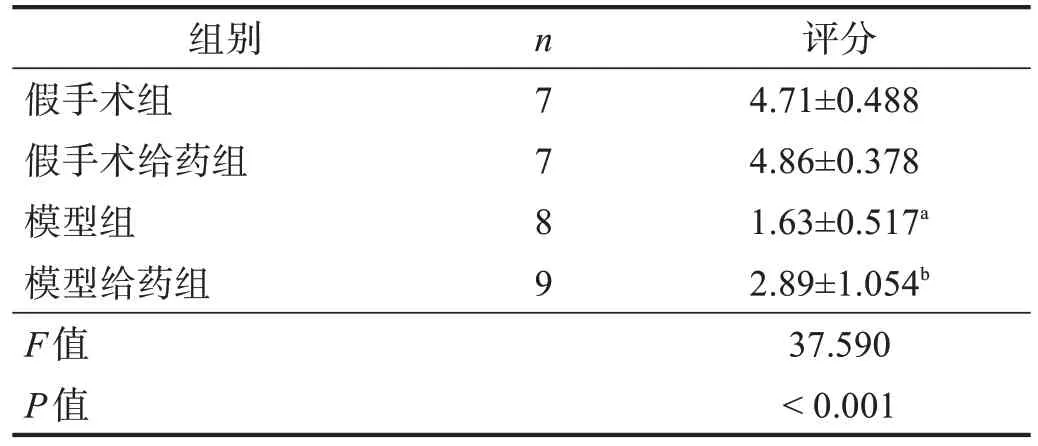
表1 各组抓握牵引实验评分
2.2 Western blotting
模型组HSP70、Bcl‑2 和Bcl‑2/Bax 较假手术组降低(P<0.05),模型给药组较模型组明显升高(P<0.01)。见图1、表2。
2.3 免疫组化染色

图1 各组皮质Western blotting结果
假手术组和假手术给药组星形胶质细胞和小胶质细胞形态正常且分布均匀;模型组星形胶质细胞和小胶质细胞活化明显,且呈团块状分布,Iba1 和GFAP阳性面积显著增加(P<0.001);与模型组相比,模型给药组星形胶质细胞和小胶质细胞活化程度明显降低,GFAP 和Iba1 阳性面积均有所减少(P<0.05)。见图2、图3、表3。
3 讨论
脑缺血再灌注损伤引起细胞凋亡、炎症反应和神经元变性,导致神经功能损伤[16‑17]。凋亡是神经元丢失的主要原因之一,而星形胶质细胞和小胶质细胞在脑缺血缺氧等刺激后被激活。我们前期研究显示[18],脑缺血再灌注损伤后第7 天,星形胶质细胞仍处于激活状态,引发神经炎症。活化的胶质细胞释放大量促炎症因子,进一步激活下游炎症信号通路,导致炎症发生,最终导致脑损伤[19‑21]。
脑缺血再灌注损伤后出现细胞凋亡,大量神经元损伤[22]。Bcl‑2 蛋白家族包括Bax 等促凋亡蛋白和Bcl‑2 等抗凋亡蛋白,二者比例决定细胞在受到凋亡信号刺激后是否发生凋亡[23]。Bcl‑2 通过稳定线粒体膜电位、抑制氧自由基产生、抑制Ca2+内流、阻止p53 基因表达产物进入胞核等多种途径,抑制细胞凋亡发生[24‑26]。再灌注24~48 h时凋亡最严重,是研究抗凋亡药物的理想时段[18]。本研究显示,缺血再灌注损伤后48 h,AGC 能显著增加MCAO 大鼠脑内Bcl‑2 蛋白表达,使Bcl‑2/Bax 比例增高,从而抑制细胞凋亡,减少损伤,维持神经元正常功能。
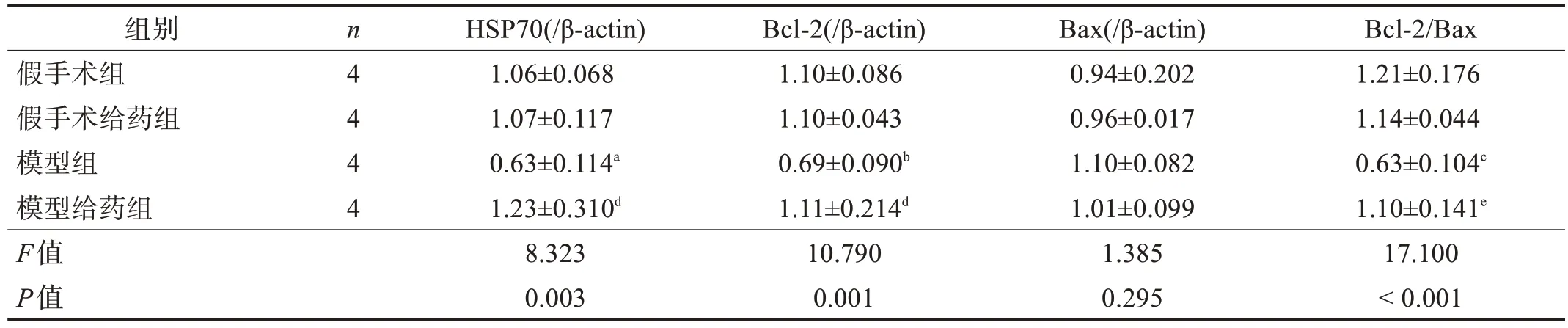
表2 各组HSP70、Bcl-2和Bax表达

图2 各组皮质GFAP表达(免疫组化染色,×200)
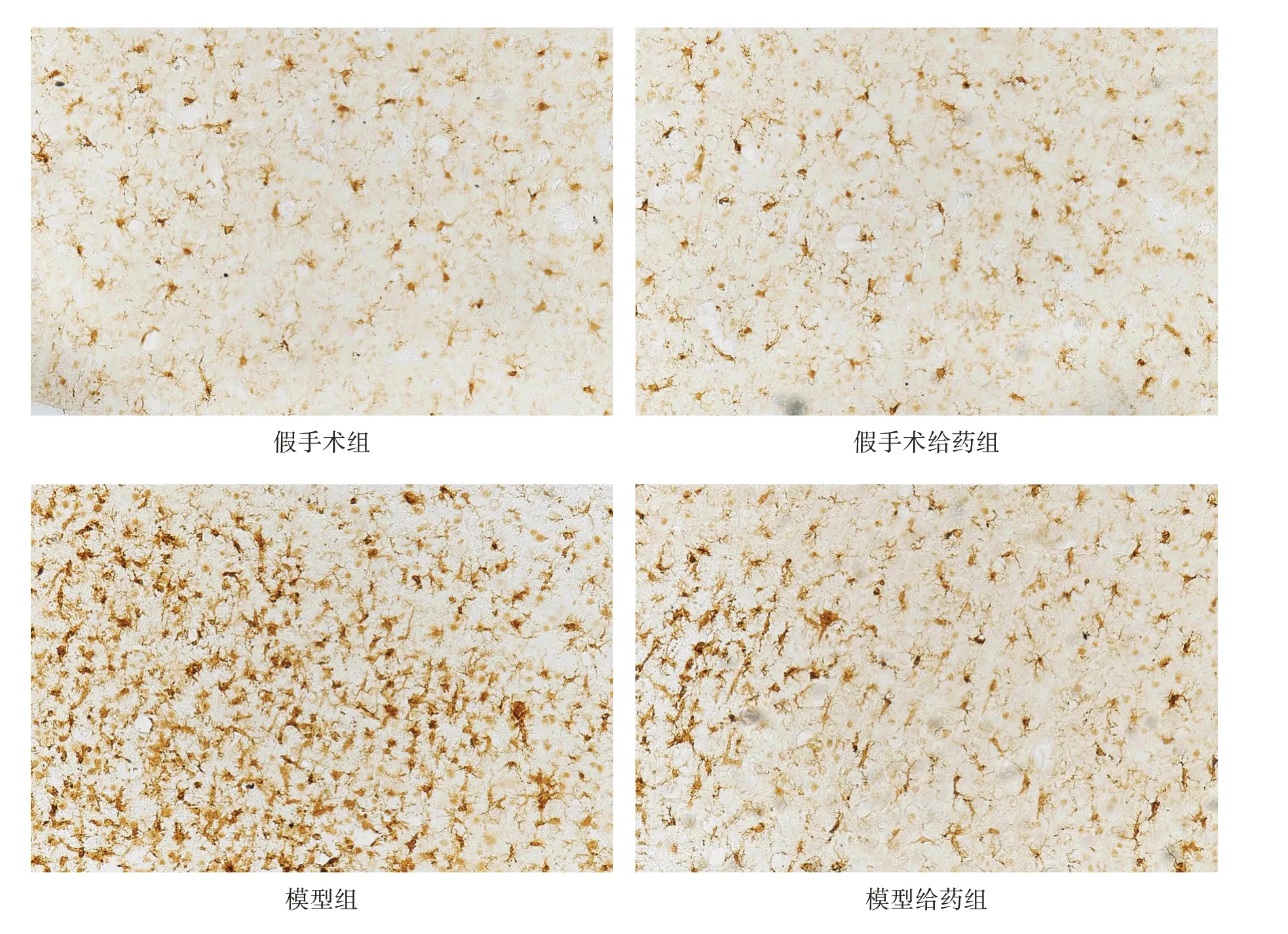
图3 各组皮质Iba1表达(免疫组化染色,×200)
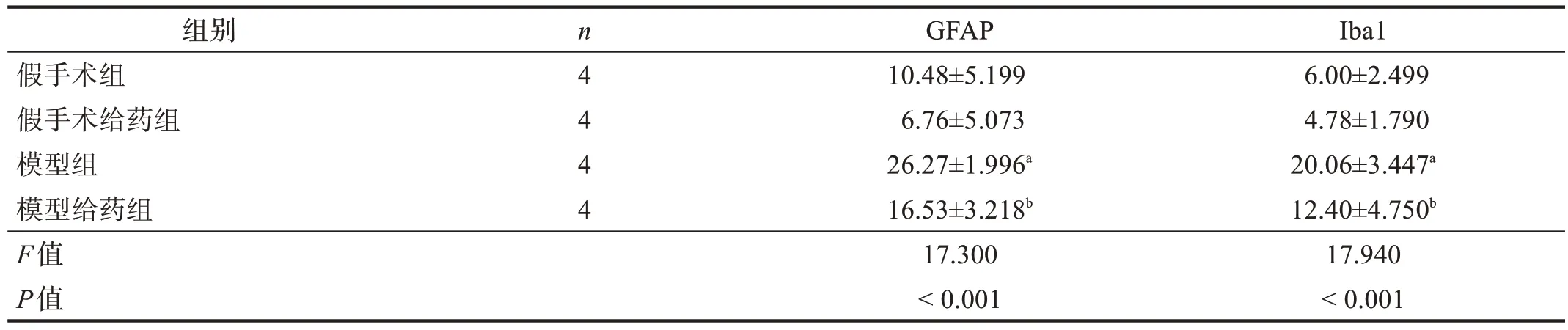
表3 各组GFAP和Iba1阳性面积(%)
HSP70 是一种细胞保护蛋白。细胞受到外源性刺激时,可通过分泌HSP70,提高细胞抵抗力[27]。HSP70 还可增加Bcl‑2 的表达,对缺血性脑损伤起保护作用[28‑29]。本研究显示,AGC 能促进MCAO 大鼠HSP70 分泌,抵抗脑损伤;还可通过调控Bcl‑2 蛋白的表达,间接抑制细胞凋亡。
Iba1 是小胶质细胞标记物。小胶质细胞活化释放许多细胞因子、补体和炎性介质[30]。GFAP 在星形胶质细胞特异性表达[31]。在脑缺血后,活化的小胶质细胞诱导神经毒性反应性星形胶质细胞活化,引发神经炎症,导致神经损伤,引起神经元死亡[19,32]。星形胶质细胞和小胶质细胞活化后,释放细胞因子,活化单核巨噬细胞,对神经元有较强的细胞毒性,使神经元细胞凋亡机制不可逆启动,从而加重脑缺血区损伤[33‑34]。本研究显示,AGC 可通过抑制星形胶质细胞和小胶质细胞活化,抑制脑缺血再灌注后炎症反应,进一步减少脑损伤。
综上所述,本研究显示,AGC可促进脑缺血再灌注大鼠运动功能恢复,对缺血再灌注损伤有较好的保护作用,可能涉及抑制细胞凋亡和神经炎症。AGC对星形胶质细胞和小胶质细胞活化的抑制作用,为进一步研究AGC抗炎作用机制提供基础。
利益冲突声明:所有作者声明不存在利益冲突。
