甲醇与一氧化碳制芳烃反应机理
2020-09-27贺振富
贺振富
(国家能源集团公司,北京 100011)
芳烃是聚酯工业的重要化工原料。随着我国聚酯工业高速发展,芳烃消费量快速增长,供应缺口逐年加大。目前,芳烃主要来自石油加工工业,煤制芳烃新技术开发对我国聚酯工业的健康发展及降低原油对外依存度意义重大。甲醇是煤化工的主要产物之一,甲醇制芳烃(MTA)是煤制芳烃技术的主要途径。
近年来,MTA技术的研究主要集中在催化剂对该反应性能影响[1-9]和MTA反应机理[10-21]方面。张一成等[10]和邹琥等[11]认为,MTA反应机理与MTO/MTH类似,ZSM-5负载金属或金属/非金属氧化物形成L酸,能增加催化剂脱氢和芳构化性能。Dessau等[12]基于碳正离子机理提出了芳烃生成机理:CH3+与烯烃反应生成更高价的碳正离子;C6+脱氢环化生成苯;CH3+与苯反应能生成甲苯和二甲苯。Dahl和Kolboe[13-14]提出“烃池”机理认为,甲醇在催化剂上首先形成大相对分子质量的烃类物质并吸附在催化剂孔道内作为活性中心。其不断与甲醇反应引入甲基基团,同时不断进行脱烷基化反应,生成乙烯和丙烯等低碳烯烃。Song等[15]认为,在MTA过程中,甲醇生成乙烯、丙烯后再进行低聚缩合反应可形成苯环。刘艳等[16]认为,MTA是典型B酸作用下酸催化反应,反应包括:甲醇脱水生成二甲醚,甲醇或二甲醚脱水生成烯烃,烯烃转化为芳烃和烷烃。Keil[17]认为,甲醇芳构化技术是在择形分子筛催化剂作用下的酸催化反应,反应主要包括3步:甲醇脱水生成二甲醚;甲醇或二甲醚脱水生成烯烃;烯烃经过聚合、烷基化、裂解、异构化、环化、氢转移等过程转化为芳烃和烷烃。时旭等[18]认为醇芳构化机理为:短链醇脱水得到醚和低碳烯烃,低碳烯烃聚合得到长链烯烃(长链醇可直接脱水得到长链烯烃),长链烯烃环化反应生成环烷烃,环烷烃脱氢芳构化或分子间氢转移得到芳烃。
Zhang等[19]认为,催化剂酸密度会影响芳构化、脱烷基化、烷基化和异构化过程;降低其酸密度可优先抑制脱烷基化反应,同时也抑制芳构化和异构化反应。Gao等[20]进行了Ga改性ZSM-5沸石催化MTA研究。结果表明,在反应过程中产生的C5和C6环烯烃可生成芳烃前体环状碳正离子。同位素实验表明:环状碳正离子在Ga/ZSM-5上的反应活性远高于在H-ZSM-5上的;环状碳正离子在芳族化合物形成中起过渡作用。除了传统的氢转移(HT)反应外,烯烃脱氢与H2释放(DeaH2)过程能显著促进芳族化合物形成。烯烃脱氢能促进DeaH2过程,并与Ga/ZSM-5上的氢转移过程竞争,促进环烯烃向芳烃转化。
近期,Chen等[21]发现,甲醇与CO能在 H-ZSM-5 分子筛上发生耦合反应,芳烃选择性约80%。因而开发了甲醇与CO直接反应制芳烃新技术:煤气化得到的CO与H2不完全合成甲醇,而是其中部分CO与H2合成甲醇,然后甲醇再与CO反应合成芳烃。新技术降低了甲醇合成和CO变换制氢负荷,缩短了工艺流程,减少了设备投资和运维成本,要优于现有的煤制合成气→合成气制甲醇→甲醇制芳烃技术。该研究采用13C核磁与同位素示踪等手段研究甲醇与CO的反应机理,结果表明CO分子中的C原子能进入芳烃及环戊烯酮类反应中间体中。据此提出了全新芳构化机理:甲醇与CO在H-ZSM-5上发生羰基化反应生成羰基化中间体,然后与烯烃反应生成环戊烯酮类中间体,经脱水得到芳烃。但该研究未解释甲醇与CO制芳烃反应机理本质。
笔者利用杂化轨道理论和关于含Si、Al元素催化剂酸中心研究方面的认识,研究甲醇、CO分子与B酸中心之间相互作用,揭示甲醇与CO制芳烃反应机理本质,为甲醇与CO反应制芳烃催化材料的设计和提高催化反应的转化率及选择性提供参考。
1 B酸中心形成[22-23]
图1为4配位B酸中心失活与再生分析。图1(a)是Al、O原子外层sp3杂化轨道和H原子s轨道。1个Al原子、4个O原子和1个H原子组成4配位B酸中心HAlO4,结构如图1(b)。HAlO4释放H+后失活,形成失活B酸中心AlO4-,如图1(c)所示。失活的B酸中心获得H+后可恢复活性。
2 甲醇与CO制芳烃反应机理
甲醇与CO在H-ZSM-5分子筛B酸作用下生成低碳芳烃,反应方程式如下:
9CH3OH+3CO→2C6H6+12H2O
(1)
11CH3OH+3CO→2C6H5-CH3+14H2O
(2)
13CH3OH+3CO→2C6H5-C2H5+16H2O
(3)
13CH3OH+3CO→2C6H4-(CH3)2+16H2O
(4)
15CH3OH+3CO→2C6H3-(CH3)3+18H2O
(5)
文献[22-23]认为,H-ZSM-5分子筛活性来源于其酸性;分子筛的酸性与其Al原子的O原子配位数密切相关。2、3配位Al原子形成L酸中心;4、5或6配位Al原子形成B酸中心。
2.1 CH3+和C↑↓〇H2生成分析[24-25]
图2为H+攻击甲醇分子C-O键生成甲基碳正离子CH3+过程分析。图2(a)是C、O原子外层sp3杂化轨道和H原子s轨道;1个C原子、1个 O原子和4个H原子组成甲醇分子,如图2(b)所示;B酸中心释放H+攻击甲醇C-O键,形成C、H、O原子共用1对电子结构,见图2(c)。
电负性表示2个不同原子间形成化学键时吸引共用电子的能力。C、H和O原子的电负性分别为2.55、2.20和3.44。B酸中心释放H+攻击甲醇分子中的C-O键。C-O键断裂有2种可能性:H+和含C原子基团结合生成CH4; H+和含O原子基团结合生成H2O。由于O原子电负性大于C原子的,所以含O原子基团会吸引共用电子对并与H+结合生成H2O,见图2(d);而含C原子基团生成了甲基碳正离子CH3+,在CH3+中C原子外层有1个空轨道,如图2(e)所示。
图3为CH3+与失活B酸中心作用生成H-form C↑↓〇H2过程示意图。反应体系中存在失活4配位B酸中心AlO4-和CH3+(图3(a)),当CH3+中C原子外层空轨道与失活B酸中心Al、O原子重叠轨道发生重叠时(图3(b)),H+从CH3+转移到相邻Al、O和C原子重叠轨道上,形成C、H、O和Al原子共用1对电子结构,如图3(c)所示。C、H、O和Al原子电负性分别为2.55、2.20、3.44和1.61。Al、O原子吸引共用电子对能力大于C原子,所以Al、O原子吸引共用电子对并与H+结合生成HAlO4,使失活的B酸中心恢复活性,见图3(d)。CH3+失去H+后生成中间体C↑↓〇H2,C↑↓〇H2中C原子外层有1对孤对电子和1个空轨道,如图3(e)所示。
2.2 中间体C↑↓〇H2与CO反应
图4为CO分子外层电子轨道结构分析。C原子2s22p2杂化轨道和O原子2s22p4杂化轨道(图4(a))中各有2个未成键电子,未成键电子相结合形成2个共价键。同时,O原子2p轨道上孤对电子进入到C原子2p空轨道形成1个配位键,形成CO分子,结构式C≡O,如图4(b)所示。

图3 CH3+与失活B酸中心作用生成H-form C↑↓〇H2

图4 CO外层电子轨道结构分析
图5为C↑↓〇H2与CO相互作用过程。图5(a)中的3个C↑↓〇H2中空轨道与CO中3个C、O原子重叠轨道发生重叠,重叠时C、O原子进行sp3杂化各形成4个sp3杂化轨道,见图5(b);同时,H+从C↑↓〇H2中转移到C、O和C三原子轨道重叠处形成图5(c)结构。C与H+结合生成CH;中间体C↑↓〇H2也转化为CH,从而形成4个CH。其中,3-CH和4-CH重叠处H+再次转移到相邻4-CH轨道上形成图5(d)结构。

图5 CO与C↑↓〇H2反应生成中间体C↑↓↑〇H和C↑,↑↑H
图5(d)中,O原子吸引共用电子对能力大于C原子,而获得共用电子对生成H2O,剩余部分4-CH 为缺电子结构,与1-CH、2-CH和3-CH共用电子对形成图5(f)结构。图5(f)中,4个C共用3对电子,其吸引电子能力相同,从而每个C原子可从共用电子对中获得1个电子,结果1-CH、2-CH 和3-CH形成了3个C↑↓↑〇H结构中间体(图5(g));4-CH形成了C↑,↑↑H结构中间体(图5(h))。在C↑↓↑〇H结构中,C原子外层有1对孤对电子、1个未成键电子和1个空轨道;在C↑,↑↑H结构中,C原子外层有3个未成键电子。其中,↑,↓表示2个未成键电子、↑↓表示孤对电子、↑表示未成键电子、〇表示空轨道。
2.3 苯的生成
中间体C↑↓↑〇H和C↑,↑↑H都可以生成苯环,但形成的方式不同。图6为C↑↓↑〇H构成苯环的方式。由图6可知,6个C↑↓↑〇H(图6(a))相结合,C↑↓↑〇H中的孤对电子占据相邻C↑↓↑〇H中空轨道,形成六元环结构(图6(b));6个C↑↓↑〇H中未成键电子共同形成1个大π键,进而形成苯环,如图6(c)所示。
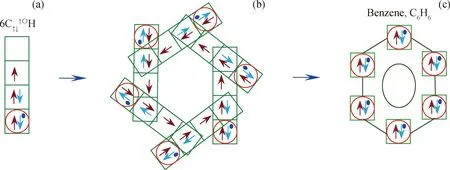
图6 6个C↑↓↑〇H形成苯环结构
图7为C↑,↑↑H形成苯环过程。图7(a)中的6个C↑,↑↑H相结合,C↑,↑↑H中的2个未成键电子分别与相邻的2个C↑,↑↑H中的1个未成键电子成键形成六元环结构,如图7(b)所示;其第3个未成键电子共同形成1个大π键,进而形成苯环结构,如图7(c)所示。

图7 6个C↑,↑↑H形成苯环结构
2.4 甲苯、乙苯的生成
图8为苯和C↑↓〇H2生成甲苯过程。由中间体形成的苯环结构与1个C↑↓〇H2结合,C↑↓〇H2中空轨道与苯环上C、H原子重叠轨道发生重叠,形成图8(b)结构;重叠处H+从苯环向C↑↓〇H2转移,并与其孤对电子成键,生成甲苯 C6H5-CH3,如图8(c)所示。
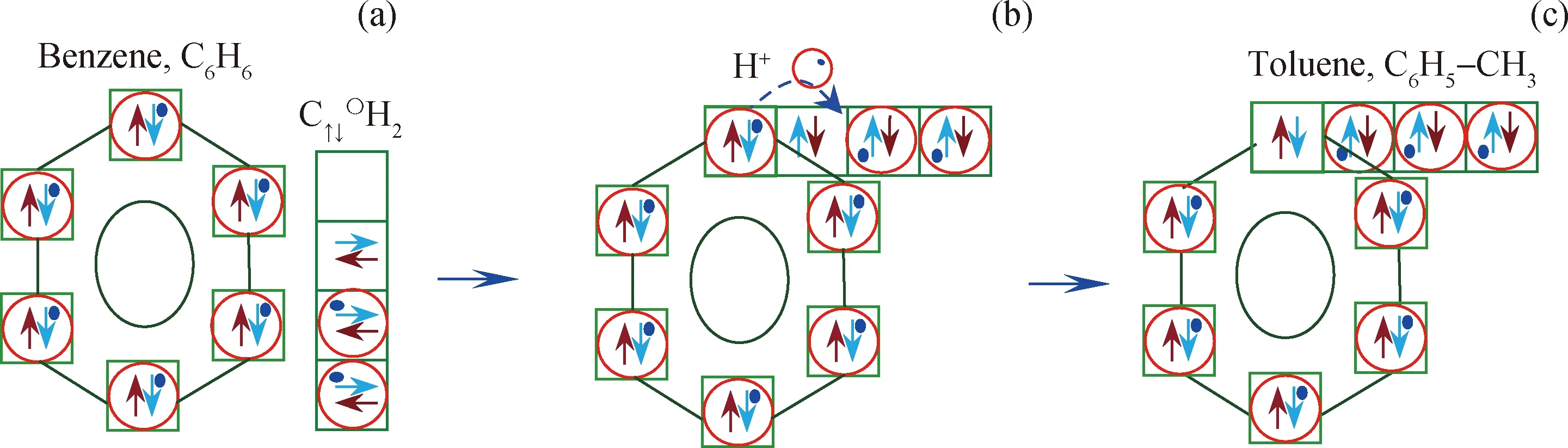
图8 苯和C↑↓〇H2生成甲苯
图9为甲苯和C↑↓〇H2生成乙苯过程。甲苯与C↑↓〇H2结合,C↑↓〇H2中空轨道与甲苯甲基位置C、H原子重叠轨道发生重叠,形成图9(b)结构;重叠处H+从甲基向C↑↓〇H2转移,并与其孤对电子成键,形成乙苯C6H5-C2H5,如图9(c)所示。

图9 甲苯和C↑↓〇H2生成乙苯
2.5 苯与C↑↓〇H2生成二甲苯
图10为苯与C↑↓〇H2生成邻二甲苯过程。苯和2个C↑↓〇H2结合,2个C↑↓〇H2中空轨道分别在苯环相邻位置与苯环C、H原子重叠轨道发生重叠,形成图10(b) 结构;重叠处的H+从苯环向C↑↓〇H2转移,并与其孤对电子成键,生成邻二甲苯C6H4-(CH3)2,结构如图10(c)。同理,上述过程发生在苯环间位位置或对位位置上,可生成间二甲苯或对二甲苯。
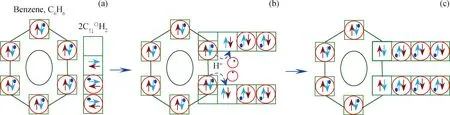
图10 苯C↑↓〇H2与生成邻二甲苯
2.6 苯与C↑↓〇H2生成多甲基苯
图11为苯与C↑↓〇H2生成1,3,5-三甲基苯过程分析。苯和3个C↑↓〇H2结合,3个C↑↓〇H2中空轨道分别在苯环1,3,5位置上与苯环上C、H原子重叠轨道发生重叠,形成图11(b) 结构;重叠处H+从苯环向C↑↓〇H2转移,并与其孤对电子成键,形成1,3,5-三甲基苯C6H3-(CH3)3,如图11(c)所示。同理,苯与4个、5个或6个 C↑↓〇H2结合可以生成四甲基苯、五甲基苯或六甲基苯。
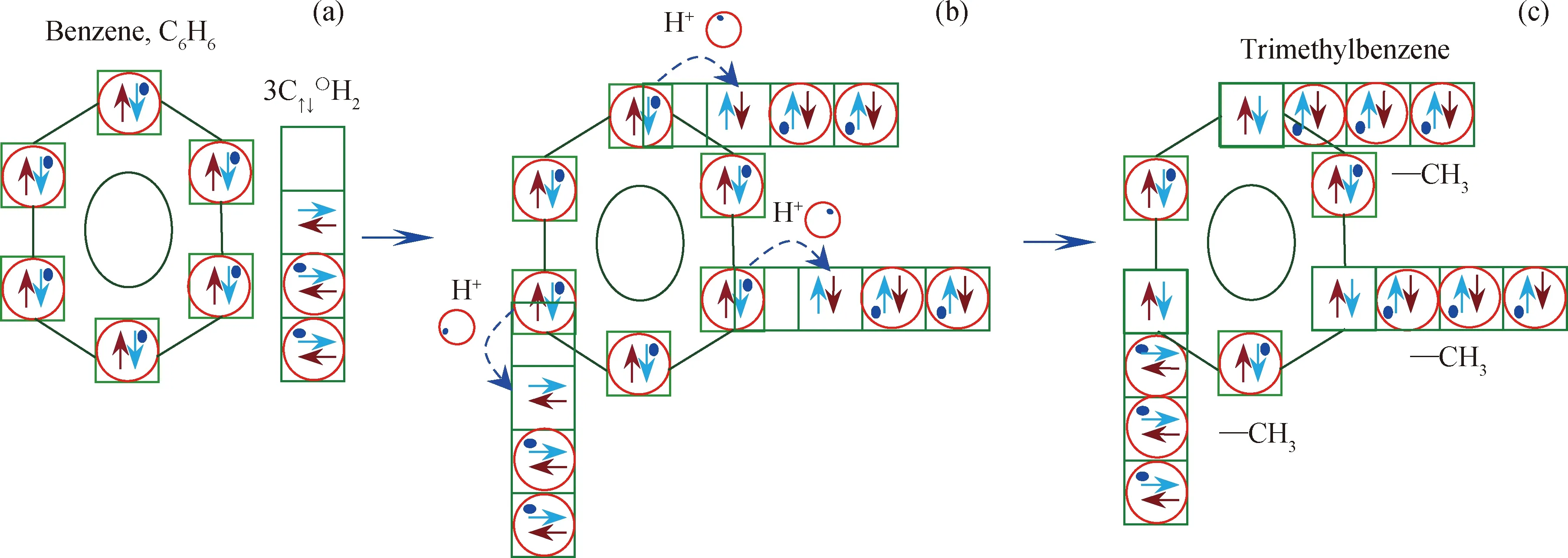
图11 苯与C↑↓〇H2生成1,3,5-三甲基苯
按照上面分析,甲醇在4配位B酸中心HAlO4作用下生成芳烃反应机理概括如下:
第1步

(6)
第2步

(7)
第3步 3C↑↓〇H2+CO→3C↑↓↑〇H+
C↑,↑↑H+H2O
(8)
第4步

(9)

(10)
第5步
反应式[(6)×18+(7)×18+(8)×6+(9)×3+(10)]÷2得反应方程(1),即反应生成苯。
反应式[(6)×22+(7)×22+(8)×6+(9)×3+(10)+(11)×4]÷2得到反应方程(2),即反应生成甲苯。
反应式[(6)×26+(7)×26+(8)×6+(9)×3+(10)+(11)×4+(12)×4]÷2得反应方程(3),即反应生成乙苯。
反应式[(6)×26+(7)×26+(8)×6+(9)×3+(10)+(13)×4]÷2得反应方程(4),即反应生成邻二甲苯、间二甲苯和对二甲苯。
反应式[(6)×30+(7)×30+(8)×6+(9)×3+(10)+(14)×4]÷2得反应方程(5),即反应生成1,3,5-三甲基苯。同理,生成四甲基苯、五甲基苯和六甲基苯的过程与生成三甲基苯的相同。
依次类推,在5配位或者6配位B酸中心上发生反应过程与在4配位B酸中心上相同,因而甲醇与CO在B酸中心上反应生成低碳芳烃反应机理相同。
3 结 论
在B酸酸中心作用下,甲醇与CO制芳烃反应过程可分5步:
(1)B酸中心释放H+攻击甲醇分子C-O键,C-O键断裂生成CH3+和H2O,B酸中心失活;
(2)失活的B酸中心从CH3+获H+后恢复活性,CH3+失去H+反应生成中间体C↑↓〇H2,C↑↓〇H2结构中C原子外层有1对孤对电子和1个空轨道;
(3)C↑↓〇H2与CO反应生成中间体C↑↓↑〇H、C↑,↑↑H和H2O,C↑↓↑〇H结构中C原子外层有 1对孤对电子、1个未成键电子和1个空轨道,C↑,↑↑H结构中C原子外层有3个未成键电子;
(4)苯环构成有二种方法,第一种方法是由6个C↑↓↑〇H形成苯环结构,第二种方法是由6个C↑,↑↑H 形成苯环结构;
(5)C↑↓〇H2中空轨道与苯环或甲基上C、H原子重叠轨道再次重叠并发生H+转移反应,可以生成甲苯、乙苯、邻二甲苯、间二甲苯和对二甲苯,以及三甲基苯、四甲基苯、五甲基苯和六甲基苯。
