N-甲基咪唑氟硼酸盐基低共熔溶剂的制备及其氧化脱硫性能
2020-09-27刘昊然陈思宇李秀萍赵荣祥
刘昊然,陈思宇,李秀萍,赵荣祥,毛 微
(辽宁石油化工大学 化学化工与环境学部,辽宁 抚顺 113001)
燃烧含硫燃料会造成阴霾天气和酸雨[1]。随着环境法规的日益严格,生产超低硫的燃料油已成为炼油行业迫切需要解决的问题[2]。加氢脱硫技术(HDS)作为一种成熟的脱硫工艺,已在世界范围内得到了广泛的应用。然而,加氢脱硫需要高压、高温、大量的氢和高活性加氢催化剂[3]。同时,由于受到空间位阻效应的影响,在常规条件下加氢脱硫技术很难实现对噻吩类等芳香族有机硫化物的高效去除[4]。为了克服加氢脱硫的缺陷,许多非加氢脱硫技术(NHDS),如萃取脱硫、吸附脱硫、光催化脱硫和氧化脱硫[5-9]等获得了广泛的关注。由于氧化脱硫工艺具有不消耗氢气、反应条件温和及对于芳香族硫化物高脱除率等优点,因此被视为最有发展前景的技术之一。离子液体(ILs)是一种具有较低蒸气压的低温熔盐,可以作为绿色溶剂来代替传统的挥发性有机溶剂[10-11]。到目前为止,许多学者都致力于设计复杂的ILs,以提高燃料的脱硫效率[12-14]。虽然ILs由于其独特的物理化学性质似乎是一种理想的萃取剂,但是其存在生物降解性低、成本较高、合成过程复杂等缺点,阻碍了其工业应用[15]。
为了克服ILs的缺点,在21世纪初出现了新一代溶剂,称为低共熔溶剂(DESs)[16]。DESs是由两种或两种以上成分通过氢键作用组成的共熔混合物,具有与离子液体相似的特性,其突出的优点是价格低廉,可生物降解,且不需要纯化[17]。近年来,越来越多的学者将低共熔溶剂应用到油品的深度脱硫中。Hao等[18]合成了L-脯氨酸/对甲苯磺酸型低共熔溶剂并将其应用于氧化脱硫,在最佳条件下,L-脯氨酸/对甲苯磺酸对二苯并噻吩的去除率达到99%。Lü等[19]制备了TBAC/2C2H2O4型低共熔溶剂,并研究了其氧化脱硫性能,最佳条件下,油品脱硫率达到了98%。侯良培等[20]以甲基咪唑盐酸盐和草酸为原料,合成了[HMIM]Cl/H2C2O4型低共熔溶剂并将其应用于氧化脱硫,在反应温度为40 ℃、反应时间为140 min的条件下,油品脱硫率可以达到92.2%。Chen等[21]用[Hnmp]Cl/ZnCl2型低共熔溶剂作为催化剂应用于柴油的氧化脱硫,最佳条件下柴油的脱硫率高达99.9%。Mao等[22]以ChCl/1.5CF3SO3H(CF3SO3H和ChCl的摩尔比为1.5)为催化剂和萃取剂,H2O2为氧化剂,研究了模型油的氧化脱硫性能,最佳条件下,模型油的脱硫率达到了98.65%。由此可见,低共熔溶剂对油品的深度脱硫展现了优良的效果,进一步开发此类低共熔溶剂具有重要的意义。
[HMIM]BF4是一种常规的离子液体,Lu等[23]考察了其氧化脱硫活性,在氧化脱硫过程中,其担当了催化剂和萃取剂的双重作用。结果表明,该离子液体只有在较高的反应温度(90 ℃)和较高的氧/硫摩尔比(n(H2O2)/n(S)=10)条件下才表现出强的氧化脱硫活性。笔者所在课题组先前的工作中,以苯丙酸为氢键的供体,以氯化锌为氢键的受体,合成了一种苯丙酸型低共熔溶剂。研究表明,该低共熔溶剂具有较好的氧化脱硫活性[24]。
笔者以N-甲基咪唑氟硼酸盐([HMIM]BF4)和苯丙酸(C9H10O2)作为氢键配体,通过简单加热合成了一系列[HMIM]BF4/C9H10O2型酸性低共熔溶剂。将该酸性低共熔溶剂作为萃取剂和催化剂、双氧水作为氧化剂,组成萃取-氧化脱硫系统,并将其应用于脱除模拟油中硫化物。分别考察了n(C9H10O2)/n([HMIM]BF4)、反应温度、n(H2O2)/n(S)、低共熔溶剂的加入量和不同含硫化合物对脱硫率的影响和催化剂的回收利用,并探讨了萃取-氧化脱硫反应的机理。
1 实验部分
1.1 试剂及仪器
N-甲基咪唑(质量分数98%),浙江凯乐化工厂产品;氟硼酸(质量分数40%)、苯丙酸(质量分数98.5%)、正辛烷(质量分数98%),国药集团化学试剂有限公司产品;四氯化碳(质量分数99%),天津市大茂化学试剂厂产品;二苯并噻吩(DBT,质量分数98%)、苯并噻吩(BT,质量分数97%)、4,6-二甲基二苯并噻吩(4,6-DMDBT,质量分数99%),阿拉丁试剂有限公司产品;H2O2(质量分数30%),辽宁泉瑞试剂有限公司产品。
微库仑综合分析仪(WK-2D),江苏江分电分析仪器有限公司产品;傅里叶变换红外光谱仪(FT-IR,NEXUS 870),美国尼高力仪器公司产品;AV-400型核磁共振仪(CH3OD为溶剂,TMS为内标),德国Bruker公司产品;旋转蒸发器(RE-52),巩义市予华仪器有限责任公司产品。
1.2 [HMIM]BF4/C9H10O2型低共熔溶剂的合成
[HMIM]BF4/C9H10O2型低共熔溶剂的合成过程如下:首先称量等摩尔的N-甲基咪唑和氟硼酸,将氟硼酸逐滴加入N-甲基咪唑中,搅拌均匀,然后将混合液置于60 ℃水浴锅中磁力搅拌1 h,用旋转蒸发仪将混合液中的水分蒸出,最后得到的淡黄色黏稠液体即为[HMIM]BF4。将C9H10O2和[HMIM]BF4分别按照摩尔比0.5、1和2置于 100 mL 烧杯中,在90 ℃下加热搅拌至完全熔融状态,最终得到[HMIM]BF4/xC9H10O2(x=0.5、1、2)型低共熔溶剂。图1为[HMIM]BF4/C9H10O2的合成路线。
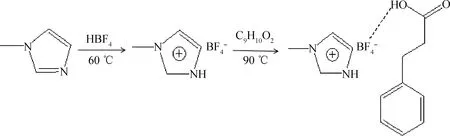
图1 [HMIM]BF4/C9H10O2的合成
1.3 氧化脱硫过程
将一定量的DBT、4,6-DMDBT、BT分别溶入到体积均为500 mL的正辛烷中,配制成硫质量分数均为500 μg/g的模拟油。分别将5 mL模拟油、一定量的低共熔溶剂和H2O2加入到100 mL三角瓶中,然后将其与冷凝装置连接,保证密封良好,在一定温度的水浴和磁力搅拌的条件下进行氧化脱硫反应。总反应时间为180 min,每隔20 min吸取少量上层的油相作为待测样品。利用WK-2D微库仑综合分析仪测定其硫含量,按式(1)计算脱硫率η。
η=[(w0-wt)/w0]×100%
(1)
式(1)中,w0和wt为反应前、反应后油品中硫的质量分数,%;η为油品中硫化物的脱除率,%。
1.4 催化剂的回收
在氧化脱硫实验完成后,利用倾倒法将上层油相与下层的DESs相分离。然后用等体积的CCl4对DESs相进行2次反萃取,采用旋转蒸发仪将残留在低共熔溶剂相中的CCl4蒸出,得到的淡黄色黏稠液体即是回收的DESs。将模拟油、H2O2和回收的DESs加入到100 mL锥形瓶中,在最优的条件下进行氧化脱硫循环实验。
2 结果与讨论
2.1 低共熔溶剂的表征结果
2.1.1 红外分析和1H NMR分析
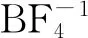
图2 低共熔溶剂(DESs)的FTIR谱图和1H NMR谱图
为了进一步确定[HMIM]BF4和C9H10O2之间是否形成了氢键,分别对[HMIM]BF4、C9H10O2和[HMIM]BF4/0.5C9H10O2进行了1H NMR分析,结果如图2(b)所示。由图2(b)可知:C9H10O2在化学位移7.22、2.93和2.69处存在3个氢峰;[HMIM]BF4在化学位移8.58、7.40、4.69和3.90处存在4个相对较强的氢峰;在[HMIM]BF4和C9H10O2形成低共熔溶剂后,相比于[HMIM]BF4和C9H10O2,在化学位移4.69处的氢峰未发生移动,其他位置均发生了轻微的移动。由此可以证明[HMIM]BF4和C9H10O2之间产生了氢键作用[27]。
2.1.2 热重分析
为了探究低共熔溶剂的热稳定性,分别对C9H10O2、[HMIM]BF4和[HMIM]BF4/0.5C9H10O2进行热重分析(TGA),结果如图3所示。由图3可以看出,在温度达到100 ℃时,C9H10O2几乎没有质量损失,而[HMIM]BF4和[HMIM]BF4/0.5C9H10O2略有损失,分别为4.4%和3.5%。这可能是因为[HMIM]BF4和[HMIM]BF4/0.5C9H10O2中所含有的少量的水蒸发造成的。同时发现,在温度低于158 ℃时,[HMIM]BF4/0.5C9H10O2的热稳定性略好于[HMIM]BF4,可能是因为[HMIM]BF4与C9H10O2之间形成的氢键提高了其热稳定性[28]。当温度高于158 ℃时,C9H10O2、[HMIM]BF4和[HMIM]BF4/0.5C9H10O2的质量损失速率逐渐提高。对于氧化脱硫反应,一般反应温度均小于100 ℃,[HMIM]BF4/0.5C9H10O2在此温度范围具有较好的热稳定性,因此适用于氧化脱硫反应。
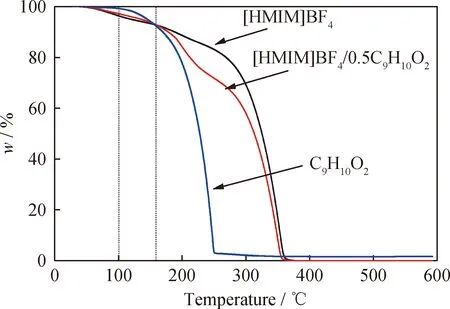
图3 低共熔溶剂的热重分析图
2.2 低共熔溶剂的酸度对DBT脱除率的影响
合成的一系列[HMIM]BF4/C9H10O2型低共熔溶剂中C9H10O2与[HMIM]BF4的摩尔比(n(C9H10O2)/n([HMIM]BF4))决定着DESs的酸度,对其氧化脱硫性能有着显著的影响。以[HMIM]BF4离子液体作为对比,探讨C9H10O2的加入量对催化剂脱除DBT性能的影响,结果如图4所示。由图4看到,当仅加入[HMIM]BF4离子液体作为催化剂时油品的脱硫率比较低,反应 180 min 时仅为20%。当n(C9H10O2)/n([HMIM]BF4)为0.5时,反应180 min,油品的脱硫率可迅速升至84.8%。这表明[HMIM]BF4与C9H10O2混合而成的低共熔溶剂具有较好的脱硫性能。然而,当n(C9H10O2)/n([HMIM]BF4)分别为1和2时,反应180 min油品的脱硫率却分别降到82%和75%。这可能是因为随着C9H10O2量的不断增加,导致催化剂的酸性过强,加快了H2O2的分解反应,抑制了氧化脱硫的进行,从而降低了油品的脱硫率[29]。因此,下面将选择[HMIM]BF4/0.5C9H10O2作为最佳低共熔溶剂进行讨论。
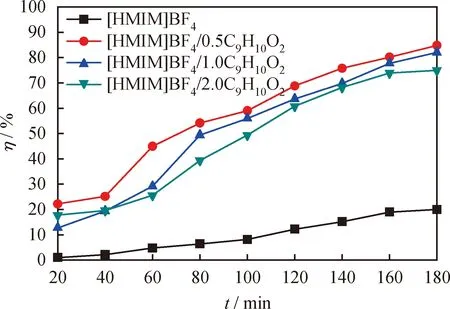
图4 不同酸度的低共熔溶剂[HMIM]BF4/xC9H10O2(x=0.5、1、2)对DBT的脱除率(η)随反应时间的变化曲线
2.3 氧化脱硫反应中影响油品脱硫率的主要因素
2.3.1 温度的影响
图5为不同反应温度下[HMIM]BF4/0.5C9H10O2对DBT的脱除率随反应时间的变化曲线。由图5可知,[HMIM]BF4/0.5C9H10O2在不同温度下对DBT的脱除率存在较大差异。当温度从40 ℃升到60 ℃时,反应180 min时DBT的脱除率由13%增加到82.8%。这是因为低共熔溶剂的黏度随着温度的升高而降低,黏度降低会增加系统的传质速率,从而提高了系统的脱硫率[30],此外,从热力学角度分析,提高反应温度也可增加氧化脱硫反应速率。然而,当温度继续升高到70 ℃,反应180 min时油品的脱硫率却降到72.4%。这是因为H2O2在氧化脱硫过程中既有氧化反应也有分解反应,这是两个相互竞争的反应,较高的温度会增加H2O2的分解,从而降低了油品的脱硫率[18]。综上所述,选择 60 ℃ 作为最佳的反应温度。
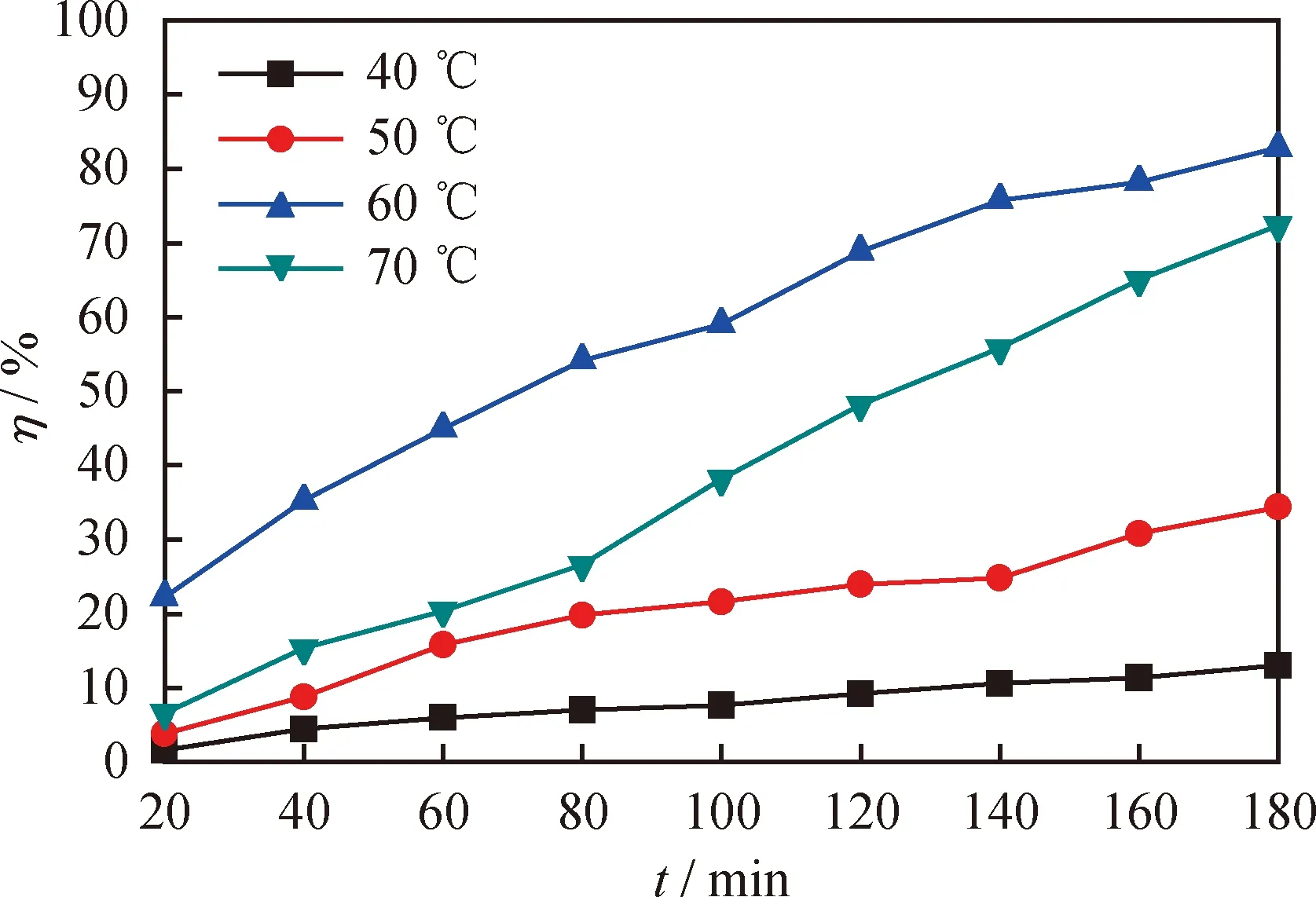
图5 不同反应温度下[HMIM]BF4/0.5C9H10O2对DBT的脱硫率(η)随反应时间的变化曲线
2.3.2n(H2O2)/n(S)的影响
在氧化脱硫反应中,H2O2作为氧化剂,其加入量直接影响氧化脱硫的效果。不同n(H2O2)/n(S)对体系脱硫率的影响见表1。由表1可知,当n(H2O2)/n(S)为0时,模拟油的脱硫率仅为9.6%,这是因为此时反应体系中仅有模拟油和低共熔溶剂,属于萃取脱硫系统,脱硫效果较差。当n(H2O2)/n(S)从2增加到8时,模拟油的脱硫率从52.6%增至98.4%,脱硫效果改善明显。这是因为在氧化脱硫反应中,随着H2O2用量的不断增加,H2O2会持续地促进过氧化物的生成,从而促进了氧化脱硫反应的进行[31]。当继续增加n(H2O2)/n(S)到10时,模拟油的脱硫率下降到88.6%。这是因为随着H2O2的持续增加,体系中的水也会持续增加,水的存在会抑制氧化脱硫反应的进行,从而导致了模拟油的脱硫率降低[32]。因此,最适宜的n(H2O2)/n(S)为8。
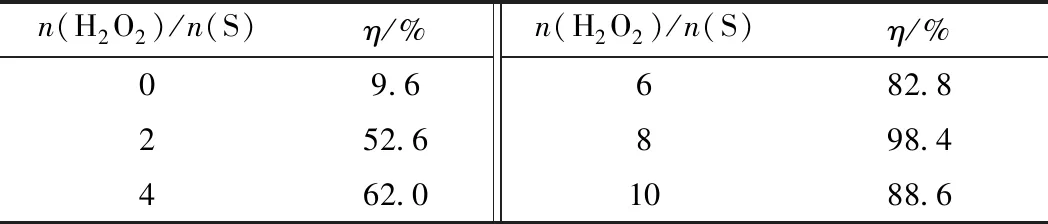
表1 不同n(H2O2)/n(S)下[HMIM]BF4/0.5C9H10O2对DBT的脱除率(η)
2.3.3 [HMIM]BF4/0.5C9H10O2加入量的影响
低共熔溶剂的加入量是影响氧化脱硫效果的重要因素之一,考察了[HMIM]BF4/0.5C9H10O2加入量分别为0.5、1.0、1.5和2.0 mL的条件下对DBT的氧化脱硫效果对比,结果见图6。从图6可以看出,当[HMIM]BF4/0.5C9H10O2的加入量由0.5 mL升高到1.0 mL时,反应180 min,对应模型油的氧化脱硫率由57.2%升高到98.4%。这是因为随着[HMIM]BF4/0.5C9H10O2加入量的不断增加,导致系统的萃取能力不断提高,有利于将油相的DBT萃取到DESs相中,从而使更多的DBT参与氧化反应,提高了系统的氧化脱硫效率[33]。然而,当继续增加[HMIM]BF4/0.5C9H10O2的加入量到1.5 mL和2.0 mL时,反应180 min,模型油氧化脱硫率分别降到90.6%和86.8%。这是因为在H2O2加入量恒定的条件下,持续增加 [HMIM]BF4/0.5C9H10O2的加入量会不断地将DBT萃取到DESs相中,导致DESs相中的n(H2O2)/n(S)相应降低,从而导致DBT的脱除率降低[34]。综合考虑,[HMIM]BF4/0.5C9H10O2的最佳加入量为1.0 mL。
2.3.4 不同硫化物的影响
由于实际油品中所含有的硫化物较为复杂,因此考察了[HMIM]BF4/0.5C9H10O2对不同硫化物的脱除效果,结果见图7。由图7可知,[HMIM]BF4/0.5C9H10O2对DBT、4,6-DMDBT和BT的脱除率有所差异,反应180 min时分别为98.4%、93%、89.6%。这主要是因为不同硫化物上S原子的电子云密度各不相同,4,6-DMDBT、DBT、BT上S原子的电子云密度分别为5.760、5.758、5.739,电子云密度越大则活性越高,越有利于硫化物的脱除[35]。然而,[HMIM]BF4/0.5C9H10O2对DBT的脱除率却高于对4,6-DMDBT的,主要是因为4,6-DMDBT苯环上的2个甲基增加了其空间位阻,降低了S原子的活性,从而增大了氧化脱硫难度[36]。
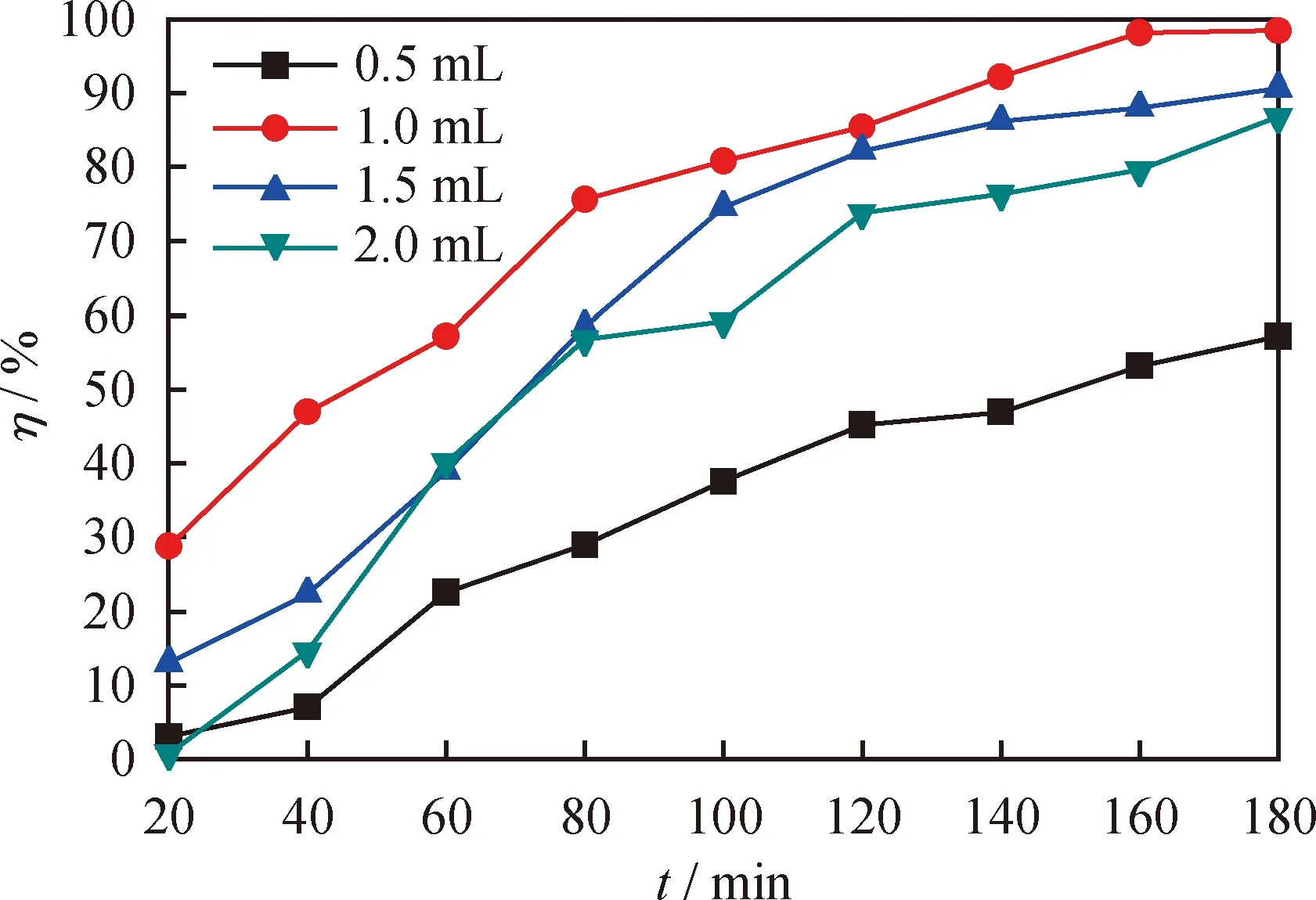
图6 不同[HMIM]BF4/0.5C9H10O2加入量对DBT的脱除率(η)随反应时间的变化曲线
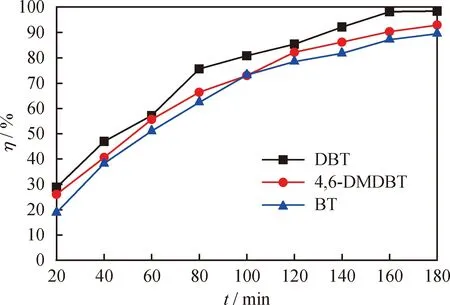
图7 [HMIM]BF4/0.5C9H10O2对不同硫化物的脱除率(η)随反应时间的变化曲线
2.4 不同硫化物脱除的动力学研究
研究表明,氧化脱硫过程符合伪一级动力学方程[37]。因此,可以用一级动力学方程式(2)进行模拟计算。
ln(w0/wt)=kt
(2)
式(2)中,k为反应速率常数,min-1;t为反应时间,min。
图8为不同硫化物氧化脱除的动力学分析。由图8可知,DBT、4,6-DMDBT、BT的动力学方程相关系数R2分别为0.97、0.99、0.99,均大于0.95,线性相关性良好,符合理论要求。不同硫化物对应的反应速率常数k分别为kDBT=0.017 min-1、k4,6-DMDBT=0.014 min-1、kBT=0.012 min-1,即kDBT>k4,6-DMDBT>kBT。由于斜率越大,反应速率越高,因此DBT最容易被氧化脱除,4,6-DMDBT次之,BT最差。这与实验结果[HMIM]BF4/0.5C9H10O2低共熔溶剂对DBT、4,6-DMDBT、BT的脱除率排序(98.4%>93%>89.6%)一致。
2.5 氧化脱除DBT的表观活化能
在化学反应中,活化能代表发生反应所需要的最低能量,其大小代表着反应进行的难易程度。通过一级动力学方程和Arrhenius方程[38]模拟计算氧化脱除DBT的活化能,结果如图9所示。由图9(a)可知,当反应温度分别为40、50、60 ℃时,反应速率常数分别为0.0007、0.0022、0.0470。根据Arrhenius方程式(3)计算[HMIM]BF4/0.5C9H10O2低共熔溶剂氧化脱除模拟油中DBT所需的活化能(Ea)。
(3)
式(3)中,R为摩尔气体常数,kJ/(mol·K);T为热力学温度,K;k为反应速率常数,min-1;A为指数前因子,min-1;Ea为表观活化能,kJ/mol。由图9(b)可见,在该萃取-氧化脱硫体系下脱除DBT的表观活化能Ea=11.4 kJ/mol。较小的活化能表明低共熔溶剂具有较强的氧化脱硫活性。
2.6 [HMIM]BF4/ 0.5C9H10O2的回收利用
催化剂的回收利用可以作为衡量其稳定性的重要指标。表2为低共熔溶剂的循环使用对脱硫率的影响。由表2可知,[HMIM]BF4/0.5C9H10O2低共熔溶剂循环使用5次后,其脱硫率下降到90.2%。这可能是因为在回收[HMIM]BF4/0.5C9H10O2的过程中积累了二苯并噻吩砜等杂质,同时,[HMIM]BF4/0.5C9H10O2在回收过程中会有部分损失,从而导致了脱硫率的下降[39]。
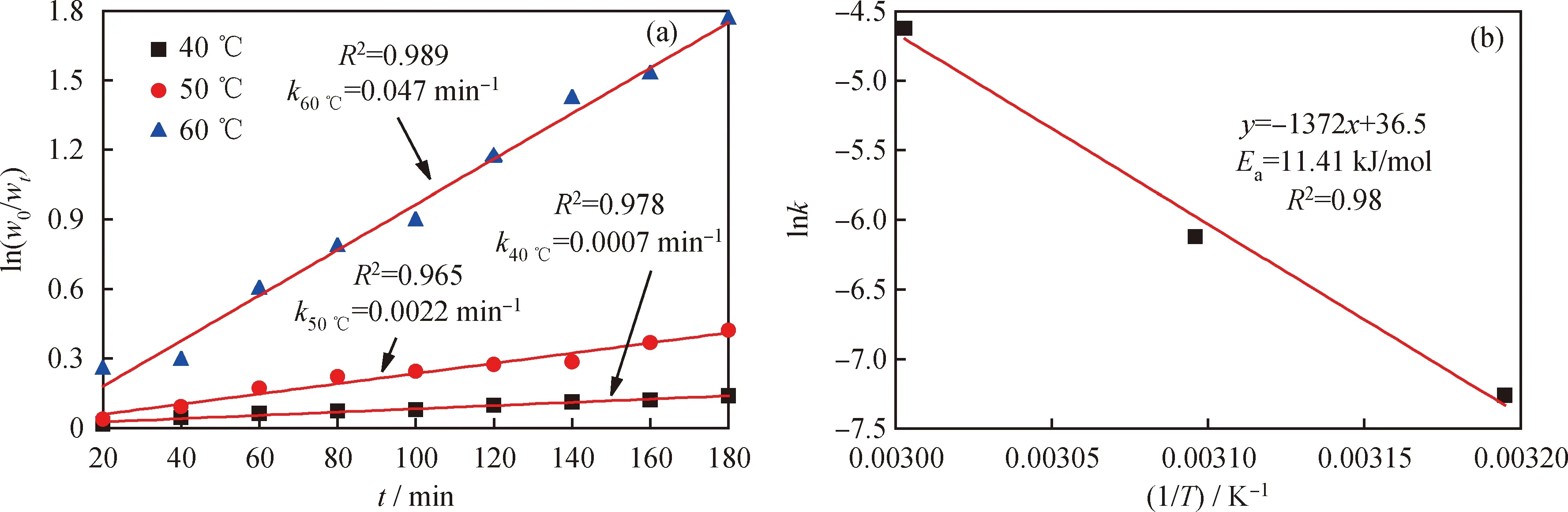
图9 低共熔溶剂[HMIM]BF4/0.5C9H10O2氧化脱除模拟油中DBT的一级动力学反应模型和所需的表观活化能
2.7 DBT氧化产物的红外表征
为了进一步探究氧化脱硫反应中氧化产物的形式,分别对DBT及其氧化产物进行红外表征,结果如图10所示。由图10可以看出,相比于DBT的红外谱图,氧化产物分别在1292、1166和1045 cm-1处形成了DBTO2(二苯并噻吩砜)和DBTO(二苯并噻吩亚砜)的特征吸收峰[40]。这说明在此萃取-氧化脱硫体系中,DBT被氧化成了DBTO2和DBTO。
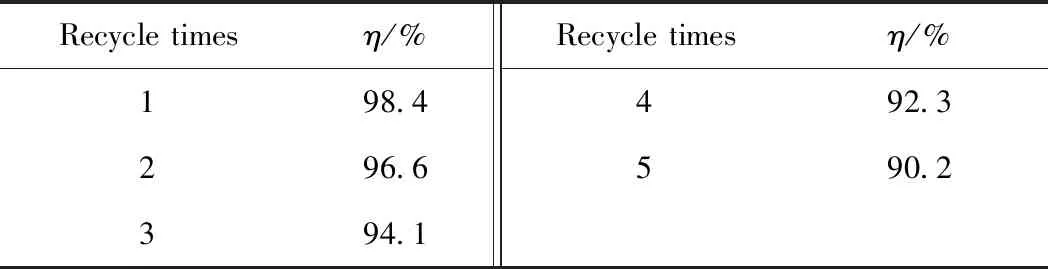
表2 低共熔溶剂[HMIM]BF4/0.5C9H10O2的循环使用对DBT脱除率(η)的影响
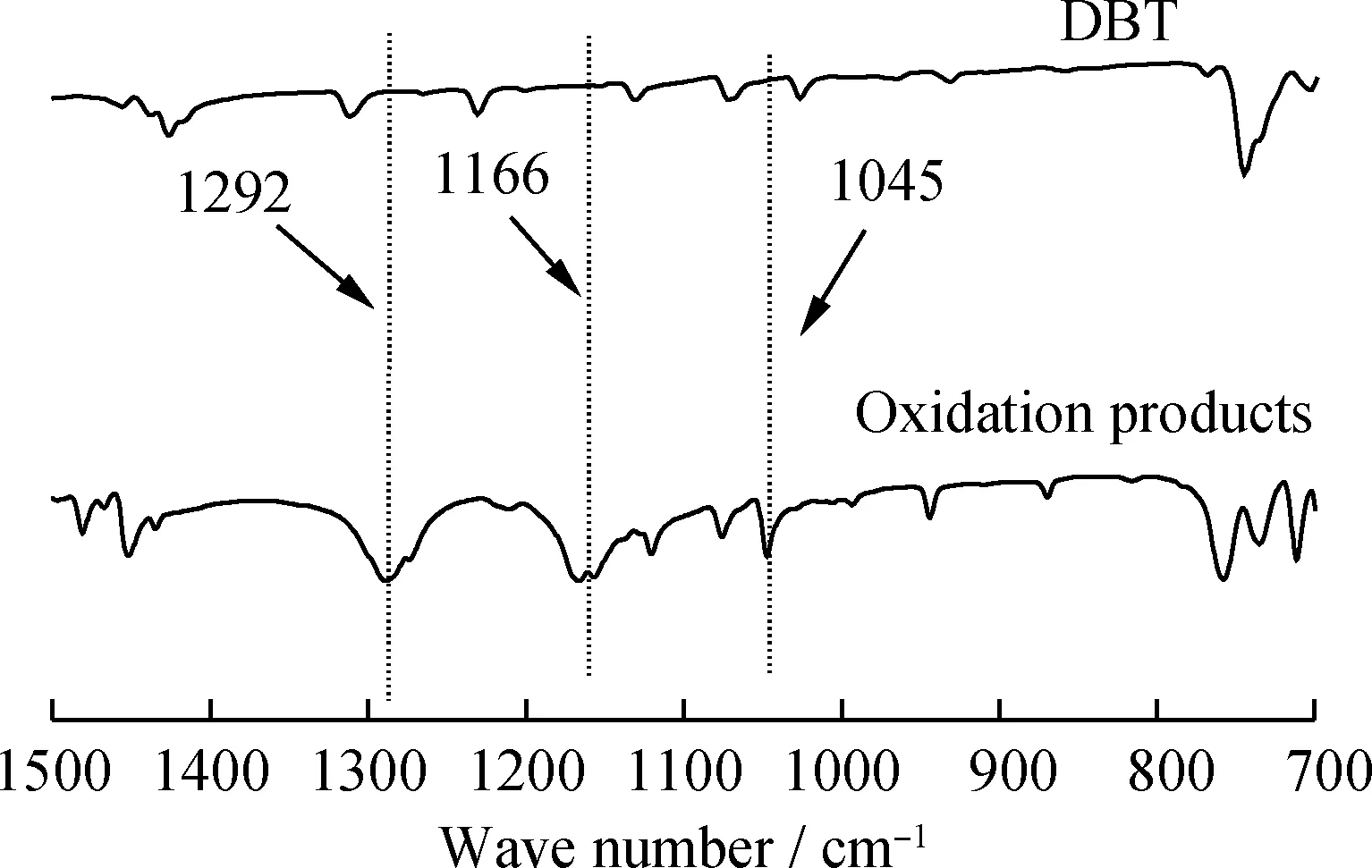
图10 氧化脱硫反应中DBT和氧化产物的红外谱图
2.8 低共熔溶剂萃取-氧化脱硫机理
为了分析[HMIM]BF4/0.5C9H10O2对DBT氧化脱硫反应的萃取-氧化脱硫机理,分别对[HMIM]BF4/0.5C9H10O2、[HMIM]BF4/0.5C9H10O2-DBT(摩尔比1∶1) 和DBT进行红外表征,结果见图11。由图11可知,DBT在1131、1067、743和702 cm-1的4个吸收峰在[HMIM]BF4/0.5C9H10O2-DBT 的红外谱图中发生了不同程度的衰退和消失,表明[HMIM]BF4/0.5C9H10O2与DBT之间发生了强烈的反应,导致DBT的结构发生“畸变”,从而降低了DBT的芳香性,使其更容易被氧化[41-42]。此外,[HMIM]BF4/0.5C9H10O2中的 C9H10O2可以被 H2O2氧化成相应的过氧化物形式 C9H10OO2,其具有将DBT氧化成DBTO2和DBTO的作用。
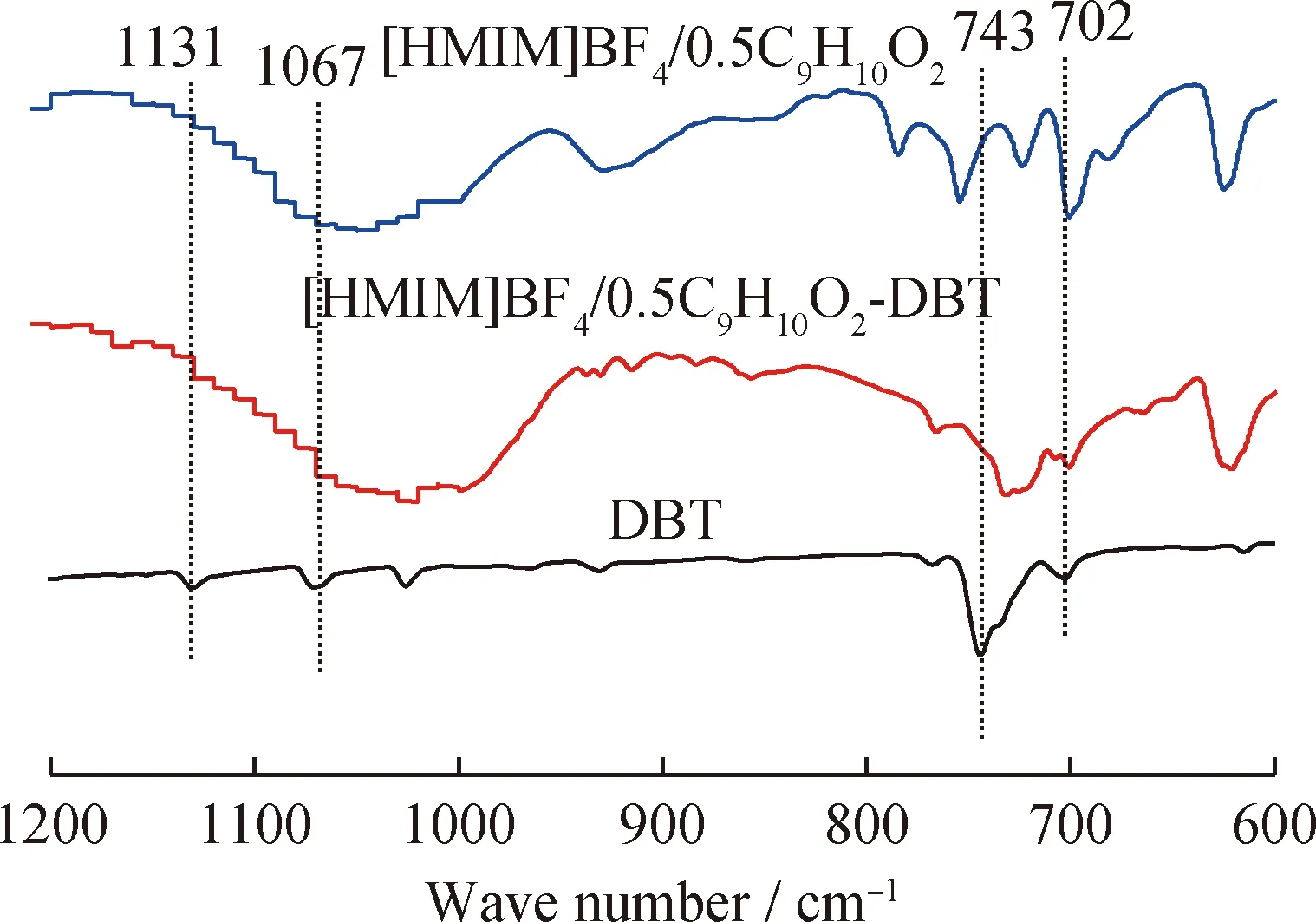
图11 [HMIM]BF4/0.5C9H10O2、 [HMIM]BF4/0.5C9H10O2-DBT(摩尔比1∶1)和DBT的红外谱图
根据以上的分析,[HMIM]BF4/0.5C9H10O2的萃取-氧化脱硫机理如图12所示。由于噻吩和咪唑都是五元环,因此[HMIM]BF4/0.5C9H10O2与DBT之间存在π-π共轭效应。[HMIM]BF4/0.5C9H10O2先将DBT从油相萃取到DESs相;被萃取到DESs相的DBT进一步与[HMIM]BF4/0.5C9H10O2相互作用,使得DBT的结构发生“畸变”;同时在H2O2的作用下,[HMIM]BF4/0.5C9H10O2会被H2O2氧化成相应的过氧化物[HMIM]BF4/0.5C9H10OO2,然后[HMIM]BF4/0.5C9H10OO2将“畸变”的DBT氧化成相应的砜。由于油相与DESs相之间的DBT存在浓度差,[HMIM]BF4/0.5C9H10O2可以持续地将油相中的DBT萃取到DESs相中。在氧化反应的进程中,[HMIM]BF4/0.5C9H10OO2还原后会再次被H2O2氧化,直至H2O2完全消耗或硫化物完全氧化。
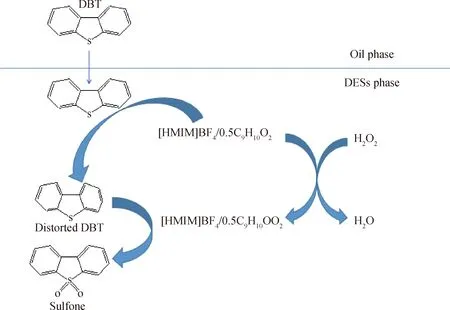
图12 [HMIM]BF4/0.5C9H10O2脱除DBT的萃取-氧化脱硫机理
3 结 论
(1)对合成的不同配比的[HMIM]BF4/xC9H10O2(x=0.5、1、2)型低共熔溶剂进行FT-IR和1H NMR表征,结果表明[HMIM]BF4与C9H10O2存在氢键作用,TGA表征表明[HMIM]BF4/0.5C9H10O2在氧化脱硫反应温度范围内具有较好的热稳定性。
(2)在模拟油体积为5 mL、n(C9H10O2)/n([HMIM]BF4)=0.5、反应温度为60 ℃、反应时间180 min、n(H2O2)/n(S)=8、[HMIM]BF4/0.5C9H10O2的加入量为 1 mL 的最佳反应条件下,[HMIM]BF4/0.5C9H10O2对DBT的脱除率达到98.4%。同时,此低共熔溶剂具有较强的再生能力,循环5次使用后,模型油脱硫率仍高达90.2%。
(3)低共熔溶剂[HMIM]BF4/0.5C9H10O2与DBT之间存在相互作用,可促进氧化脱硫的进程。
