儿童重型遗传性血管性血友病2 例临床分析
2020-09-25王一铭刘玉峰
王一铭 李 白 刘玉峰
郑州大学第一附属医院小儿血液与肿瘤科(河南郑州 450052)
血管性血友病(von Willebrand disease,VWD)于1926年首次发现,是一种遗传性出血性疾病,病因为血管性血友病因子(von Willebrand factor,VWF)数量或质量缺陷,导致无法形成稳定的血栓而致出血时间延长[1]。既往研究显示,VWD患病率约为0.1%~1.0%。男女患病率均等,但症状性出血多见于女性,因女性面临月经及生育等出血风险[2]。由于患者VWF 缺乏或功能障碍程度有所不同,出血症状也呈异质性。VWD 主要表现为皮肤黏膜的小血管出血,常见症状包括鼻腔、口唇、牙龈及月经出血,外科手术或拔牙等术后出血时间延长。消化道、关节腔及软组织出血常见于重型患者(如3型)[3]。儿童患者可能仅以易于擦伤为唯一表现。诊断VWD 时应先评估患者及家族的出血史,其次考虑VWF水平和出血症状。近亲结婚可导致3型VWD等常染色体隐性遗传患病率增加[4]。本研究回顾分析2 例重型VWD 患儿及其家系的临床资料。
1 临床资料
例1,男,1岁,以间断皮肤瘀斑3月余于郑州大学第一附属医院小儿血液与肿瘤科住院治疗。否认类似家族史。体格检查:全身皮肤黏膜可见散在出血点及瘀斑,口腔黏膜及牙龈可见出血,左侧额部可见大小约为4 cm× 4 cm的血肿,余查体未见明显异常。实验室检查:血常规白细胞(WBC)7.44×109/L、血红蛋白(HB)96.4 g/L、血小板计数(PLT)280×109/L;活化部分凝血活酶时间(activated partial thromboplastin time,APTT)71.9 s、D-二聚体0.41 mg/L;血浆因子Ⅷ凝血活性(plasma factor Ⅷ coagulant activity,FⅧ:C)1.9%、血浆因子ⅩⅡ凝血活性(plasma factor ⅩⅡ coagulant activity,FⅩⅡ:C)43.2%、VWF活性(VWF activity,VWF:Act)<5%。
例2,男,2岁,以间断鼻衄1年余于郑州大学第一附属医院小儿血液与肿瘤科住院治疗。祖母及其父母均易鼻衄,量稍多,较易止。有一姐姐体健。体格检查:鼻黏膜可见出血,不易止血,全身皮肤黏膜未见出血点及瘀斑,余查体未见明显异常。实验室检查:血常规WBC 11.76×109/L、HB 88.3 g/L、PLT 369×109/L;FⅧ:C 23%、VWF:Act 2.8%;血型O型。
2 例患儿临床表现以间断皮肤黏膜出血为主,结合家族史及实验室检查,初诊为VWD。病情告知家属,由于我院未开展分型诊断试验,因此建议行基因检测进一步确诊及分型诊断。经家属同意并通过伦理审核后,采集两例患儿及其父母的全血,进行VWF基因检测。方法如下:通过高通量基因测序,分析F7、F8、F 9、F 11、VWF基因全部外显子编码区和剪接区的变异情况;采用PCR结合Sanger测序的方法,分析VWF基因位点的变异情况。
例1患儿VWF基因检测到c.813C>G(p.Tyr271Ter)纯合变异,其父母VWF基因均检测到c.813 C>G(p.Tyr271Ter)杂合变异;例2患儿VWF基因检测到c.55G>A(p.Gly19 Arg)和c.1200 C>A(Asp400Glu)杂合变异,其父亲V W F基因检测到c.5 5 G>A(p.Gly 19 Arg)杂合变异,其母亲VWF基因检测到c.1200 C>A(Asp 400 Glu)杂合变异。c.813 C>G(p.Tyr 271 Ter)已报道与3 型VWD 相关;c.55 G>A(p.Gly 19 Arg)变异率极低,有报道与1 型VWD 相关;c.1200 C>A(Asp 400 Glu)未见报道,但SIFT、Polyphen和MutationTaster软件均预测其有致病性。
2例患儿止血及替代治疗后,出血症状好转。
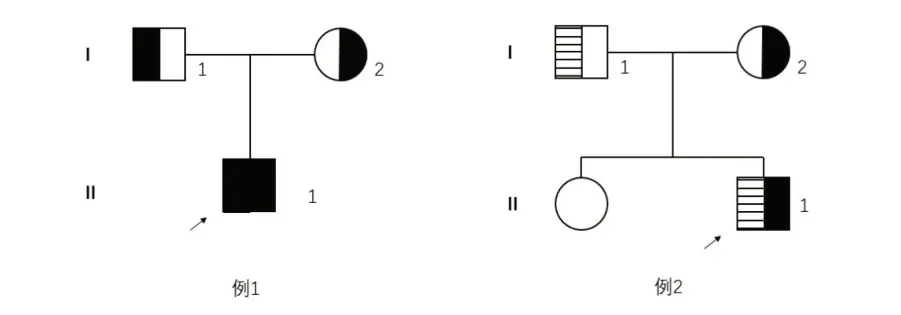
图1 2 例患儿家系图
2 讨论
VWD 分为3 种类型,根据VWF 数量缺乏分为1型和3型,根据VWF质量缺陷分为2型。VWF具体诊断分型及其发病机制和基因变异见表1[2,5]。1型最常见(约占40%~70%),血浆VWF<30 IU/dL,FⅧ相应减低,多聚体构型相对正常。重型1型为血浆VWF<5 IU/dL。2型约占20%,分别为2A、2B、2M、2N,每种亚型有不同的VWF功能缺陷。3型是最罕见和严重的类型,通常VWF:Ag < 1 IU/dL。我国的诊断标准为VWF:Ag缺如(即VWF:Ag<3%)[6],国外学者认为VWFpp ≤5 IU/dL作为标准更精确[7]。重型VWD为VWF<10 IU/dL和/或FⅧ水平<20 IU/dL。3型、大部分有严重出血症状的2 型VWD 患者都可诊断为重型VWD。2 A 和Vicenza 型由于VWF 清除加快,也被定义为重型VWD[8]。血浆VWF:Ag水平在30~50 IU/dL 之间者,诊断为低水平VWF。低水平VWF 是由于内皮细胞合成和分泌VWF 减少,通常不伴VWF 相关基因变异[9-10],表现为VWF水平比正常人低,易于出血,但出血症状比1型患者轻[11]。
疑似VWD 患者可先行出血筛查试验,进一步明确诊断可行VWF数量、结构及功能的检测。由于血浆VWF水平还表现出日节律性,中午达峰值,日波动可达22%[12]。因此,指南建议应重复测量因子水平,以确保诊断的一致性[13]。无法行相关诊断性检测时,基因检测可为确诊VWD提供强有力的支持。VWD应与血友病、获得性von Willebrand综合征(acquired von Willebrand syndrome,AVWS)、血小板型VWD、遗传性血小板病等出血性疾病相鉴别。血小板型VWD 由于血小板功能紊乱导致,基因检测是诊断PT-VWD的金标准[14]。AVWS多发生于中老年,常伴发基础疾病,既往无出血史及家族史[15-16]。遗传性血小板病患者血小板轻度减少,外周血涂片检查可见血小板异常改变。

表1 VWF诊断分型及其发病机制和基因突变
本组2 例VWD 依据我国2012 年VWD 诊断专家共识进行诊断[17]。例1 出血表现为黏膜出血伴皮下血肿,VWF 及F Ⅷ水平均显著降低;基因测序显示c.813C>G(p.Tyr271Ter)纯合变异,为常染色体隐性遗传。有报道显示c.813C>G(p.Tyr271Ter)为无义变异,与3型VWD相关[17]。例1患儿确诊为重型3型VWD。例2 患儿出血表现为间断鼻衄,偶见散在瘀斑,血型为O型;FⅧ:C 23%、VWF:Act 2.8%;基因测序显示c.55G>A(p.Gly19 Arg)和c.1200 C>A(Asp400Glu)杂合变异,其中,c.55G>A(p.Gly19Arg)变异率极低,SIFT、Polyphen和MutationTaster软件均预测为有致病性,亦有研究显示其与1型VWD相关[18];c.1200 C>A(Asp400Glu)为错义变异,在正常人群中发生频率极低,HGMD数据库(专业版2019.2)中未见报道,但SIFT、Polyphen和MutationTaster软件均预测为有致病性。根据ACMG指南[19],该变异判定为临床意义未明。例2 患儿VWF 水平显著降低,考虑与O型血型有关。O型血比非O型血患者体内血浆VWF水平低25%,可能与血型抗原使VWF 分子糖基化水平改变及VWF清除加速有关[18]。例2 患儿最终诊断为重型1型VWD。
VWD 的治疗目标是通过补充足量VWF,或取代异常功能的VWF 而达到止血效果。对于预防围手术期出血或急性出血,应保证VWF及FⅧ水平充足[19]。预防治疗可使显著出血患者受益[20]。常用的治疗药物包括去氨加压素(desmopressin,DDAVP)、抗纤溶剂及替代治疗。1型和大多数2型VWD的一线治疗是应用DDAVP。不同患者应用DDAVP 的反应有差异,建议应用前先行DDAVP 实验,以明确VWF 的持续时间[13]。1 C 型患者应用DDAVP 后VWF 水平显著增高,但分泌VWF的半衰期缩短[5]。仅18%的2型患者使用DDAVP 后有效[21]。2 N 型患者应用后F Ⅷ:C 显著升高,但FⅧ半衰期缩短[22]。2B型患者应慎重使用DDAVP,因为可能加重血小板减少,增加出血风险。但既住有研究应用DDAVP治疗2B型VWD患者后出血时间缩短[23]。儿童发生低钠相关性癫痫风险较高,3 岁以下儿童应避免使用DDAVP[2]。氨基己酸、氨甲环酸等抗纤溶剂可防止血栓溶解,对黏膜出血疗效较好。围手术期、3型及抵抗DDAVP患者常进行替代治疗,如血浆源性VWF 及重组VWF 产品。重组VWF 中不含FⅧ,适合耐受血浆源性VWF或FⅧ水平较高的患者[1]。
综上,由于VWD临床表现差异较大,相关的实验室检测较复杂,确诊及分型困难,易出现漏诊或误诊。本文分析2例儿童VWD的临床特征及家系遗传情况,以提高广大儿科医师对本病的认识。
