293 例再生障碍性贫血患者髓系肿瘤基因变异分析
2020-09-25胡绍燕何广胜肖佩芳何海龙
樊 晔 尹 华 胡绍燕 何广胜 卢 俊 肖佩芳 李 捷 何海龙
1.苏州大学附属儿童医院血液科(江苏苏州 215000);2.江苏省人民医院血液科(江苏南京 210000)
获得性再生障碍性贫血(aplastic anemia,AA)是一种多病因引起的骨髓造血衰竭性疾病。目前认为AA 的主要发病机制是T 细胞过度免疫活化对自身骨髓造血细胞的破坏所导致的骨髓造血衰竭[1]。随着免疫抑制治疗(immunosuppressive therapy,IST)和造血干细胞移植技术的广泛应用,AA 患者的存活时间明显延长[2]。20 世纪90 年代,部分诊断为AA 的患者在疾病后期进展为阵发性血红蛋白尿(paroxysmal hemoglobinuria,PNH)、骨髓增生异常综合征(myelodysplastic syndrome,MDS)/急性髓系白血病(acute myeloid leukemia,AML)克隆性疾病,并提出AA 存在克隆性造血的假设[3]。但由于当时技术的局限性,常规的染色体检测难以证明AA 克隆性造血的发生。随着二代测序技术出现,检测到AA中常伴有与恶性克隆性疾病中相同的体细胞变异[4],而这些体细胞变异与AA 的克隆性造血有极大的相关性,但是对于导致AA克隆性造血的体细胞基因变异在儿童及成人AA中的特征,目前相关报道很少。本文收集293例儿童及成人AA 患者的二代测序基因检测结果,探讨其25种髓系肿瘤相关基因变异的特点与临床意义。
1 临床资料
以2014年9月至2018年6月苏州大学附属儿童医院、江苏省人民医院收治的293例AA患者为研究对象。入选者均根据血常规、骨髓涂片、多次骨髓活检、染色体及FISH 等检查结果,初次诊断为AA;并排除先天性AA及继发性AA。其中,按照初次诊断年龄分为儿童青少年组(0~18岁)及成人组(>18岁)。本研究获医院医学伦理委员会批准。
二代测序及分析步骤:①建立含目标基因的全基因组文库,从血液中提取3~5 μg DNA,采用Covaris S2超声仪进行超声片段化,然后进行末端补平、连接adaptor、PCR等步骤,从而建立含目标基因的全基因组文库,并对其进行质量检测;②使用麦基诺公司专利开发的相关液相捕获试剂盒和委托的基因组文库(其中包括髓系肿瘤相关的25个基因:ASXL1、CBL、DNMT3A、ETV6、EZH2、IDH1、IDH2、JAK2、NRAS、KRAS、RUNX1、SETBP1、SF3B1、SRSF2、TET2、TP53、U2AF1、ZRSR2、CALR、MPL、SH2B3、CSF3R、BCOR、BCORL1、PIGA)混合,Target region相关基因片段就被杂交到探针上;③将样本文库与基因探针进行富集、清洗及洗脱、纯化、PCR等步骤,从而捕获富集目标基因文库;④利用新一代测序仪illumina HiSeq 2500进行高通量测序;⑤利用SNP分析及InDel分析,从而确定变异位点发生的基因、坐标、mRNA位点、氨基酸改变、变异类型(错义变异/无义变异/可变剪切位点)、影响蛋白功能预测(氨基酸插入/氨基酸缺失/移码变异)等。⑥对于变异阳性患者,取口腔黏膜进行验证。
重型再生障碍性贫血(severe aplastic anemia,SAA)、极重型再生障碍性贫血(very severe aplastic anemia,VSAA)或有输血依赖的非重型再生障碍性贫血(non-severe aplastic anemia,NSAA)选用联合免疫抑制治疗;其余NSAA或因经济问题拒绝使用ATG的患者选用口服环孢霉素A(cyclosporine A,CsA)治疗,两种治疗方法可联合或不联合使用雄激素、中药制剂口服,并根据需要予血制品输注、防治感染及祛铁治疗等。①联合免疫抑制治疗:静脉滴注猪抗人淋巴细胞免疫球蛋白(porcine anti-human lymphocyte immunoglobulin,p-ALG),25 mg/(kg·d)×5 d,或兔抗人胸腺细胞免疫球蛋白(rabbit anti-human thymocyte immunoglobulin,r-ATG),2.5 mg/(kg·d)或3.75 mg/(kg·d)×5 d。首日r-ATG/p-ALG治疗之前进行药物静脉敏感试验,r-ATG/p-ALG治疗期间为防治过敏反应,均联合应用甲泼尼龙,治疗后为预防血清病反应继续予甲泼尼龙静滴,3周后减停;r-ATG/p-ALG治疗结束后联合CsA,5 mg/(kg·d),口服,q12h,调整用药剂量使药物浓度前3个月维持在150~250 ng/dL,后维持在100~250 ng/dL。②口服CsA,5 mg/(kg·d),q12 h,调整用药剂量使药物浓度前3个月维持在150~250 ng/dL,后维持在100~250 ng/dL。
定期门诊随访或电话随访,记录6个月后的疗效。AA免疫抑制治疗反应标准参见2016年英国AA诊治指南中对于AA免疫抑制治疗反应的标准[4]。
293例AA患者中苏州大学附属儿童医院患儿111例,江苏省人民医院患者182例;男155例、女138例,中位年龄20.0岁(范围1月龄~85岁);其中婴幼儿(0~3岁)16例,学龄前儿童(~7岁)53例,学龄儿童(~12岁)44例,青少年(~18岁)29例,青壮年(~40岁)81例,中年(~65岁)54例,老年(>65岁)16例;NSAA共178例,SAA及VSAA共115例。
293 例AA 患者中,19 例检出髓系肿瘤相关基因变异,总变异率为6.48%(19/293)。发生变异的基因共10种:KRAS、ASXL1、PIGA、TP53、BCOR、TET2、SF3B1、DNMT3A、SH2B3、MPL;其中变异最多的基因为TET 2,共5 例,变异率为1.71%;其余KRAS、SF3B1、MPL各1例(0.3%),ASXL1、PIGA、TP53、BCOR、DNMT3A、SH2B3各2例(0.7%)。见表1。19例检出基因变异者中,18 例为单基因变异,1 例同时存在ASXL1及BCOR基因变异。男性基因变异者6例,变异率3.9%(6/155);女性基因变异者13例,变异率9.4%(13/138),两者间差异无统计学意义(χ2=3.71,P=0.054)。16例婴幼儿患者中未检出变异者,53例学龄前儿童检出1 例(1.9%),44 例学龄儿童检出1 例(2.3%),29例青少年检出2例(6.9%),81例青壮年检出6例(7.4%),54例中年检出7例(13.0%),16例老年检出2例(12.50%),变异率呈现随年龄增长而增加的趋势。儿童青少年变异率为2.82%(4/142),成人变异率为9.9%(15/151),两者间差异有统计学意义(χ2=6.0,P=0.014)。178例NSAA患者中14例有变异,变异率为7.8%;115例SAA及VSAA患者中5例有变异,变异率为4.4%,两者间差异无统计学意义(χ2=1.43,P=0.233)。

表1 19例髓系肿瘤基因突变阳性AA患者信息
293 例患者中,放弃治疗3 例,治疗后失访或死亡32 例,其余258 例患者均进行IST 治疗,并至少随访6个月。6个月后,19例检出变异者IST治疗有效14例,有效率73.7%;239例未检出变异者,151例有效,有效率63.2%;两组差异无统计学意义(χ2=0.84,P=0.359)。变异组(n=19)中,成人患者IST治疗6个月有效率为73.3%(11/15),儿童青少年患者有效率为75.0%(3/4),差异无统计学意义(P=1.000);无变异组(n=239)中,成人患者有效率为61.7%(82/133),儿童青少年患者有效率为65.1%(69/106),差异无统计学意义(χ2=0.30,P=0.584)。
5例TET2变异者均为成人患者,4例女性、1例男性,4例NSAA、1例SAA;主要氨基酸改变类型为:3个错义变异、2个移码变异、1个终止变异;p.G1137S、p.G1137fs、p.C973X、p.I1762V、p.N488S为发生的氨基酸改变。3例治疗有效。
根据基因作用机制,将10 种变异基因分为表观遗传学、转录调节因子、信号转导通路及其他组。表观遗传学组包含有ASXL1、TET2、DAMT3A、BCOR/BCORL1,转录调节因子组为TP53,信号转导通路组有KRAS、MPL、SH2B3,其他组主要为PIGA、SF3B1。各变异类型分组与无变异组疗效相比,差异无统计学意义(P=0.9);10例表观遗传学变异者,7例治疗有效,有效率70.0%(7/10)。见表2。
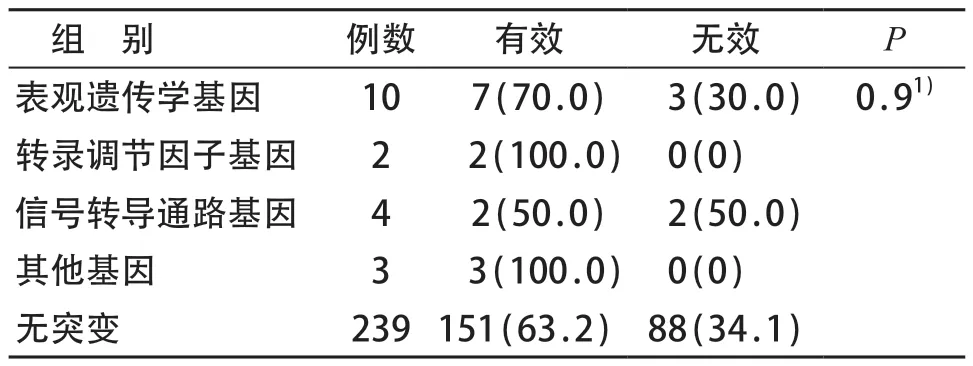
表2 根据不同基因作用机制分组疗效比较[n(%)]
2 讨论
再生障碍性贫血是由多种病因引起的骨髓造血衰竭症,目前普遍认为AA 存在克隆演变,其转化为MDS/AML 的风险是15%,演化为PNH 的风险是10%。MDS、AML 及PNH 三者均具有血液肿瘤的特征。在分子水平上,肿瘤发生一方面是癌基因激活,促进细胞增殖,另一方面是抑癌基因失活或受抑,促进细胞恶变。基因变异经常发生,但部分变异可能构成恶变的始动过程,若此时体内免疫系统丧失免疫监视功能,肿瘤便会发生。AA患者主要的发病机制便是免疫功能障碍,这本身就是肿瘤发生的易感因素。AA向PNH、MDS/AML 的进展可能与体内某些癌基因、抑癌基因的变异有关。
近年来对AA髓系肿瘤基因变异的研究报道逐步增多。然而,各研究报道中的样本特点及目标基因各不相同,得出的结论也有一定的差异[4-8]。对比国外相关文献发现,尽管本研究样本量较多,但是检测目标基因少,样本中位年龄小,因此检出的突变率处于相对较低的水平。
本研究发现,成人AA 的髓系肿瘤基因变异率较儿童高,在此之前也有学者得出相似结论。相关研究对439例AA检测106个基因突变,36%患者检测到体细胞突变,且每位患者的突变数量与年龄呈正相关,即随着年龄增长,体细胞突变有所增加,特别是DNMT3A和ASXL1变异克隆随着时间的推移而扩大[4]。相关研究也提示克隆性造血的患者在确诊时年龄可能更大,且在包括确诊年龄、病程等在内的多因素logistic回归分析中,确诊年龄与克隆性造血显著相关[4]。本研究中儿童青少年变异率为2.82%,明显低于成人(9.9%)。但是,变异率在不同年龄的区别是否与自然衰老有关,目前没有统一意见,但对于AML来讲,大多数AML基因组实际上是在造血干/祖细胞(HSPC)获得起始突变之前发生的随机事件,是由少许个别基因扩增、其他基因协同而决定疾病的特点与预后[9]。由此认为,在AA中的髓系肿瘤基因变异与年龄相关的差别,更多是由于克隆扩增引起,低水平的年龄相关的克隆可能代表克隆创始阶段,后期的克隆扩增引起恶性疾病发生;即在AA中,小的和相对大的疾病克隆群体的检测可能表明克隆进化的不同阶段而不是正常的衰老[8]。
本研究发现,髓系肿瘤基因变异对AA 的联合免疫治疗疗效没有影响,这一结论与相关研究相似,但在相关研究中,PIGA、BCOR/BCORL1变异对免疫治疗效果更好,而DNMT3A、ASXL1、TP53、RUNX1及CSMD 1变异对免疫抑制治疗反应更差[4]。同时也有研究指出DNMT3A和TET2可以降低AA进展为AML的风险,TP53和剪接体基因(包括U2AF1)变异也与较差的预后有关,同一个体中存在的多个变异的影响是倍增的,预计更多数量的变异会增加进展为AML的风险[10]。由于本研究检出某一特定基因变异人数较少,对发生率相对较高的TET 2及表观遗传学变异进行分析,结果对疗效无影响,对于此差异,可能与各研究样本量、随访时间等不同有关。
综上所述,检测25种髓系肿瘤相关基因,基因变异发生率与年龄有关,而变异发生率与性别、AA分类无关;在疗效方面,本研究中有无髓系肿瘤基因变异与联合免疫治疗的疗效无差别,且在不同年龄组内差别无统计意义,与近期国外相关研究结果有相似也有不同的结论,期待更多的样本量及更长随访时间的研究。
