儿童分化型甲状腺癌肺转移14 例131I 治疗分析
2020-09-25邸玉青高洪波李隆敏刘海春张晓勇邵玉军
李 娜 邸玉青 高洪波 李隆敏 刘海春 张晓勇 邵玉军
1.遂宁市中心医院肿瘤中心(四川遂宁 629000);2.北京核工业医院核素诊疗中心(北京 102413)
儿童甲状腺癌是少见的恶性肿瘤,约占儿童恶性肿瘤的0.5%~3%[1],发病率随年龄增加,以分化型甲状腺癌(differentiated thyroid cancer,DTC)为主。儿童DTC的疾病特异性死亡率低(<2%),放射性131I治疗反应好。美国甲状腺学会(American Thyroid Association,ATA)在2015年颁布了专门针对儿童甲状腺结节与DTC的管理指南[2]。研究发现,儿童DTC有着不同于成人的临床特点[3-4],具有发现时病灶体积较大,出现颈部淋巴结或远处转移比例高,肿瘤细胞钠/碘同向转运体表达增高,治疗后复发率高,但总体存活率较高等特点[5]。20%~30%的儿童DTC合并肺转移,多灶性转移也较成人更为常见[6]。本研究回顾分析14 例DTC 肺转移患儿的临床资料,探讨其临床特点以及131I治疗效应。
1 临床资料
2009年7月至2019年6月在北京核工业医院房山院区核素诊疗中心住院行131I治疗的儿童DTC患者总计39例,明确诊断为肺转移14例。其中男5例、女9例,男女比例 1:1.8;平均年龄(12.71±3.05)岁,年龄范围7~18岁。
14 例患儿的病程1 个月至10 年。所有患儿均接受甲状腺全切或次全切手术,经病理学明确诊断为甲状腺乳头状癌11例,甲状腺滤泡癌2例,弥漫硬化型1例。在初诊或随访过程中经131I全身显像(whole body scan,WBS)诊断肺转移,伴或不伴胸部CT异常。
14 例患儿根据肿瘤原发部位大小和侵犯范围进行分期(T分期):T1期1例,T3-T4期9例,分期不详(Tx)4例。所有患儿均出现颈侧区淋巴结转移(N1b),均为肺脏单一器官转移(M1),临床分期均为Ⅱ期。12例患儿为双侧甲状腺病灶,11例为多发病灶。2例有肿瘤家族史。12例接受1次甲状腺切除和颈部淋巴结清扫手术,2例接受2次手术。
14例患儿均接受了2次以上131I治疗。131I治疗前停用左旋甲状腺素钠(L-T4)3周及低碘饮食2周;完善相关检查包括血常规、肝肾功能、尿碘、FT3、FT4、促甲状腺激素(TSH)、甲状腺球蛋白(Tg)、抗甲状腺球蛋白抗体(TGAb)、甲状腺及颈部淋巴结超声、胸部CT等。口服131I,并于第3天行131I-WBS。采用固定剂量法制订131I治疗剂量,131I剂量主要根据体质量计算,剂量范围37.0~74.0 MBq/kg。首次清除残余甲状腺组织37.0 MBq/kg,清除DTC肺转移灶74.0MBq/kg,间隔6个月后重复治疗。治疗间期给予L-T4抑制治疗。
根据实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST 1.1)、血清Tg 和131I-WBS制定疗效评价标准。①完全消除:胸部CT所有靶病灶消失,131I-WBS阴性;在无TGAb干扰时,抑制状态下Tg<0.2 ng/mL或刺激性Tg<1 ng/mL。②好转或稳定:胸部CT靶病灶明显缩小和/或病灶数目减少或无明显变化,131I-WBS 病灶明显缩小和/或病灶数目减少或无明显变化,Tg明显下降或无明显变化。③无效或进展:胸部CT靶病灶增大或增多,131I-WBS病灶增大或增多,Tg明显增高。治疗有效为完全消除+好转+稳定,治疗无效为进展。
14例患儿接受131I治疗(4.0±1.7)次。131I治疗中位累积剂量为9.43(8.25~19.74)GBq。见表1。14例患儿中,完全消除4 例(28.6%),好转或稳定8 例(57.1%),无效或进展2例(14.3%)。131I初次治疗后,5例患儿出现颈部肿胀伴疼痛,8例在服131I后3天内出现恶心、呕吐。1 例典型病例131I 治疗前后的影像学资料见图1。
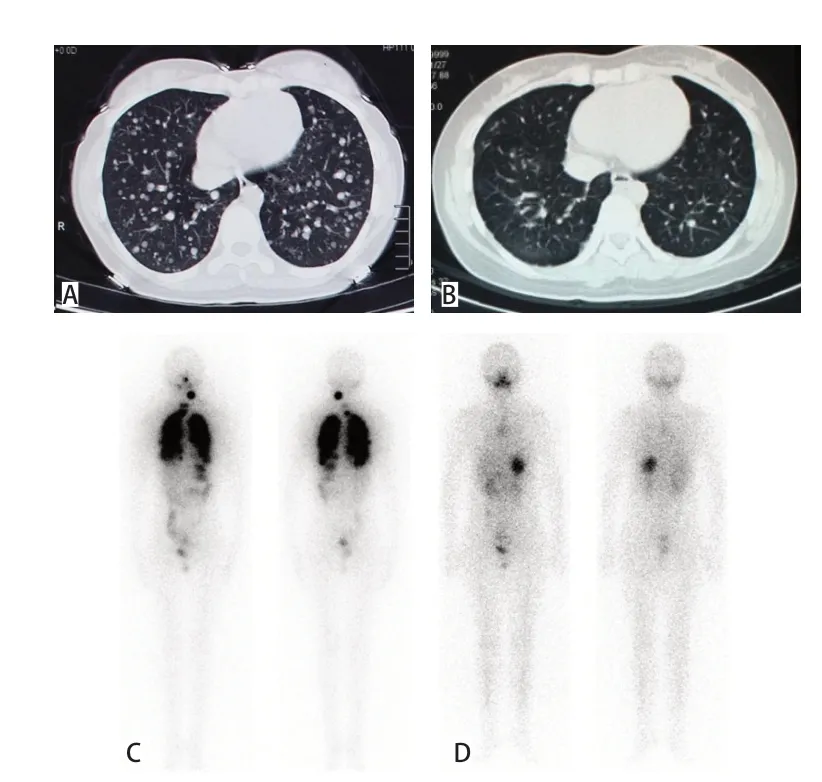
图1 典型病例影像学资料

表1 14例儿童一般情况
随访至2019年11月31日,中位随访时间63.4个月(范围6~124 个月)。14 例患儿均存活,生存率为100%;中位无进展生存期63.5个月,2年无进展生存率为84.61%,5年无进展生存率为80.0%。
2 讨论
全球范围内,儿童甲状腺癌的患病率逐年升高,其中90%~95%是DTC。青春期前男女发病率基本相同,青春期后男女发病率比为1:4[7]。儿童甲状腺癌病因尚不明确,目前认为头颈部放射史是重要的致病因素[8]。儿童甲状腺癌发病率增高还有一个潜在可能是环境的改变。过多暴露于影像学检查产生的电离化辐射也可能与儿童甲状腺癌增长有关[9],也可能与遗传因素有关。对于大部分儿童DTC,甲状腺全切术是治疗首选,手术联合131I 治疗有助于降低儿童DTC 的复发率及改善预后。儿童 DTC 的临床表现、病理特征、生物学行为、治疗及预后等方面与成人差异很大[10]。儿童DTC具有较高的侵袭性及颈部淋巴结转移率,易发生远处转移,且多以肺转移为主[11],多表现为功能性肺转移且DTC癌细胞膜表达的钠/碘同向转运体较成人高[12],因此能从血液循环中主动摄取131I且治疗效果较成人好。儿童DTC治疗后复发率高达30%,但其DTC的总体生存率可高达95%以上。
本研究中,患儿平均发病年龄12.71岁,男女比例为1:1.8。甲状腺乳头状癌占85.7%,甲状腺滤泡癌占14.3%。T分期3、4期9例,所有患儿均出现颈侧区淋巴结转移(N1b),12例为双侧甲状腺病灶,11例为多发病灶,显示儿童DTC具有较高的侵袭性及颈部淋巴结转移率[13]。
2015 ATA 儿童DTC 指南中推荐131I 主要用于手术不可切除的 DTC 摄碘性局部病灶、淋巴结或远处转移灶,其中具有摄碘性肺转移DTC 可从131I 治疗中显著获益[2]。研究认为,对已有淋巴结转移或远处转移的患儿,131I治疗可延长生存期、减少复发[14]。目前尚无标准化儿童DTC的131I治疗剂量标准。推荐经验性选择治疗剂量或根据体质量或体表面积折算131I的剂量。对于存在摄碘性弥漫性肺转移灶或其他远处转移灶需要多次131I 治疗的DTC 患儿,建议计算最大可给予的131I 剂量。有研究推荐DTC 患儿术后131I 治疗剂量通常为3.7~7.4 GBq,年龄较小的患儿可依据50~100 MBq/kg进行调整[15]。临床上常用体质量来计算,剂量范围为18.5~74.0 MBq/kg。也有学者按年龄分层计算治疗剂量,15岁患者需要接受成年患者剂量的 5/6,10岁的剂量为成年患者的 1/2,5岁则予成年患者剂量的 1/3[14]。固定剂量法相对比较简便,应用更广泛,但可能导致治疗过度或不足。本研究根据患儿体质量来制定治疗剂量,患儿平均接受131I治疗4次,中位累积剂量为9.43 GBq。儿童患者是否有安全的累积暴露剂量仍无定论。
儿童DTC 肺转移胸部CT 有多种表现,可为单发结节、多发小结节(直径≤ 1cm)、多发大结节、肺弥漫性转移等,131I治疗效果也有所差异。对于肺转移为微结节(最大直径<2 mm)和多发小结节131I治疗效果较好,大多数患儿经过多次治疗后转移病灶消失,达到临床治愈;多发大结节转移病灶疗效不如多发小结节,但大多数患儿治疗后结节体积缩小,部分消失,临床病情得到明显缓解[16]。大结节肺转移病灶131I效果最差,病灶缩小、Tg下降,但难以达到疾病完全缓解。因此,肺转移患者只要病灶能摄取131I,就是治疗的指征[17-18]。不摄碘肺转移病灶无法从131I 治疗中获益。本研究中14例患儿的完全消除率为28.6%,好转或稳定率为57.1%,有效率为85.7%。在疗效方面与国内相关研究相当[19-20]。
131I治疗出现的短期不良反应主要有唾液腺损伤、口干、味觉改变或丧失、颈前肿胀疼痛,以及恶心、呕吐等胃肠道反应;长期不良反应主要包括损伤性腺、骨髓抑制、肺纤维化和继发性肿瘤等。本研究中颈部肿胀疼痛发生率为35.7%,颈前肿胀疼痛主要为术后残留甲状腺组织在治疗中放射性炎症及水肿所致。胃肠道反应发生率为57.1%,儿童患者恶心、呕吐较成人多见,考虑儿童胃肠道黏膜对放射线更为敏感,更容易受到辐射损伤,DTC 患儿131I 治疗期间应预防并积极处理胃肠道不良反应。研究发现,131I治疗后儿童可出现白血病及胃、膀胱、结肠、唾液腺和乳腺等部位肿瘤,尽管尚不能确定这是否由131I治疗所致,但依然值得高度警惕。本研究中14例患儿接受131I治疗中位累积剂量为9.43(8.25~19.74) GBq,单次最大剂量为5.55 GBq,最大累积剂量达34.04 GBq,经过平均63.4个月(最长124个月)的随访,均无继发肿瘤发生。儿童和青少年DTC131I治疗后继发肿瘤发生是否增加尚不明确,多数文献报道随访时间短,最长15 年,尚不能说明131I治疗与继发肿瘤的关系。
综上,儿童DTC 有其独特的临床病理特征,主要表现为肿瘤多灶性,侵犯广泛,淋巴结转移及肺转移发生率高。131I 治疗儿童DTC 肺转移有较好的临床效果,能够很好地控制疾病,但因没有统一的治疗方案,仍需长期大样本的前瞻性研究及对照试验来进行评价。本研究例数相对较少,对于131I 治疗儿童DTC 肺转移治疗剂量、治疗次数、间隔时间以及不良事件发生时间等仍需进一步研究。
