白蛋白作为抗肿瘤药物递送系统载体的研究进展
2020-09-24王小巍张红艳王东凯
王小巍,刘 锐,张红艳,王东凯
(沈阳药科大学 药学院,辽宁 沈阳 110016)
白蛋白是指在人体内含量最高(通常占血浆蛋白总含量的 50% 以上),且含有 585 种氨基酸残基的一种单链多肽。它是血浆中存在的最小蛋白质之一,分子量约为 66 458[1]。同时,白蛋白也是一种通用的大分子载体,有利于帮助溶解度有限的各种内源性化合物(包括脂肪酸和胆红素),在全身循环中的运输。白蛋白还可与紫杉烷类、磺胺类、青霉素类和苯并二氮杂类等治疗剂结合,来影响药物的生物分布、生物活性和代谢[2]。由于具备上述功能,在临床上白蛋白已被广泛证明是一种安全的生物材料,可用于设计药物输送系统。
白蛋白作为药物载体,能够避免难溶性药物被血液清除,从而发挥靶向作用;还可减少抗肿瘤药物所产生的不良反应和毒副作用;同时,还能增加患者的顺从性[3],具有广阔的应用前景。本文主要从白蛋白的结构、白蛋白作为抗肿瘤药物载体所具有的优势、白蛋白的制备方法和质量评价等方面来展开介绍,以期使其能够更好地应用于临床抗肿瘤药物载体的研究。
1 白蛋白的结构
白蛋白(human serum albumin,HSA),结构如图1所示。在白蛋白分子结构中,包含 17个二硫键、许多带电的残基(例如:赖氨酸、天冬氨酸和没有辅基的基团或者碳水化合物)、少量的色氨酸或者甲硫丁氨酸残基。由于白蛋白具备多种基团,使其具有多种生理功能。在人体体液 pH 值为 7.4 的生理环境中,白蛋白是以负离子的形式存在,且每个白蛋白分子能够带有 200个以上的负电荷,使药物包载在白蛋白中具有相对的优势,能够避免被内皮系统细胞所吞噬[4]。
人血清白蛋白的大空间结构中具有一个心形的三级结构,但人血清白蛋白溶液是由排列成链的柔性球体组成的椭圆体[5]。研究数据表明,大约超过一半的人血清白蛋白的三级结构是由多个α螺旋结构组成的[6]。实际上,白蛋白由 3 个相对应的结构域组成(Ⅰ,Ⅱ,Ⅲ),每一个与之相对应的结构域中都包含有两个亚级结构域(A和B),每个亚级结构域又是由 6 个螺旋结构所组成的[7],在对应的结构域中,是由疏水性和带正电荷的基团所形成的袋状结构[8]。白蛋白独特的空间结构优势,有助于它与物质发生结合。
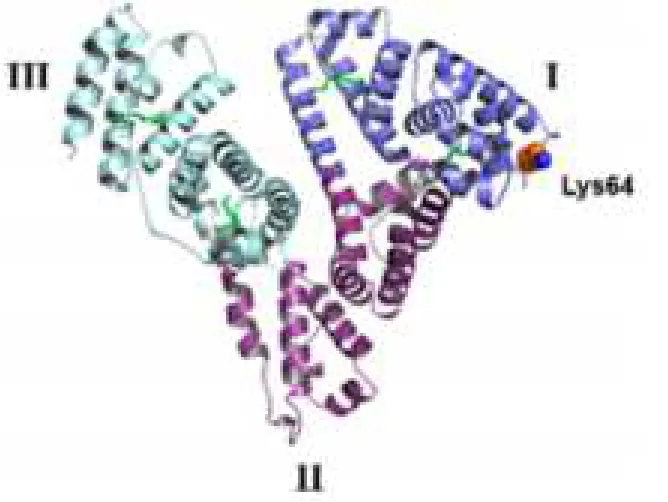
Fig. 1 HSA crystal structure, HSA domains I, II, and III图1 HSA结构,标明HSA域I,II和III
2 白蛋白作为抗肿瘤药物载体的优势以及合理性
白蛋白作为抗肿瘤药物的载体与其他载体相比,具有如下优势:(1)生物相容性好。白蛋白是人体的内源性物质,不会给机体带来毒性反应,也不会引发自身免疫反应,或使机体产生变性、降解等一些不良反应[9]。(2)稳定性好。白蛋白是具有特殊结构和独特性质的蛋白质,在一定的温度和 pH 范围内,会保持良好的稳定性。因此,对于大多数的外源性物质来说,白蛋白是一种理想的载体,可以提高外源性物质的稳定性[10]。(3)载药性能好。白蛋白具有独特的空间结构,能够以物理包裹或化学键偶联的方式将药物包载。研究发现,白蛋白可以增加疏水性药物在血浆中的溶解度,并且对于易氧化药物具有较好的保护作用[11-12]。(4)具有靶向性。药代动力学研究表明,白蛋白不仅可以躲避网状内皮系统的识别与吞噬,被动靶向于肝、肾、骨髓等器官[13];还可以在白蛋白表面,通过以非共价键结合的方式,修饰各类具有靶向功能的物质(例如,对白蛋白表面具有活性赖氨酸中的氨基进行化学修饰)。因为在血管的内皮细胞和大部分的肿瘤细胞表面都有白蛋白受体,这些受体可以提高白蛋白药物在肿瘤细胞中的富集,进而实现白蛋白在体内主动靶向的目的[14]。(5)体内半衰期时间较长。由于白蛋白在血液中带有负电荷,使其不易被巨噬细胞清除,这个特点为实现药物的长效循环提供了可能。综上所述,白蛋白所具备的这些优点,为其成为一种良好的药物载体奠定了一定的基础。
3 白蛋白抗肿瘤药物载体的制备方法
虽然白蛋白作为药物载体的研究已经成为热点,但是它作为药物载体的制备以及相关药物新剂型的开发,仍存在一定的技术壁垒。白蛋白药物载体常见的制备方法,主要有去溶剂法、乳化法、自组装技术、NabTM技术[15]、聚合物分散法、超声法和 pH 凝聚法。
3.1 去溶剂法
去溶剂法多适用于疏水性药物白蛋白载体的制备。该方法是指在不断搅拌下,利用乙醇等有机溶剂将白蛋白的水化膜去除,将它的疏水性区域暴露出来,溶解度降低后,析出白蛋白纳米颗粒。然后,再通过热变性或者是化学交联的方法,形成比较稳定的白蛋白纳米颗粒。最后,将反应中残留的化学交联剂和有机试剂去除,这样就获得了纯化的白蛋白纳米颗粒。去溶剂法具有制备过程步骤少、操作简单、反应速度快、所需试剂相对较少和环保等优点[16-20]。
H. Nosrati 等[20]在研究中,通过采用去溶剂化和化学共沉淀法合成了具有窄粒径分布的氧化铁磁性(iron oxide nanoparticles,IONPs)牛血清白蛋白(bovine serum albumin,BSA)纳米粒(BSA包覆的 IONPs)。采用这种简单、绿色、一锅式的合成方法,合成出的 BSA 涂层的 IONPs 具有均匀的球形核-壳结构,平均粒径在 70~90 nm。该研究对 BSA 涂层的 IONPs 的纳米粒进行了生物相容性分析,表明 BSA 涂层的 IONPs 作为药物载体的溶血性是微不足道的,细胞活力检测在 IONPs 表面上作为生物分子涂层的白蛋白显示出有降低细胞毒性的效果。根据该研究设计的纳米粒特性表明,BSA 涂层的 IONPs 是多功能生物医学应用中有希望的候选者,白蛋白可以在这种有机-无机结构中扮演药物载体的角色,具有降低颗粒细胞毒性的作用。基于这种优势,白蛋白外壳显著提高了其在体外和体内生物医学领域(例如:细胞标记、药物和诊断递送应用)开发应用的可能性。
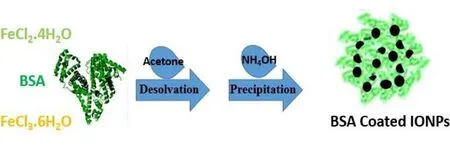
Fig. 2 Schematic illustration of the synthesis of BSA coated IONPs by desolvent图2 去溶剂法合成BSA包被的IONPs的示意图
3.2 乳化法
乳化法制备白蛋白纳米粒的步骤:将含有白蛋白的水溶液与含有药物和乳化剂的油相混合,经搅拌、超声或高压均质等方式进行乳化,得到油包水(W/O)型乳液。与药物结合的白蛋白将分布于内部水相液滴中,再通过热变性或化学交联法进行固化,将所包含的有机相去除,最终得到白蛋白纳米颗粒。通过乳化法制备的乳滴大小受制备机械剪切力水平和力度、乳化剂的性质和浓度,以及乳化剂的添加方式等影响[21]。乳化法主要适用于制备负载疏水性药物的纳米颗粒,但此方法也存在一定的缺点,其缺点主要来自于在乳化过程中,使用到的强大的力量设备所产生的力度和超声作用等有可能会破坏白蛋白的稳定性,使其发生降解,可能会使制备出来的纳米粒的质量达不到相应的预期[22]。同时,这种制备方法也不能很好地控制所制备的纳米粒形态,可能会造成批间均一性差异比较大的结果。
Wu M. F. 等[23]研究了通过高压均质乳化法制备白藜芦醇-甘草酸偶联的人血清白蛋白纳米粒,建立靶向肿瘤的纳米药物递送系统。在制备药物乳液的过程中,纳米粒的尺寸受 HAS 浓度、水与有机相的体积比、均质速度、均质持续时间、均质压力和一定压力水平下的均质频率等参数的影响。在这项研究中,研究者采用正交实验设计和单因素方法,确定了制备方法的最佳条件。在最佳条件下,制备的纳米粒平均粒径为 108.1 nm,多分散指数(polydisperse index,PDI)为0.001,甘草酸与人血清白蛋白的结合量为 112.56 mg/mg,药物包封率和载药量分别为 83.6% 和11.5%。白藜芦醇-甘草酸偶联的人血清白蛋白纳米粒中的白藜芦醇是以非晶形状态存在的,通过近红外荧光成像系统监测纳米粒在 H22 荷瘤小鼠中的体内分布,表明白藜芦醇-甘草酸偶联的人血清白蛋白纳米粒对肝肿瘤表现出有效的靶向性和缓释性能。
3.3 自组装技术
自组装技术最关键的是在白蛋白的表面增加疏水性物质,白蛋白的疏水性增加之后,药物分子能与白蛋白的疏水性区域结合,从而诱导形成白蛋白纳米粒。自组装主要是通过分子间非共价相互作用而形成结构明确和稳定的结构,这种相互作用通常包括氢键、静电吸引和范德华相互作用。自组装的纳米粒具有粒径小、柔性好,且能够有效地逃避生理屏障等特点,为靶向到特定的生物组织和器官奠定了基础。
L. E. Nita 等[24]研究将线性多肽聚天冬氨酸(polyaspartic acid,PAS)和球状蛋白—牛血清白蛋白通过自组装的方法在水溶液中建立大分子共组装体。结合各种表征技术研究 PAS 和 BSA 之间的自组装能力以及它们的混合物在 37 ℃ 双水溶液中的状态,确定复合物形成的最佳条件。数据显示,PAS/BSA 摩尔比约为 0.541 时,会形成共聚物配合物。该研究表明 BSA 表面具有可用于共价修饰和生物活性物质附着的氨基和羧基,适用于生物医学应用材料的设计,例如药物输送系统。
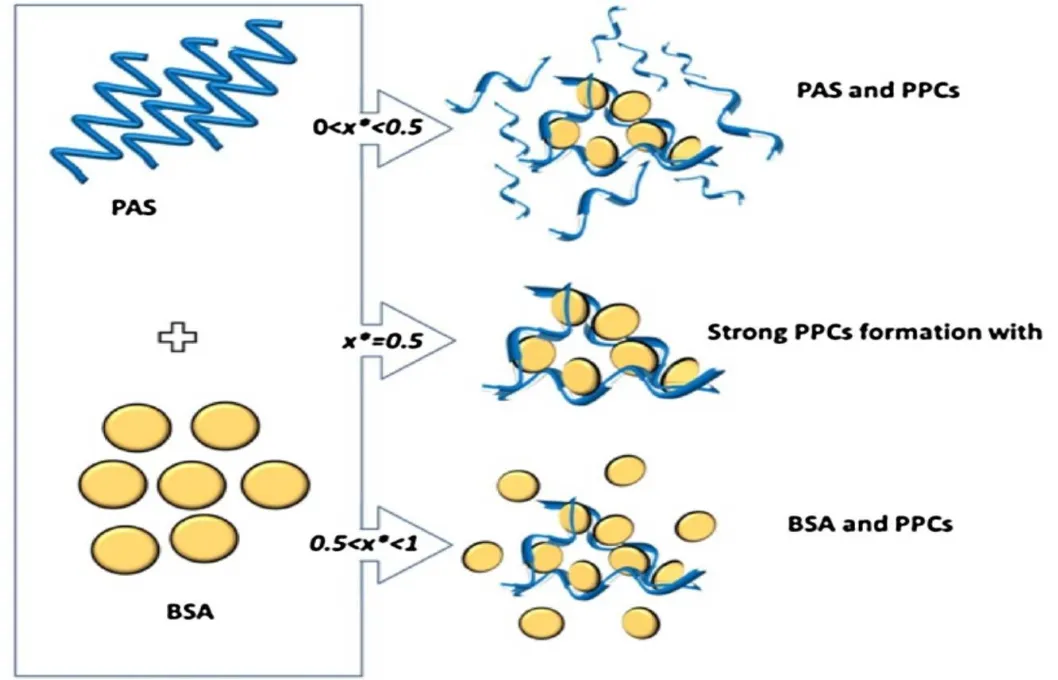
Fig. 3 Formation of PPCs by self-assembling between PAS and BSA as function of the PAS/BSA[24]图3 PAS和BSA之间的自组装形成PPC纳米粒制备示意图[24]
3.4 NabTM技术
NabTM技术是由 American Bioscience 公司研制与开发的,该技术是以白蛋白为载体,将疏水性药物负载在载体上的一种技术。同时,该公司利用 NabTM技术成功研发出已经 FDA 批准上市的紫杉醇白蛋白纳米粒(Abraxane®)。该技术是将疏水性药物溶解在非极性溶剂中,再加入到以白蛋白为水相且作为基质和稳定剂的溶液中,经过高速剪切和搅拌,制备成纳米乳剂,然后将非极性溶剂去除即可得到白蛋白纳米粒。此技术与去溶剂法有一些相似,最后步骤都需要将溶剂去除,因此可能会涉及到溶剂残留问题。但是 NabTM技术可以避免使用毒性较大的交联剂,具有制备方法简便、安全等优点[25]。
Xu W. 等[26]采用 NabTM技术制备拉帕替尼人血清白蛋白纳米粒(lapatinib human serum albumin nanoparticles,LHNPs),开发制备的拉帕替尼纳米粒可以用于静脉给药,能够克服拉帕替尼药物水溶性差、口服吸收率低、服用剂量大等缺点。由于拉帕替尼在氯仿中的溶解度低(1.18 g/L),所以该研究将卵磷脂酰胆碱(egg phosphatidylcholine,EPC)引入处方中溶解拉帕替尼。制备的纳米粒在透射电子显微镜(transmission electron microscope,TEM)下观察呈均匀的球形核-壳结构,平均粒径约为 140 nm,粒径分布较窄(PDI = 0.189)。将冻干后 3 天的粉末重新溶解后测量粒径,数据显示复溶后的纳米粒的平均粒径略微有所增加,变化量可以忽略不计,表明采用该技术制备的LHNPs 具有良好的稳定性。药代动力学研究表明,HAS 纳米颗粒有效地增加了拉帕替尼在肿瘤组织中的蓄积,蓄积水平分别是拉帕替尼(Lapatinib)和市售药物拉帕替尼(Tykerb)的 2.38 和 16.6倍,与市售药物 Tykerb 相比,它对荷瘤小鼠的原发性乳腺癌和肺转移均具有明显更好的抑制作用。LHNPs 的抗肿瘤功效提高的部分原因可能是它与基底膜 40 蛋白(secreted protein acidic and rich in cysteine,SPARC)的紧密结合,而 SPARC 广泛存在于肿瘤组织的细胞外基质中。这些结果表明LHNPs 可能是三阴性乳腺癌(triple negative breast cancer,TNBC)有希望的抗肿瘤药物。
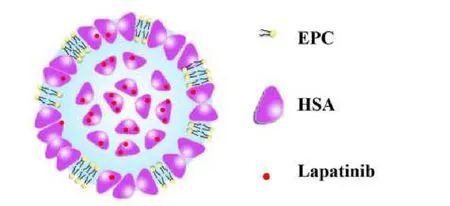
Fig. 4 Structure diagram of lapatinib human serum albumin nanoparticles图4 拉帕替尼人血清白蛋白纳米颗粒结构示意图
3.5 聚合物分散法
聚合物分散法是指将水溶性白蛋白溶液加入到含有聚甲基丙烯酸甲酯聚合物的分散介质中,然后通过振荡混合,形成具有一定大小的白蛋白微球,再添加到含有戊二醛的有机相中进行化学交联,最后通过洗涤干燥,得到的一些亲水性良好的白蛋白微球[27]。
W. E. Longo 等[27]研究开发了一种制备戊二醛交联的人血清白蛋白微球的新方法。该方法主要包括在有机相中添加戊二醛,以及使用疏水性聚合物(聚甲基丙烯酸甲酯)或亲水性聚合物(聚氧乙烯-聚氧丙烯嵌段共聚物)的浓溶液作为分散介质。通过该方法可以容易地制备出均匀、圆形、3~150µm 尺寸的亲水性微球。制备微球的平均尺寸是关于分散时间和能量输入的一种函数关系,并且使用 2-氨基乙醇或氨基乙酸进行化学改性将残余的醛基淬灭,改变其表面的性质。这种方法所制备的白蛋白微球易于分散在注射用水介质中,且无需表面活性剂,能够适用于生产尺寸范围较宽的固体微球。
3.6 超声法
超声法是指将白蛋白水溶性溶液和其中所包含的辅料添加到含有药物的有机相中,通过搅拌和超声乳化,将有机溶剂去除,得到纯度较高的白蛋白纳米溶液,再经过冷冻干燥,即可得到白蛋白纳米粒[28]。
W. M. Girma 等[28]研究通过简单的加热方法合成了二硫化铁亚铜(CuFeS2)纳米晶体,并使用超声辅助微乳液法制备 CuFeS2@ BSA 纳米颗粒,进一步与叶酸(folic acid,FA)和二氢卟吩(chlorin,Ce6)结合,形成具有良好的溶解度和强的近红外(near-infrared,NIR)吸收率的 Ce6︰CuFeS2@BSA-FA 纳米杂化物。通过动态光散射(dynamic light scattering,DLS)测量制备的CuFeS2@BSA 的粒径分布为(18.71 ± 6)nm,比 CuFeS2NPs(10.2 ± 3)nm 大,但低于原始 BSA(234.5 ± 20)nm 的大小,合成的纳米杂化物显示出较低的体外和体内细胞毒性,通过直接的体外实验观察到纳米杂化物具有突出的细胞摄取和活性氧(reactive oxygen species,ROS)生成能力。研究证明BSA可作为丰富的重要血液成分的表面功能化能够增强生物相容性和延长血液循环,牛血清白蛋白功能化的 CuFeS2/Ce6 具有协同的光热疗法(photothermal therapy,PTT)和光动力疗法(photodynamic therapy,PDT)效果。
3.7 pH凝聚法
R. Hedayati 等[29]研究采用复凝聚法制备出具有不同粒径和相对窄粒径分布的牛血清白蛋白-阿拉伯树胶(Acacia)纳米粒(NPs),作为药物和生物活性传递系统的新型纳米载体。由 BSA-Acacia制备的纳米粒尺寸受多个工艺变量的影响,包括:pH、蛋白质与多糖之比、离子强度、生物聚合物总浓度、温度、搅拌速度和戊二醛浓度等参数对产品制备过程的影响,还包括加热、超声处理、交联在内的稳定化步骤等对 NPs 平均尺寸和多分散性的影响。Rouhollah Hedayati等分别对各个影响因素进行了深入的研究,研究结果表明,制备的 NPs 的最小尺寸(即最佳产品)为 108 nm,这种用于制备纳米粒并将细胞毒性药物加载到 NPs 上的方法的优化,将成为进一步的研究主题。
4 白蛋白抗肿瘤纳米药物载体的修饰
白蛋白纳米粒可以根据不同的需求,将纳米粒的表面进行下列修饰:共价偶联修饰白蛋白纳米粒、偶联配体和抗体修饰白蛋白纳米粒、借助配体和抗体的作用将白蛋白与相应的配体和抗体进行修饰,以实现药物的主动靶向性[30]。
4.1 共价偶联修饰白蛋白纳米粒
如果抗肿瘤药物的粒径较小,给药后就会被内皮细胞所吸收,并迅速分布到各个器官中,增加正常组织器官的负担。研究表明,将白蛋白纳米粒共价偶联聚乙二醇(polyethylene glycol,PEG),实现纳米粒的 PEG 化,可以避免这种情况的发生。其主要原因是由于通过 PEG 化的纳米粒可以逃避内皮细胞的识别从而避免被吞噬,延长了纳米粒在体内的循环时间[30]。
J. E. Lee 等[31]研究使用 HAS 和 PEG 的共轭物制备基于白蛋白的紫杉醇(paclitaxel,PTX)纳米粒,用以进行有效的全身性癌症治疗。采用简单的薄膜浇铸和水化程序,可将 PTX 有效地掺入自组装的 HSA-PEG 纳米粒(HSA-PEG/PTX)中,无需其他过程。例如,施加高压/剪切或化学交联,这是一种简便的方法。制备的球形 HSA-PEG/PTX 纳米粒的流体动力学直径约为 280 nm,HSA-PEG/PTX 纳米粒在静脉注射后显示出延长的全身循环,在实体瘤区域中有显著积累,并且在动物肿瘤模型中具有显著的抗肿瘤作用。研究表明,基于 HSA-PEG 的纳米粒可以用作简单的、具有成本效益的绿色治疗药物平台。
4.2 配体修饰白蛋白纳米粒
配体修饰的白蛋白纳米粒,是指在白蛋白纳米粒的表面用配体进行修饰,不同的细胞表面具有不同的配体,可以使纳米粒靶向所相对应的靶细胞,从而杀伤癌细胞,改变纳米粒在体内的分布[32]。
B. Marzieh 等[33]研究开发负载在氧化铁和金纳米粒上的核酸适配体(Aptamer,AS1411)配体功能化白蛋白纳米粒,用于阿霉素(doxorubicin,Dox)抗癌药物的靶向递送。采用超声辅助和受控种子生长合成法制备 IONP 和金纳米颗粒(gold nanoparticles,GNP),然后通过去溶剂化学交联法合成 Dox@BSA IONPs-GNP 纳米载体,最后通过共价连接 AS1411 配体合成Dox@apt-BSA IONPs-GNPs。Dox@apt-BSA IONPs-GNP 纳米粒为球形,平均直径为 120 nm。研究表明,具有白蛋白涂层的 GNP 和 IONP 可以显著抑制癌细胞的增殖。与非靶向纳米颗粒相比,AS1411 配体功能化的纳米粒改善了对腺癌细胞(michigan cancer foundation-7,MCF7)的细胞摄取,主要原因为 AS1411 配体对 MCF7 细胞表面过表达的核仁素具有高度亲和力。
4.3 抗体修饰白蛋白纳米粒
J. T. Patterson 等[34]研究开发在 HAS 中位点选择性标记赖氨酸的环己烯磺酰胺化合物,这种方法被证明可以快速修饰 HAS 并表现出出色的血清稳定性。研究发现,虽然 HAS 上的表面赖氨酸残基很高,标记仍是具有位点选择性的,采用曲妥珠单抗(赫赛汀)缀合物评估此类融合蛋白的稳定性。研究表明,抗体-HSAdI 融合体具有良好的特性,能够保留抗原的结合以及缀合物稳定性。因此,抗体-HSAdI 融合体具有广泛的用途,可用于制备血清稳定的抗体结合物。
5 白蛋白抗肿瘤药物载体的质量评价
白蛋白药物载体的质量评价主要是通过药物载体的粒径、药物载体的形态、药物载体的 Zeta电位、药物载体的包封率,以及载药量等指标表征。
5.1 白蛋白抗肿瘤药物载体的粒径
粒径是抗肿瘤药物载体开发过程中重点关注的指标之一。在网状内皮系统的作用下[35],粒径大于 200 nm 的纳米粒易在肝脏部位发生聚集,粒径小于 10 nm 的纳米粒则会在血液循环中被肾脏快速的清除。目前,通过一系列的研究发现,粒径在 100~200 nm 范围内的纳米粒子被认为是纳米转运系统中最优的选择[36]。
付永莉等[37]研究采用超高压微射流技术制备伊曲康唑白蛋白纳米粒混悬液,筛选混悬液的处方以及摸索制备工艺,考察了白蛋白纳米粒混悬液的外观形态、粒径分布等理化性质和体外释药情况。所制备的伊曲康唑白蛋白纳米粒的平均粒径为(108.1 ± 32.8)nm,PdI 为 0.205。由体外释药考察结果可知,白蛋白纳米粒在刚开始时药物释放比较快,在 0.5 h 释放了 10.7% 的药物,在累积到 4 h 时释放为 33.3%,8 h 时为 47.1%。说明存在于白蛋白纳米粒表面的药物比较少,大部分的药物被包裹在内部,到 24 h 后药物的释放量达到 73.5%。数据表明伊曲康唑白蛋白纳米粒具有延缓药物释放的作用。
5.2 白蛋白抗肿瘤药物载体的形态
最常见的白蛋白抗肿瘤药物载体的形状为球形,根据相关研究发现,药物载体的形态也会影响药物的释放和吸收。
A. Pourjavadi 等[38]研究设计了一种基于 pH 敏感的聚丙烯酸-椰油酸和人血清白蛋白的新型双层涂层的介孔二氧化硅纳米粒(MCM-41),用于吉西他滨(抗癌药)向癌细胞的可控递送。介孔二氧化硅周围的壳具有双层结构,聚丙烯酸-椰油酸用作 pH 敏感的内壳,HAS 用作外壳,核-壳结构的形成是由于修饰的 MCM-41 的氨基与共聚物的羧酸酯基之间的静电相互作用。白蛋白层通过来自蛋白质的氨基和共聚物壳的羧酸酯基之间的静电相互作用而被包裹在共聚物涂覆的纳米粒周围。图5中显示出了 HSA-聚(丙烯酸-椰油酸)-MCM-41 的 TEM 图像。纯 MCM-41的 TEM 图像(图a和b)显示出均匀,离散的球形颗粒,涂有聚合物的 MCM-41(图5 c和d)显示了用箭头标记的聚合物域,显然,MCM-41 纳米粒被聚合物包围。基于这种 pH 敏感核壳结构的纳米粒,药物纳米载体表现出 pH 响应行为,药物的释放与聚电解质共聚物和改性介孔二氧化硅表面之间的静电相互作用有关。在酸性介质中,共聚物壳的构型改变为塌陷状态,药物易于从孔中释放,在中性 pH 值下,药物载体处于稳定状态,外壳靠近纳米粒表面药物释放量很小。

Fig. 5 TEM images of the HSA-poly (acrylic acid-co-itaconic acid)-modified MCM-41[38]图5 HSA-聚(丙烯酸-椰油酸)改性的MCM-41的TEM图像[38]
5.3 白蛋白抗肿瘤药物载体的Zeta电位
白蛋白纳米药物载体的表面电荷会影响药物在血液中的循环,主要是因为纳米药物载体与血液中的蛋白具有一定的非特异性作用。通常血液中的蛋白大都是带有负电荷的[39],如果纳米药物载体表面带有正电荷,则很容易被网状内皮系统识别并被吞噬,所以最佳的纳米药物载体应当带有负电荷,可以躲避内皮系统的吞噬[40]。
E. Ertugen[41]研究载有多西他赛(docetaxel,DTX)的纳米粒用于诊断和治疗前列腺癌。将DTX以 50% 的载药量加载到 HAS 上。载有 DTX 的纳米粒(DTX-HSA)的大小在 150~160 nm 内,电位为 -27.2 mV。在体外药物释放测定中,DTX-HAS 在 48 h 结束时,在 pH 7.4 介质中有 80%的 DTX 释放,而在 pH 5.8 介质中有 93% 的 DTX 释放。因为 DTX-HAS 的表面带有负电荷,可以使其在血液循环中避免被内皮细胞吞噬。数据显示,DTX-HAS 可以选择性地积聚在前列腺癌细胞中,增加癌细胞的死亡,同时对健康细胞的影响又较小,因此作为药物递送系统的化疗效果可能会增强。
5.4 白蛋白纳米药物载体的包封率和载药量
白蛋白纳米药物载体的包封率和载药量会直接影响抗肿瘤药物的治疗效果。包封率是指被包裹在纳米药物载体中的药物占药物总量的百分比;载药量是指被包裹在纳米药物载体中的药物占纳米药物载体总重量的百分比[42]。载药量的大小会直接影响药物的临床应用剂量。
Ruan C. H. 等[42]研究采用白蛋白作为药物递送载体,提高 PTX/白蛋白纳米颗粒(nanoparticles,NPs)的稳定性和靶向效率,从而增强 PTX 的化学治疗效果。SP(substance P)-HSA-PTX NPs 具有令人满意的载药量(7.89%)和包封率(85.7%),体外药物释放是以氧化还原反应方式发生,SP-HSA-PTX NPs 表现出良好的稳定性,增强了药物在肿瘤部位的蓄积能力,并具有较强的抗肿瘤作用,同时具有较低的全身毒性。该研究为仿生材料在肿瘤治疗领域中的应用提供了一个新的平台。
6 结语
本文主要是对以白蛋白作为抗肿瘤药物载体的相关研究做了一个比较详细的介绍,阐明白蛋白不仅是一种理想的药物载体,还可以应用于多种类型的纳米颗粒的表面修饰。白蛋白具有代谢底物和治疗药物的结合位点,可以优先被发炎组织和肿瘤吸收,并且具有可利用性、生物降解性、非毒性和非免疫原性等优势,被广泛地应用于抗肿瘤药物递送系统的研究,以促进纳米粒在生物医学中的应用。
通过以上的举例和实验数据表明,白蛋白可以通过渗透性反应增强抗肿瘤药物的被动靶向运输,提高药物在肿瘤组织中的积累,起到提高药物生物利用度的作用。白蛋白还可以通过共价偶联、静电作用或疏水作用与多种药物结合形成纳米粒子。基于白蛋白的纳米粒子的尺寸,可以很容易地调节并控制在 20~200 nm。
目前,对于白蛋白纳米粒的制备方法的相关研究颇多,为以白蛋白作为抗肿瘤药物载体奠定了基础,同时也推动了更多适用于临床的白蛋白纳米粒的研究,从而能够更好地解决患者的实际问题。因此,白蛋白作为抗肿瘤药物递送系统载体在癌症的治疗上有着重要的临床意义以及发展前景。
