鲟源海豚链球菌分离鉴定及药敏试验
2020-09-22麻强生焦世璋张小丽李世瑛马小军刘倩
麻强生,焦世璋,张小丽,李世瑛,马小军,刘倩
(1.甘肃农业大学动物医学院,甘肃 兰州 730070;2.甘肃省永靖县农牧局,甘肃 永靖 731600)
海豚链球菌是一种革兰氏阳性的β-溶血类链球菌,1976年从亚马逊淡水海豚中首次分离出[1].海豚链球菌能够引起人鱼共患病,主要引起人的蜂窝组织炎[2],目前有血清Ⅰ型和Ⅱ型两种,鱼类感染血清Ⅰ型表现为神经突变,感染血清Ⅱ型产生败血症病理特征[3].海豚链球菌的致病性和毒力基因密切相关[4],毒力基因包括simA,simB,sagA,scpI,pdi,cpsD和cfi,其中simA或simB基因编码SiM蛋白能够促进海豚链球菌对鱼体上皮细胞的粘附和抗吞噬[5];sagA基因编码细胞溶血素从而破坏宿主红细胞和淋巴细胞,还可促进脑血管创伤;scpI基因编码的C5a肽酶是一种表面蛋白,水解补体因子C5a并破坏宿主的抗侵袭能力;pdi基因编码的多氧脱乙酰基酶能够促进菌体粘附、侵袭宿主细胞和抵抗溶菌酶的作用,使得细菌能够逃避宿主的体液免疫[6];cpsD基因编码的荚膜多糖能够保护细菌不受宿主的吞噬[7];pgmA基因编码的葡萄糖磷酸变位酶参与维持细菌形态、荚膜表达和抗先天免疫[8];cfi基因编码的CAMP因子是一种穿孔毒性蛋白,通过结合免疫球蛋白Fc片段来增强致病性[9].
海豚链球菌感染多种淡水养殖鱼、野生淡水鱼和海水养殖鱼,如鲟鱼、虹鳟鱼、大马哈鱼和鲈鱼等[10].我国已发现有罗非鱼、卵形鲳鲹、鲟鱼和斑点叉尾鮰感染海豚链球菌,给我国淡水养殖业造成巨大经济损失[11].近年来每至7、8月,甘肃省永靖县刘家峡杂交鲟常大规模发病,病征以体表溃烂内脏出血或充血为主.调查表明,在该养殖场空气温度28 ℃、表层水温25 ℃的环境下,40~50日龄、体质量约1 kg的杂交鲟开始发病,发病率为40%~50%,死亡率接近70%,给养殖户造成了巨大的经济损失.为探究刘家峡水产养殖场鲟鱼发病的病因,本研究采集病鱼的肝、肾和心等内脏器官,进行了病原菌的分离、鉴定及药物敏感性试验,并对其毒力基因进行分析,以期能为刘家峡鲟鱼养殖中疫病的有效防控提供理论依据.
1 材料与方法
1.1 试验材料
具有典型病征并处于濒死期及死亡杂交鲟(Acipenserschrenckii♀×Acipenserbaeri♂)30尾,分别采自甘肃省刘家峡6家鲟鱼网箱养殖场;40~50日龄健康杂交鲟(Acipenserschrenckii♀×Acipenserbaeri♂)60尾,购自兰州浙东水产有限公司,体质量(1 000±5)g.
BHI琼脂和BHI肉汤购自青岛海博生物公司;无菌脱纤维家兔血液购自上海翊圣生物科技有限公司;细菌生化鉴定管购自杭州微生物试剂有限公司;细菌基因组提取试剂盒,2000 DNAMarker及PCR试剂均购自诺唯赞(南京)公司;药敏纸片购自广东环凯微生物科技有限公司;各种基因扩增引物均由金唯志(天津)公司合成.
1.2 试验方法
1.2.1 海豚链球菌的分离纯化及鉴定
1.2.1.1 细菌的分离纯化 无菌剖检具有典型病征或濒死的杂交鲟,分别取肝脏、肾脏和心脏置于灭菌培养皿中,用灭菌手术剪剪开上述组织,用其横断面在BHI琼脂平板划线接种,30 ℃恒温培养24 h.挑取可疑单个菌落在家兔鲜血平板上反复划线分离,30 ℃培养,直至得到纯化的单一菌落.

表1 本试验中各类基因PCR扩增引物
1.2.1.2 分离菌株培养特性、染色特性及生化特性的观察 观察分离菌株的培养特性及其溶血性,并对分离菌进行革兰氏染色,观察其染色特性.采用微量生化鉴定管,参照《伯杰氏系统细菌学手册》,并按照细菌生化鉴定管的说明进行分离菌株的微量生化试验,初步鉴定分离菌株[12].
1.2.1.3 16S rRNA基因及海豚链球菌特异性基因lctO 的PCR扩增及序列分析
挑取初步鉴定分离菌株的单个菌落接种BHI肉汤,30 ℃,220 r/min恒温震荡培养12 h后,按照细菌基因组提取试剂盒说明书进行分离菌株基因组DNA的提取.以提取的分离菌株基因组DNA为模板扩增细菌16S rRNA基因及海豚链球菌lctO基因[13](引物序列见表1),16S rRNA基因PCR反应体系为:25 μL mix,上下游引物各1 μL,1 μL模板DNA,ddH2O补足至50 μL;特异性基因lctO PCR反应条件为:94 ℃ 5 min,94 ℃ 45 s,58 ℃ 30 s,72 ℃ 90 s,30个循环,72 ℃ 7 min.扩增产物经1%的琼脂糖凝胶电泳检测后送至金唯智(天津)公司进行测序.测序结果在NCBI上BLAST比对分析,确定该分离菌株的种类.
1.2.1.4 系统发育树分析 根据测定分离菌株所得的16S rRNA基因序列与相关属种16S rRNA基因序列,利用MEGA 5.0软件以N-J法构建系统发育进化树,各个分支的bootstrap值选择2000[14],确定分离菌株的进化位置.
1.2.2 人工感染试验
1.2.2.1 菌悬液的制备 挑取分离单个菌株接种于BHI肉汤,30 ℃,220 r/min恒温震荡培养12 h后,用无菌枪头吸取0.5 mL菌液添加到4.5 mL无菌生理盐水中,充分混匀制备成10-1稀释浓度的菌悬液;无菌枪头吸取0.5 mL 10-1稀释浓度的菌悬液添加到4.5 mL的无菌生理盐水中,充分混匀制成10-2稀释浓度的菌悬液;按照上述操作顺序,制备10-3、10-4、10-5、10-6、10-7稀释浓度的菌悬液备用.
选取10-5、10-6、10-7稀释浓度的菌悬液用无菌枪头各吸取0.2 mL,滴加到无菌BHI琼脂平板,用无菌三角棒充分混匀(上述每一稀释浓度重复3次),平板在30 ℃恒温培养48 h进行菌落计数[15].菌落计数结果为1.25×109CFU/mL,将30 ℃,220 r/min恒温震荡培养12 h后的菌液用无菌枪头吸取1 mL添加到4 mL无菌生理盐水中充分混匀制备成2.5×108CFU/mL的菌悬液,将浓度为2.5×108CFU/mL的菌悬液按照10倍比依次稀释为2.5×107、2.5×106、2.5×105、2.5×104CFU/mL的菌悬液备用.
1.2.2.2 人工感染 将60尾健康鲟鱼随机分为6个组,每组10尾,分别饲养在6个水箱中(试验用水箱为玻璃材质,规格为1.5 m×1.0 m×1.0 m,水深0.5 m),饲喂观察7 d确认健康后进行分离菌株的人工感染试验.试验期间,所有水箱的水温均由电子温控仪控制在(25±1) ℃,各水箱中的水每天更换总水量的70%,利用增氧机保证各水箱溶氧量一致.受试的6组鲟鱼分别进行如下处理:第1组作为对照组,每尾腹腔注射无菌生理盐水0.4 mL;第2~6组为分离菌株人工感染组,每组分别以2.5×104、2.5×105、2.5×106、2.5×107、2.5×108CFU/mL浓度的菌悬液进行腹腔注射,每尾0.4 mL.注射完毕,观察记录6组鲟鱼7 d内的变化情况,及时记录病死数,用寇氏法计算7 d半数致死量(LD50)[16,19].剖检死亡鲟鱼,观察病理剖检变化,无菌摘取病变组织,以划线分离的方式再次进行细菌分离鉴定.
1.2.3 海豚链球菌药物敏感性试验 将分离鉴定的病原菌接种于BHI琼脂,参照NCCLS抗生素敏感试验操作标准进行纸片扩散法抑菌试验,并参照NCCLS的判断标准进行结果判定[17].
1.2.4 海豚链球菌血清型分析(RAPD分型)和毒力基因检测
1.2.4.1 海豚链球菌的血清型分析(RAPD分型) 以LP为引物(5′-GATCAAGTCC-3′)[18],提取的海豚链球菌基因组DNA为模板进行随机扩增多态性DNA(RAPD).PCR反应体系:25 μL mix;引物2 μL;2 μL模板DNA;ddH2O补足至50 μL.PCR反应条件:94 ℃ 5 min:94 ℃ 45 s;40 ℃ 30 s,30个循环;72 ℃ 90 s;72 ℃ 5 min.1%的琼脂糖凝胶电泳检测PCR 扩增结果.
1.2.4.2 海豚链球菌毒力基因扩增 根据GenBank中海豚链球菌毒力基因序列,参考Baums等[2]方法设计、合成扩增海豚链球菌的主要毒力基因scpI、pdi、cpsD、pgmA和cfi的引物(表1).以提取的海豚链球菌基因组DNA为模板,进行海豚链球菌5种毒力基因的扩增.PCR反应体系:25 μL mix;上下游引物各1 μL;1 μL模板DNA;ddH2O补足至50 μL.PCR反应条件:95 ℃ 5 min;94 ℃ 45 s;59 ℃ 30 s;72 ℃ 90 s;35个循环;72 ℃ 5 min.1%的琼脂糖凝胶电泳检测PCR扩增结果后送至金唯智(天津)公司进行测序.
2 结果与分析
2.1 病原菌培养特性及染色特性、生化反应结果
从具有典型病征并处于濒死期及死亡的30尾杂交鲟的肝脏、肾脏和心脏中共分离出5株疑似海豚链球菌菌株.5株疑似菌株均在BHI琼脂平板上形成圆形、白色、边缘齐整、表面光滑、直径约为0.5~1.0 mm大小的菌落,在家兔鲜血琼脂平板上呈β溶血,在光学显微镜下均呈革兰氏阳性链状排列的球菌(图1).5株分离株生化反应结果均一致,与海豚链球菌标准菌株ATCC29178[19]生化反应基本一致,因此初步确定此5株分离菌株均为海豚链球菌(表2).

图1 分离株革兰氏染色形态(×1000)Figure 1 Isolated strain Gram staining morphology(×1000)
2.2 分离菌株16S rRNA基因及海豚链球菌特异性基因lct O扩增及序列分析
1%琼脂糖凝胶电泳结果表明,5株分离菌株16S rRNA基因扩增产物的大小均约为1 400 bp,与预期的目的片段大小相符(图2),序列分析结果表明其大小均为1 411 bp(图3),各分离菌株的16S rRNA基因序列均相同,在NCBI网站BLAST结果与海豚链球菌相似性达99%;分离菌株的海豚链球菌特异性基因lctO扩增结果表明,5株分离菌株均在750 bp和1 000 bp的之间出现了目的条带,与预期的大小(870 bp)一致(图5),测序结果表明其与已公布海豚链球菌特异性基因lctO基因(GenBank:EF126045.1)的同源性为99%.说明分离菌株均为海豚链球菌,随机挑选一株命名为海豚链球菌LJX.
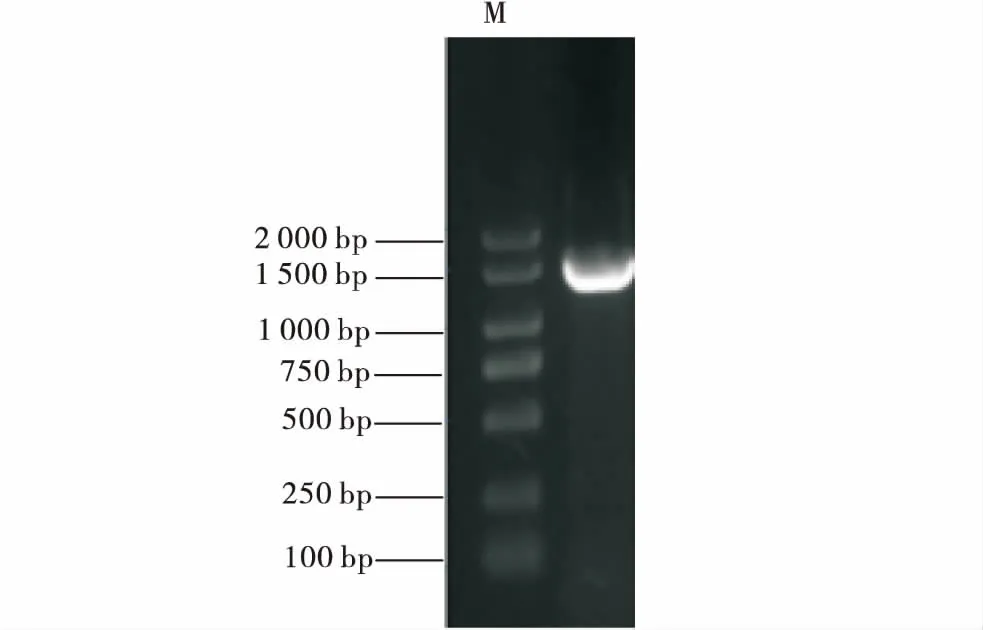
图2 分离株16S rRNA基因扩增产物Figure 2 Isolated strain16S rRNA gene amplification products

表2 分离菌株与海豚链球菌标准菌株生化反应结果

图3 分离株序列分析结果Figure 3 Sequence analysis results of isolated strain
2.3 系统发育树分析
利用MEGA5.0软件构建系统发育树,分离菌株LJX与海豚链球菌聚为一支(图4),且与海豚链球菌标准菌株ATCC 29178(NR_025148.1)的亲缘关系最近,结合扩增出海豚链球菌特异性基因lctO,可将分离菌株LJX进一步确定为海豚链球菌.
2.4 海豚链球菌LJX人工感染试验
将海豚链球菌LJX进行健康杂交鲟的人工感染试验,结果表明其死亡率与细菌活菌数目具有一定相关性(表3).死亡鱼体表溃烂,剖检后可见内脏出血或充血,这与自然发病症状相似,并从以无菌环境采取的死亡鲟鱼内脏组织分离得到了与分离菌株海豚链球菌LJX在培养特性和生化特性一致的细菌.说明此次分离的海豚链球菌LJX对健康鲟鱼具有致病作用.运用寇氏法计算出分离菌株海豚链球菌LJX对杂交鲟的LD50为3.15×106CFU/mL.
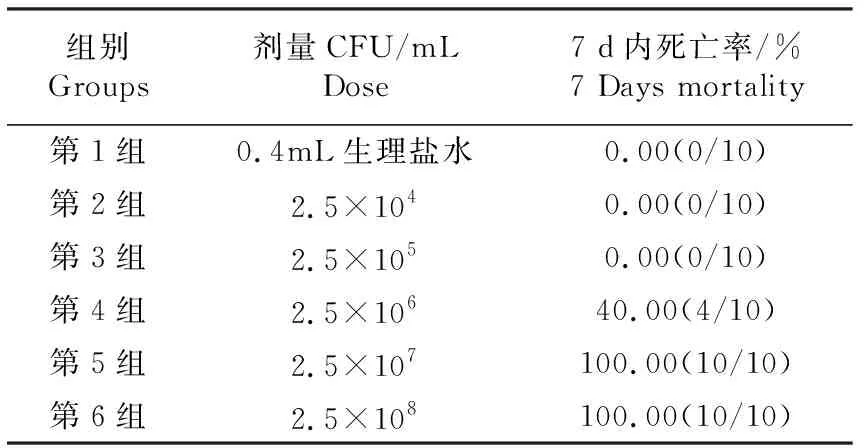
表3 海豚链球菌LJX人工感染试验死亡率
2.5 海豚链球菌LJX药物敏感性试验结果
药敏试验结果:海豚链球菌LJX对卡那霉素、强力霉素、依诺沙星、红霉素、四环素、阿奇霉素、环丙沙星、阿莫西林等敏感;对链霉素、大观霉素、阿米卡星、庆大霉素、诺氟沙星、氨曲南等耐药(表4).

图4 分离株LJX16S rRNA 基因序列构建的系统发育树Figure 4 Phylogenetic tree constructed by isolates of the LJX16S rRNA gene sequence
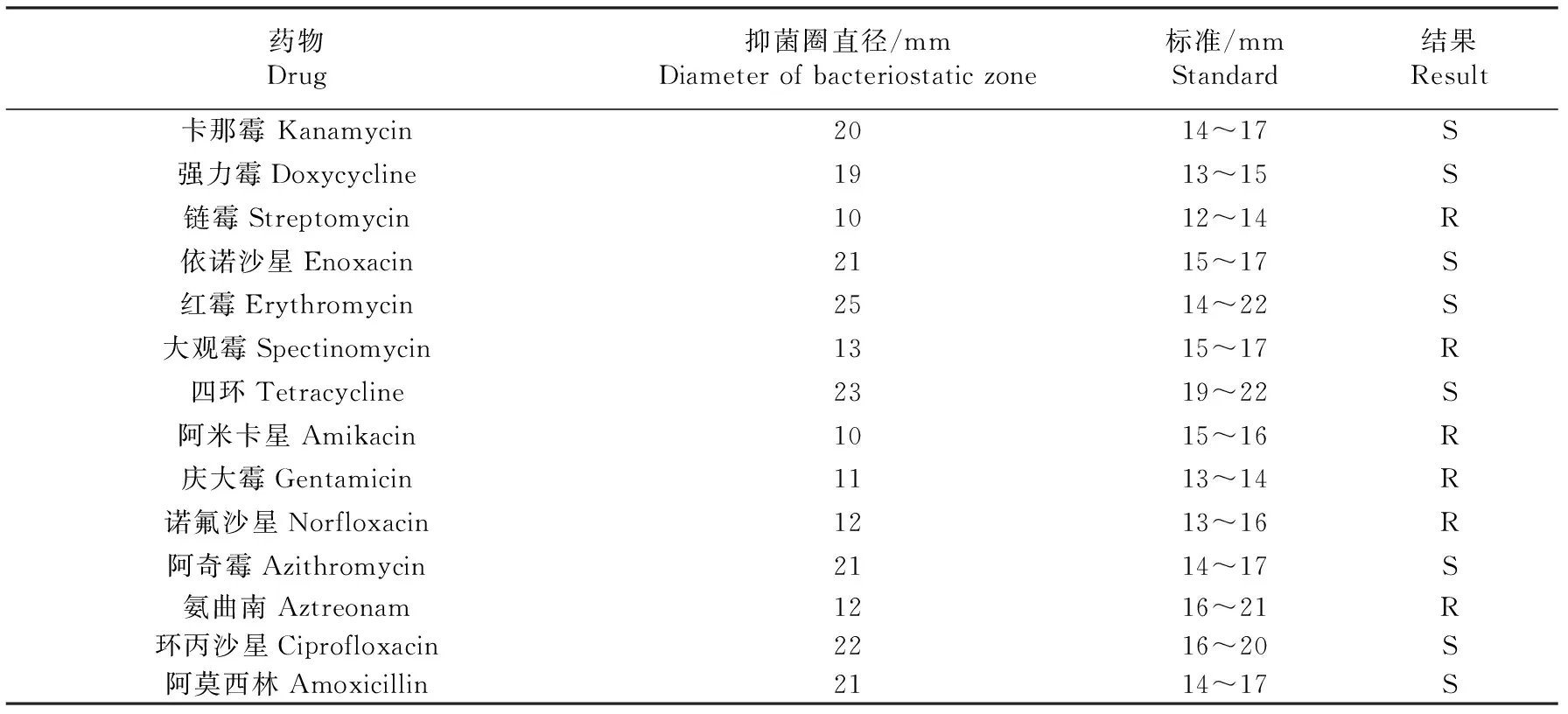
表4 海豚链球菌LJX药敏试验结果
2.6 海豚链球菌LJX血清型分析
已知海豚链球菌血清型有Ⅰ型和Ⅱ型两种.I型在LP引物的作用下可以扩增出750 bp大小的条带,而II型扩增后无结果;I型与核糖和精氨酸反应是阳性结果,而II型是阴性结果.将本试验分离的海豚链球菌LJX在LP引物作用下的扩增产物进行琼脂糖凝胶电泳,结果显示未扩增出750 bp的条带(图5),说明从刘家峡鲟鱼分离出的海豚链球菌LJX是血清型II型,这与生化试验的结果一致.
2.7 海豚链球菌LJX毒力基因扩增结果
海豚链球菌LJX的毒力基因扩增结果显示,试验分离的海豚链球菌LJX扩增出与预期结果大小相似的条带(图5).测序结果BLAST后,分离菌株LJX的毒力基因与已发布的海豚链球菌毒力基因scpI(GenBank:EU693239.1),pdi(GenBank:FJ664396.1),cpsD(GenBank:JX164238.1),pgmA(GenBank:JF795256.1)和cfi(GenBank:KC132870.1) 5种毒力基因相似度均为99%,是一株毒力较强的菌株.

图5 海豚链球菌LJX毒力基因、特异性基因lct O及血清型扩增结果Figure 5 Streptococcus iniae LJX virulence gene,specific gene lct O and serotype amplification results
3 讨论
海豚链球菌是一种世界性分布的鱼类致病菌,宿主广范,传染性强,死亡率高,危害严重,近年来海豚链球菌病对我国的水产养殖业造成了巨大经济损失[20].由于传统的生理生化鉴定并不能准确鉴定出海豚链球菌,市售的链球菌生化鉴定试剂盒常常会将海豚链球菌鉴定为乳房链球菌或停乳链球菌[21],因此淡水养殖业防治海豚链球菌病的首要前提是将其准确的分离鉴定.本研究采用扩增分离菌LJX 16S rRNA 基因及海豚链球菌特异lctO基因(乳酸盐氧化酶基因),通过测序分析,确定了分离株为海豚链球菌.有研究结果表明,海豚链球菌目前至少存在 2 种不同血清型,Bachrach等[18]通过对海豚链球菌血清型与基因多态性进行比较研究,发现以色列1997~2000年分离到的海豚链球菌较之前分离菌株具有不同的基因多态性,并且 2 种基因多态性对应2种血清型,即进行RAPD分型时扩增出750 bp条带的菌株对应血清型Ⅰ型海豚链球菌,未扩增出750 bp条带的菌株对应血清型Ⅱ型海豚链球菌.本研究根据Bachrach等方法利用随机扩增多态性DNA标记(RAPD)对分离的5株海豚链球菌进行基因多态性分析,结果表明此5株分离菌株均为海豚链球菌血清型II型.
人工感染试验结果表明,当海豚链球菌LJX对健康杂交鲟半数致死量是3.15×106CFU/mL,腹腔感染剂量不低于2.5×107CFU/尾时,试验鱼7 d内的死亡率高达100%,表明海豚链球菌LJX致病性较强,这与分离株LJX含有5种毒力基因(scpI,pdi,cpsD,pgmA,cfi)相印证.人工感染试验中死亡鱼的症状与刘家峡养殖场死亡杂交鲟症状一致,皆为体表溃烂,剖检内脏出血或充血,这是海豚链球菌血清II型感染的典型症状,此外从人工腹腔感染发病死亡的24尾杂交鲟体内再次分离病原菌,得到与分离海豚链球菌LJX相同的菌株,进一步说明分离株海豚链球菌LJX为引发刘家峡鲟鱼死亡的主要病原菌.药敏试验结果表明,分离株海豚链球菌LJX对卡那霉素、强力霉素、依诺沙星、红霉素、链霉素、大观霉素、四环素、阿奇霉素、环丙沙星、阿莫西林等敏感;对卡那霉素、阿米卡星、庆大霉素、诺氟沙星、氨曲南等耐药,本研究结果可为甘肃刘家峡杂交鲟海豚链球菌病防治和疫苗研制提供理论依据.
4 结论
此次刘家峡养殖杂交鲟在自然情况下大规模发病是由毒力较强的血清Ⅱ型海豚链球菌引起的.
