婴幼儿乳粉中维生素B12检测的实验室间比对结果分析
2020-09-22陈秀芬梁颖思黄家欣周露
陈秀芬,梁颖思,黄家欣,周露
(广东省食品检验所,广州510435)
0 引 言
维生素B12的检测方法主要有微生物法、化学分析法和试剂盒法[1-3]。微生物法灵敏度和准确度较高[4],所以公职分析化学家协会(AOAC)[5]和美国药典(USP)[6]以及中国国家标准[7]都将该方法作为检测的主要方法和仲裁方法[8],但检测步骤繁琐、检测周期长和易受干扰[9];化学分析法相对快速简单,但存在错测漏测和易受干扰的可能[10];试剂盒法基于微生物法原理,步骤简单,检测周期短,结果准确性较高。
实验室间比对是按照预先规定的条件,由两个或多个实验室对检测物品进行检测的组织、实施和评价[11],并对内部质量控制活动进行监控,确保检测结果的质量[12]。因此,本实验室与广州市食品检验所对婴幼儿乳粉中维生素B12进行实验室间比对实验,比对结果满意。
1 实 验
1.1 材料与仪器
广州市食品检验所发放的一包约30 g 比对样品奶粉,包装为塑料密封袋,完好无破损。
菌种:莱士曼氏乳杆菌(Lactobacillus leichmannii)ATCC 7830(美国Microbiologics公司)。
试剂:乳酸杆菌琼脂培养基和乳酸杆菌肉汤培养基、维生素B12试剂盒(北京陆桥技术股份有限公司);维生素B12试剂盒(德国拜发公司);维生素B12测定用培养基(美国BD 公司);维生素B12标准品(编号CCFD200070,纯度为99.6%,购于CATO Reseach Chemicals Inc.);水磷酸氢二钠,广州化学试剂厂;无水偏重亚硫酸钠,上海麦克林生化有限公司;一水柠檬酸,天津市福晨化学试剂厂。
FE 型 pH 计,梅特勒-托利多集团;Allegra64R 型离心机,美国 Beckman Coulter;UV-2600 型紫外可见分光光度计,日本岛津公司;SX-700 型高压灭菌器,日本TOMY 公司;AC2-4S1 型生物安全柜,新加坡ESCO 公司;SW-CJ-2F 型超净工作台,苏州安泰空气技术有限公司;LRH-250 型生化培养箱,上海一恒科学仪器有限公司;800-TS 型酶标仪,美国BioTek 公司。
1.2 方法
1.2.1 微生物法[7]
(1)测试菌悬液的制备。将活化后的莱士曼氏乳杆菌接种到乳酸杆菌肉汤培养基中,36 ℃±1 ℃培养18~24 h。将培养液以 2 000~3 000 r/min 离心 2~3 min,弃去上清液,加入10 mL 生理盐水,混匀,重复以上步骤3 次,再加10 mL 生理盐水,混匀吸适量该菌悬液于10 mL生理盐水中,混匀制成测试菌悬液。
以生理盐水做空白,于550 nm 波长下测测试菌液的透光率,用生理盐水或菌液调整透光率至60%~80%之间。
(2)前处理液的制备。称取无水磷酸氢二钠1.3 g,无水偏重亚硫酸钠1.0 g,一水柠檬酸1.2 g,用100 mL水溶解。
(3)样品的前处理。称取约6 g 样品于250 mL 锥形瓶中,用10 mL 前处理混合后,再加150 mL 水,与121 ℃水解10 min,冷却后调pH值至4.5±0.2,再用水定容至250 mL,过滤。移取滤液5 mL,加入水20~30 mL。调pH 值至6.8±0.2,用水定容至100 mL。
(4)维生素B12标准曲线的制作。按表1 顺序加入水、标准曲线工作液和维生素B12测定用培养基于培养管中,一式三份。

表1 标准曲线的制作 mL
(5)样品的制作。按表2 顺序加水、样品溶液和维生素B12测定培养基于培养管内,一式三份。

表2 待测液的制作 mL
(6)灭菌、培养和测定。将所有标准试样管和样品管121 ℃灭菌5 min。再将上述试管迅速冷却至30 ℃以下,并向各试管滴加1 滴(50 μg)测试菌液(标准曲线管中空白S1 除外),放入恒温培养箱36 ℃±1 ℃培养19~20 h。培养结束后,在波长550 nm 下,测定每支试管的吸光度。
1.2.2 试剂盒法(进口与国产)
进口试剂盒和国产试剂盒按照说明书操作。
(1)样品的前处理。试剂盒法(进口)称取1 g(精确至0.0001 g)样品溶入40 mL 蒸馏水中,试剂盒法(国产)称取1 g(精确至0.01 g)样品溶入20 mL 样品处理液(维生素B12保护液与蒸馏水比例为1:50)中,摇匀。95 ℃水浴30 min,期间每5 min 振荡一次 ,然后迅速冷却至室温,并用0.2 μm 无菌滤膜过滤至无菌离心管中。将无菌滤液稀释备用。
(2)培养基制备。在含有培养基的玻璃瓶中加入10 mL 无菌水,95 ℃ 水浴 5 min,期间每 2 min 振荡一次,然后迅速冷却至室温,并用0.22 μm 无菌滤膜过滤至无菌离心管中备用。其中,试剂盒法(国产)需将维生素B12检测菌球溶解于培养基中,振荡,摇匀。
(3)标准品溶液的制备。试剂盒法(进口):在维生素B12标准瓶中加入2.4 mL 无菌水,摇匀。取6 个无菌管按照表3 配置(0.03~0.18)μg/100 g 系列浓度的标准溶液。

表3 标准曲线稀释质量分数
试剂盒法(国产):在维生素B12标准瓶中加入5 mL 标准品稀释液(维生素B12保护液与1×维生素B12缓冲液比例为1:50),摇匀。取8 个无菌管按照表4 配置0.02~0.16 μg/100 g系列浓度的标准溶液。

表4 标准曲线稀释质量分数
(4)上板培养。取相应数量的微孔板条至板架,试剂盒法(进口)加入150 μL 培养基和150 μL 标准品或样品,试剂盒法(国产)加入100 μL 培养基和100 μL标准品或样品,再用密封胶片将所有微孔密封,37 ℃黑暗条件下培养44~48 h。
(5)读数及结果分析。孵育完毕后,将微孔板倒置并振荡摇匀,揭去粘合箔并去除微孔液体表面的气泡,用酶标仪在630 nm 或540 nm 条件下读数。结果分析时使用ELISA 专业统计分析软件中4-Parameter计算方法对结果进行分析。
1.2.3 质量控制措施
为保证检测数据的准确性和可信度, 本次实验室间比对根据试样C00076 中B12含量水平、方法选择以及实验室条件, 对B12的测定采用以下质量控制措施:平行实验、加标回收实验、质控样品实验、实验室间比对和方法比对。质量控制措施的具体内容如下:
(1)平行实验。采用2 平行,即称取2 份样品,在重复性条件下获得两次独立测定结果,计算平行结果的相对标准偏差(Reative Standard Deviation,RSD),分析测定结果的精密度。
(2)加标回收实验。在试样C00076 中加入已知浓度的维生素B12标准工作液,加标量为50 ng,计算加标回收率,分析测定结果的准确度。
(3)质控样品实验。选用购自中国检验检疫科学研究院测试评价中心的含B12婴儿配方乳粉作为质控样品进行实验,分析实验过程的质量控制。
(4)实验室间比对。与广东省广州市食品检验所对微生物法进行实验室间比对,在再现性条件下获得测定结果,计算再现性标准差(Reproducibility Stan⁃dard Deviation),检验实验过程的可信度。
(5)方法比对。采用微生物法和试剂盒法进行方法比对,分析测定结果受试验方法差异的影响。
2 结果与分析
2.1 方法线性分析结果
分别用微生物法和试剂盒法(分别包括进口试剂盒和国产试剂盒)对试样C00076 进行测定,以维生素B12含量为横坐标,以吸光度为纵坐标,根据四参数方程拟合标准曲线,3 种方法标准曲线如图1~图3 所示,其线性回归方程、相关系数、检出限和定量限如表5 所示。 由表5 可知,微生物法所得标准曲线相关系数为0.9151,试剂盒法(进口)为0.9995,试剂盒法(国产)为0.9979,可知试剂盒法(进口试剂盒)的线性关系更好。

图1 微生物法维生素B12标准曲线
2.2 精密度实验结果
称取6 份试样C00076 按照上述实验方案进行分析,测定结果如表6所示。微生物法和试剂盒法(进口和国产)的测定结果的RSD分别为5.92%、4.00%和8.00%,RSD均小于10%,满足GB5413.14-2010的要求[8]。

图2 试剂盒法(进口)维生素B12标准曲线
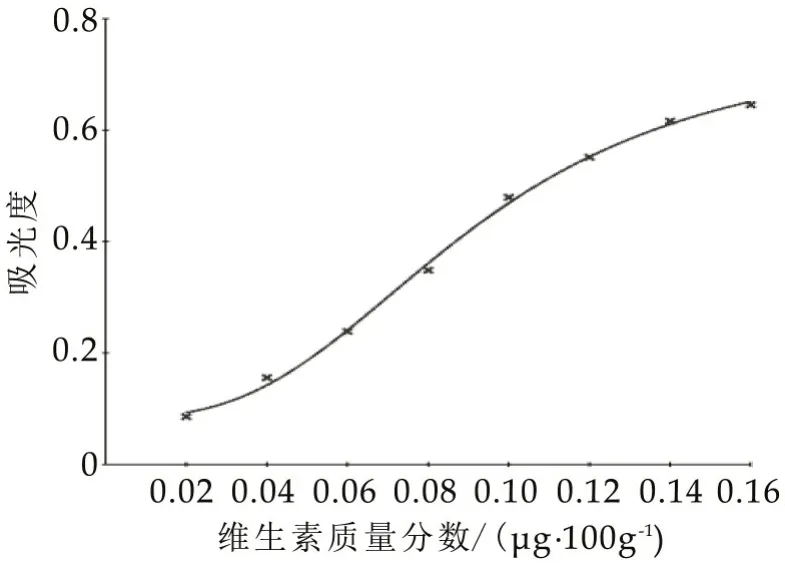
图3 试剂盒法(国产)维生素B12标准曲线

表5 线性回归方程、相关系数、检出限和定量限 μg/100g

表6 精密度实验结果 μg/100g
2.3 加标回收实验结果
称取试样C00076,加入0.5 mL 浓度为100 ng/mL的维生素B12标准溶液,微生物法和试剂盒法(进口和国产)的测定结果的加标回收率如表7 所示,参照GB/T 27404-2008 附录F,回收率均在80%~110%范围内,均符合要求。
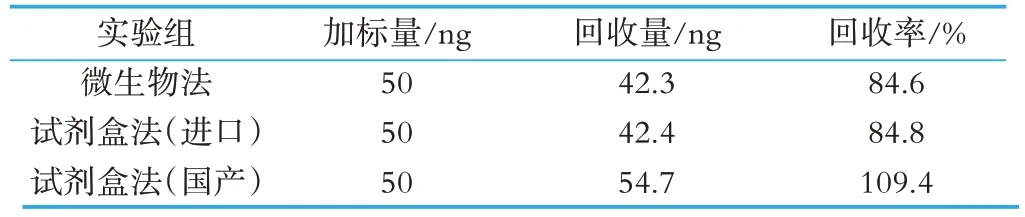
表7 加标回收实验结果
2.4 质控样品实验结果
称取质控样品QC17038 与待测试样C00076 同时进行前处理,再各自按照上述实验方案进行实验,质控样品的实验结果如表8 所示。由表8 可以看出,微生物法和试剂盒法(进口和国产)检测出的质控样品结果均在满意值范围内,说明所选择的检测方法合适,检测结果可靠。

表8 质控样品实验结果 μg/100g
2.5 实验室间比对结果
本实验室与广东省广州市食品检验所采用微生物法进行实验室间比对,结果如表9 所示。由表9 可以看出,本实验室与广东省广州市食品检验所维生素B12报告值得再现性标准差为0,表明比对结果满意。

表9 实验室间比对结果 μg/100g
2.6 微生物法和试剂盒方法比较
本次实验维生素B12微生物法检测值(1.7 μg/100 g)比试剂盒法检测值高(进口为1.0 μg/100 g;国产为0.8 μg/100 g)(表6),可知,微生物法比试剂盒法(进口和国产)的结果都高。微生物法与试剂盒法(进口)的报告值相对偏差为51.9%,加标回收率相对偏差为3.27%;微生物法与试剂盒法(国产)的报告值相对偏差为72.0%,加标回收率相对偏差为19.2%;试剂盒法(进口)与试剂盒法(国产)的报告值相对偏差为11.1%,加标回收率相对偏差为16.0%。方法比对的报告值相对偏差均大于10%,表明测定结果受到实验方法差异的影响较大。有学者研究表明,商品化试剂盒法线性关系良好、人员比对重复性良好[13]和减少了洗涤污染等问题,但是使用试剂盒需要进行评价和方法确认[14]。另外,试剂盒法检测维生素B12的结果显著低于国标法结果[15-16],GB 5413.14-2010[7]中试样提取过程用到的偏重亚硫酸钠能使不稳定的钴胺素转变为稳定的氰钴胺素或者亚硫酸合钴胺素,利于维生素B12提取,而商品化试剂盒一般采用蒸馏水提取维生素B12,可能使得样品中维生素B12提取不彻底,进而导致检测结果低于实际值,且但仅能检测添加的维生素B12,或者也可采用氰化物作为提取液,但氰化物是剧毒,不易获得也不适于长期检测。因此,应尽量避免采用试剂盒法检测食品中的天然维生素B12质量分数较高的食品或者检测强化和天然维生素B12总和的食品。
3 结 论
本次实验室间比对,对试样C00076 的维生素B12质量分数测定结果为1.7 μg/100 g,与广州市食品检验所进行比对,结果满意。
微生物法检测维生素B12虽然操作步骤繁琐、实验周期长和受外部影响大,但是准确度和灵敏度较高,关键在于控制好接种菌的活力和数量、实验玻璃器具除杂、样品前处理的pH 值变化范围、培养基和严格无菌操作。为了提高检测效率和准确度,可以参考试剂盒法的实验方法来对现有的微生物法进行改进:(1)实验全程采用一次性无菌塑料试管和容器,或者将玻璃仪器专项专用放置,每一次实验完毕后都采用热肥皂水浸泡清洗、180 ℃,3 h 干燥除杂处理;(2)参考样品快速前处理方法, 从而缩短前处理时间;(3)将培养基和样品进行过滤操作,减少对干扰吸光度的因素;(4)将实验菌株预先制成冻干粉或者制成甘油管于液氮或-80 ℃冰箱中更易于保存,实验时再用植物乳杆菌肉汤复苏、连续传代2~3 代后使用另外有研究将莱士曼氏乳杆菌按标准制成接种液,再与甘油混匀分装冻存于-80 ℃冰箱,接种液可随时使用,避免实验前耗费4~5 d 制备菌液, 实现来样当天检测, 缩短检测周期和节约成本[17];(4)采用空白无菌微孔板代替试管培养,酶标仪代替紫外可见分光光度计测出吸光度,ELISA 专业统计分析软件中4-Parameter 计算方法代替中国国家标准GB 5413.14-2010[7]中的繁琐计算,从而提升检测效率。将测定维生素B12质量分数的微生物方法进行改进,可以较大程度的缩短了检测时间和降低试验成本[18],有利于建立高效实验流程和加强实验室质量管理,保证结果的有效性和准确度,加强微生物法在实验室间的推广。
