基于基因组学对副干酪乳杆菌BS 08黏附作用的分析
2020-09-22杨郑州侯保朝谢晓娜郭炳豪
杨郑州,侯保朝,谢晓娜,郭炳豪
(百色学院农业与食品工程学院,广西百色533000)
0 引 言
近年来,微生态制剂作为一种新兴的保健品,对增强机体免疫力、促进宿主健康起到了一定的作用,由于它的安全无副作用,已被大多数人所肯定[1-2]。当益生菌(probiotics)黏附于宿主肠道内时,对调节肠道微生态失调、促进机体免疫功能、发挥其益生功能特性起着重要的作用。黏附性能作为益生菌的重要特点之一,已被越来越多的学者所重视[3]。Collins 等提出确定益生菌株的标准是,益生菌黏附和定植于宿主肠道的能力,因为益生菌株必须对上皮细胞组织具有黏附性才能长期在肠道中存活并发挥其作用[4]。
副干酪乳杆菌(Lactobacillus paracasei)作为益生菌可应用于食品以及营养保健品中,它能黏附于宿主肠道上皮细胞上,保证了其发挥益生功能[5-6]。国内外的一些研究表明,乳酸菌通过黏附素与肠黏膜上皮细胞受体黏附,维持肠道菌群平衡及发挥益生功能,对于维护胃肠道正常的生态环境稳定起重要作用[7-8]。因此,基于基因组学注释乳酸菌黏附作用相关基因并探究其黏附作用,将为研究乳酸菌的益生功能提供新的理论基础。本课题选用分离自西藏地区传统发酵乳制品的L. paracasei 作为乳酸菌的代表,筛选出高黏附性能的目标菌株,利用GO 分类筛选Human Genome U133 Plus 2.0 Array 基因表达谱芯片中的黏附相关基因,同时通过研究去除L. paracasei 表面黏附素对黏附性的影响情况,并研究其对病原菌黏附的抑制作用,为深入揭示益生菌黏附机制奠定重要基础,也为微生态制剂的研发与生产提供了深层次的理论依据,具有重要的科学理论意义。
1 材料与方法
1.1 材料与试剂
20 株分离自西藏地区传统发酵乳制品的L. para⁃casei;大肠杆菌(Escherichia coli)K 8,丹麦丹尼斯克公司;人结肠癌细胞Caco-2,中国科学院上海生命科学研究所;Trizol Reagent,Invitrogen 公司;DMEM,GIB⁃CO 公司;青霉素、链霉素,大连美罗大药厂;PBS 磷酸盐缓冲液、焦碳酸二乙酯(DEPC)、MRS 培养基,北京索莱宝生物科技有限公司;细菌基因组DNA 快速提取试剂盒,BioTeKe公司;胎牛血清、胰蛋白酶消化液,TBD 公司;细胞培养瓶、细胞培养板,Orange公司。
1.2 仪器与设备
各种规格 Eppondorf 移液器、HF90 型 CO2培养箱,上海力申科学仪器有限公司;AE31 型倒置显微镜,麦克奥迪实业集团有限公司;BCN1360 型生物洁净工作台,北京东联哈尔仪器制造;低温冷冻离心机,上海离心机械研究所;微量台式离心机,美国Beck⁃man 公司;快速混匀器,姜堰市新康医疗器械有限公司;Model 680 酶标仪,美国 Beckman 公司;YDS-10 型液氮罐,成都金凤液氮容器有限公司;DH-101 恒温鼓风干燥箱,青岛海尔集团公司;电热恒温水浴锅,天津泰斯特仪器有限公司。
1.3 实验方法
1.3.1 高黏附性能菌株的筛选
将活化后活菌数为1×107CFU/mL 的1 mL 菌液在 4 ℃ 条件下 10 000 r/min 离心 5 min,经无菌 PBS 缓冲液洗涤两次后重悬于DMEM 高糖培养液。将Ca⁃co-2 细胞接种于六孔板中,于加菌前24 h 更换不含青链霉素的细胞培养液,将细胞培养至极化状态并加入含菌细胞培养液,置于37 ℃,5% CO2的培养箱中共培养2 h,每个样品设置三个平行。共培养后,使用PBS缓冲液冲洗掉未黏附上的菌体,胰酶消化收集细胞并稀释涂布,在37 ℃条件下置于培养箱中培养48 h 后,平板计数。以黏附率为评价指标筛选出高黏附性能的目标菌株,黏附率公式如下所示:
黏附率 (%) = 100× lg 黏附的菌落数(CFU) / lg 加入的菌落数(CFU)
1.3.2 黏附基因的注释
本实验中采用Affymetrix 公司的U133 Plus 2.0 表达谱芯片,由上海生物芯片有限公司-生物芯片上海国家工程研究中心提供。通过GO 分类分析基因芯片中的黏附相关基因。差异基因筛选标准是:基因变化(change)为I 或MI,log ratio≥1,实验组检测值(De⁃tection)为P 的为上调基因;change 为D 或MD,log ra⁃tio≤-1,Detection为P 的为下调基因。
1.3.3 扫描电镜观察处理菌体的情况
将经过菌体黏附实验后的细胞先用2.5%(v/v)的戊二醛4 ℃固定1.5 h。固定后与经过酶和化学法处理过的目标菌株一起用0.1mol/L pH7.2 的磷酸盐冲洗两次,每次10min。分别用50%、70%、90%、100%的乙醇脱水两次,每次10~15min。用100%乙醇∶叔丁醇=1∶1 的溶液以及纯叔丁醇处理样品各一次,每次15 min。冷冻干燥4 h。扫描电镜观察经过酶和化学法处理过的目标菌株。
1.3.4 处理的菌体对Caco-2细胞黏附影响
Caco-2 细胞培养至对数生长期后,PBS 缓冲液洗2 次,胰酶消化,用DMEM 培养液调整细胞浓度为5.0×104个/mL。将细胞接种于6 孔板中,培养15 d 后用无抗生素的PBS 缓冲液漂洗2 次,每孔分别加入1 mL DMEM 培养液及1 mL 处理过的目标菌株,在37 ℃下,含5%CO2的培养箱内共同培养2 h。PBS洗3次,4%多聚甲醛固定30 min,PBS 洗5 次。进行革兰氏染色。进行镜检,随机读取20 个视野100 个细胞黏附的总菌数,其值即为每100 个细胞上黏附菌数的平均数及标准差(X±SD)。
1.3.5 对病原菌黏附的抑制作用
在96 孔板中,每孔加入细胞悬液100 μL。设置三个组别分析对病原菌的竞争、排斥以及置换作用。竞争组是将Caco-2 细胞、目标菌和经过FITC 标记的大肠杆菌(Escherichia coli)K 8 在37 ℃厌氧条件下共同孵育1 h;排斥组将Caco-2 细胞和目标菌在厌氧条件下共孵育1 h 后,1 000 r/min 离心去上清,再加入经FITC 标记的E. coli K 8 共孵育1 h。置换组是将Ca⁃co-2 细胞和经FITC 标记的E. coli K 8 厌氧条件下共孵育1 h 后,离心去上清后再加入目标菌,厌氧条件下共孵育1 h。三组样品孵育完成后,1 000 r/min 离心去上清。使用PBS洗涤沉淀3次后,用PBS重悬至黑色的96 孔板,避光静置2 h。每个培养孔中加入0.1 mL胰酶作用5 min,待细胞完全脱落,加入0.4 mL 胰酶使培养液终止反应。收集液体,用酶标仪测定其荧光强度,每组设置6 个重复,每个培养孔为1 个重复。黏附率公式如下所示:
黏附率(%) = 100×A2/A1
式中:A1为无目标菌存在的情况下,黏附在Ca⁃co-2 细胞上的E. coli K 8 相对荧光强度;A2为存在目标菌的情况下,黏附在Caco-2 细胞上的E. coli K 8 相对荧光强度。
1.3.6 统计分析
实验数据均采用SPSS 18.0 软件进行t 检验及方差分析(ANOVA),检测差异显著性结果以平均数±标准差表示。
2 结果与分析
2.1 高黏附性能菌株的筛选
乳酸菌是一类能够维持肠道微生态平衡,对宿主起有益作用的益生菌。乳酸菌必须黏附于宿主肠道细胞,才能与正常菌群一起构成生物屏障,通过定植保护作用发挥生理功能[9]。目前国内外常用体外模型来检测乳酸菌黏附于肠道的能力[10]。Caco-2 细胞是体外研究乳酸菌黏附性能的最常见的模式细胞[11],具有与小肠相同的维持细胞极性的重要结构(如微绒毛和紧密连接等),能表达正常人肠细胞的形态和某些生理特征。
如图1 所示,分离自西藏地区传统发酵乳制品的20 株 L. paracasei 均能黏附于 Caco-2 细胞,不同菌株的黏附水平之间存在差异性,L. paracasei BS 08 黏附能力显著高于其他L. paracasei 菌株,表明乳酸菌对肠道细胞黏附有种属及菌株特异性。有研究报道,甘露糖和Ca2+在一些乳酸菌的黏附过程中起重要作用,乳酸菌细胞壁中的脂磷壁酸以及乳酸菌发酵液中菌体分泌的某些蛋白也能促进乳酸菌对肠上皮细胞的黏附[12]。本实验采用的是培养至对数生长期的L. paracasei 菌株,各菌株均具有黏附能力,说明L. paracasei 对Ca⁃co-2 细胞的黏附不是或不完全是由发酵液中的蛋白质介导的,具体的黏附机理还有待于进一步的实验研究。

图1 20株L.paracasei 的黏附率
2.2 黏附作用基因分析
本研究所用的人基因表达谱芯片涵盖47 000 个转录本,代表38 500 个人类基因。通过该芯片杂交检测了 L. paracasei BS 08 与 Caco-2 细胞作用 2 h 后的基因表达变化,根据GO 分类标准,将得到的差异表达基因分为24 类。其中有18 个涉及黏附作用的相关基因(见表1)。
通过比对可知,L. paracasei BS 08 的基因组中存在18 个与黏附相关的基因。黏附相关基因均属于黏附相关的分子家族,如整合素家族、免疫球蛋白超家族、选择素家族、黏蛋白样血管地址素、黏着素或钙离子依赖的细胞黏附分子家族等[13]。上述18 个基因中的prgB/asc10、EF0485、EF0149、Asa1、efaA、Ace、srtC、ebpC、ebpB、lap、esp、clpC 均属于免疫球蛋白超家族,是淋巴细胞抗原的配基,也可与CD6和NgCAM 等蛋白结合[14]。而clpC 既是整合素家族中白细胞黏附受体组的配体,又同时属于免疫球蛋白超家族。还有锰离子依赖或与整合素家族相互作用的细胞黏附分子。
2.3 扫描电镜观察处理后的菌体形态
黏附素是存在于微生物的菌毛、细胞壁、外膜蛋白、鞭毛、荚膜及小丝状体的一类与微生物的黏附密切相关的特殊物质,可能是蛋白质、多肽、糖蛋白、糖脂和多糖或单糖,是一种具有多种结构和功能的多样化分子。许多研究表明菌体的表面成分,即表面蛋白,胞外多糖和磷壁酸,是影响菌体与细胞之间黏附的黏附素。而之前的研究大多关注去除这些菌体表面黏附素后,利用体外黏附模型观察菌体黏附细胞数的增减[15]。乳酸杆菌和宿主肠上皮细胞的黏附已经被证实与乳酸菌体表面成分作用有关,如胞外多糖(exopolysaccharides, EPS)、脂磷壁酸(lipoteichoic acid,LTA)和表面蛋白(surface layer protein, SLP)等,其中表面蛋白起着关键性的作用[16]。
由图 2 d 可以看出,L. paracasei BS 08 为杆状,表面平滑,处理组与非处理组并无明显差异。无处理组的菌体长度大约为3.3 μm,经过处理以后L. paracasei BS 08的菌体长度分别约为3.2 μm(图2 a),3.5 μm(图2 b)和3.5 μm(图2 c),所以经过处理以后并没有引起菌体表面出现异常形态或者造成菌体的断裂。但是我们可以较明显的看到,三个处理组中的菌体都呈聚集状态,而无处理组的菌体都是独立存在的,说明三种处理都会增加菌体表面的黏性。
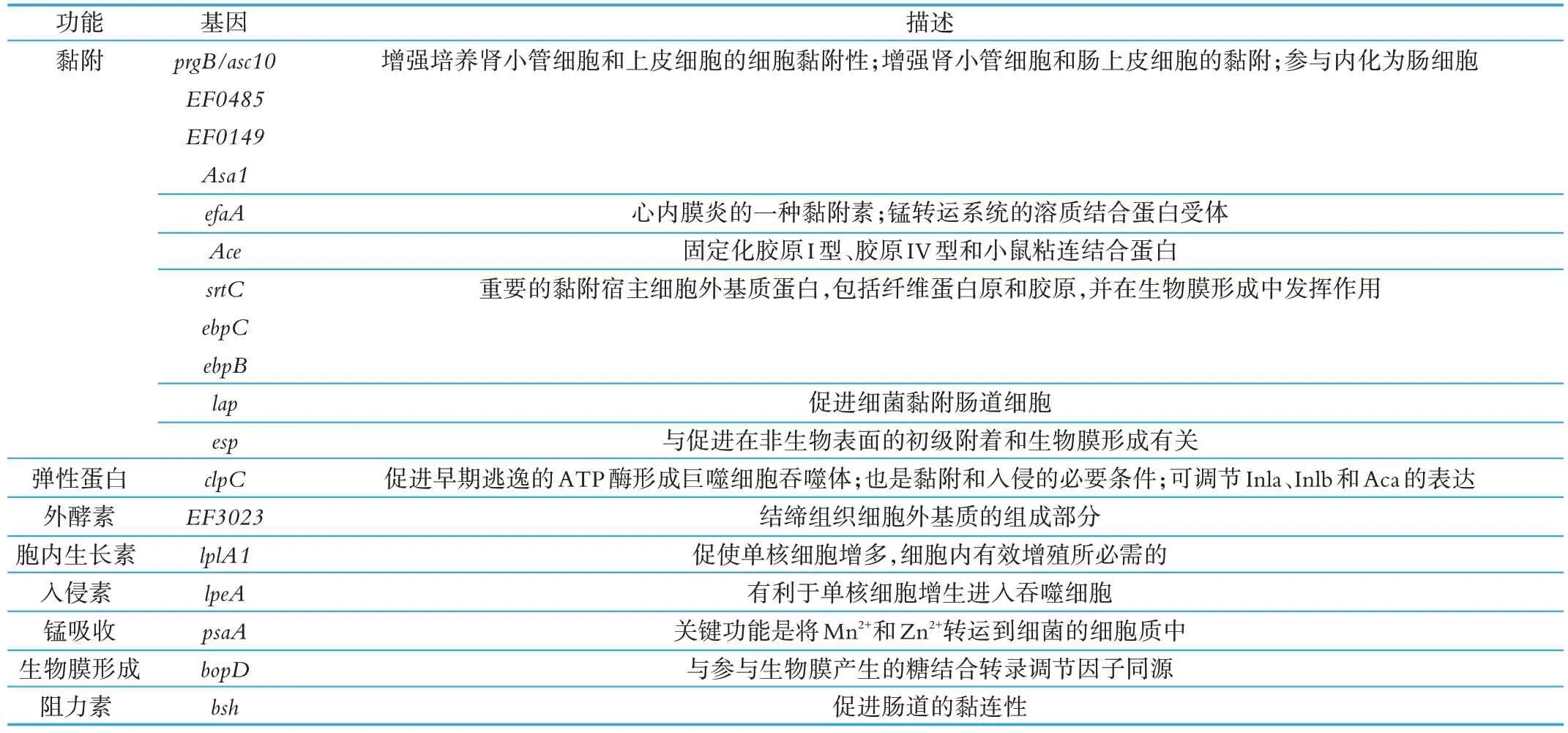
表1 黏附作用相关基因
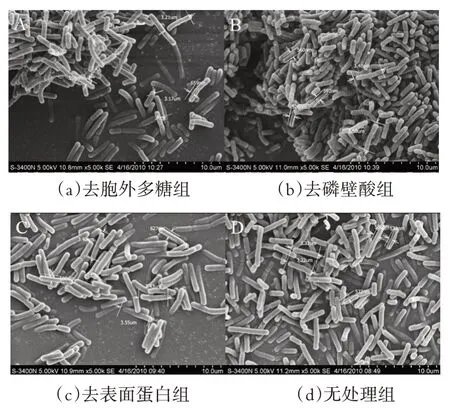
图2 扫描电镜(×5000)下观察处理后的L. paracasei BS 08的形态特征
2.4 L. paracasei BS 08对Caco-2细胞的黏附能力
随机选取20 个视野,记录100 个细胞黏附的菌体总数(见图3)。从图中可以看出,在去表面蛋白组和去胞外多糖组中,菌体与细胞的黏附数都显著低于无处理组(P<0.01),说明表面蛋白和胞外多糖都是影响菌体与细胞之间黏附的主要因素。对于两个处理组之间的比较可以看出,去表面蛋白组的黏附数显著地低于去胞外多糖组(P<0.01),说明表面蛋白对菌体与细胞黏附的影响显著地大于胞外多糖。
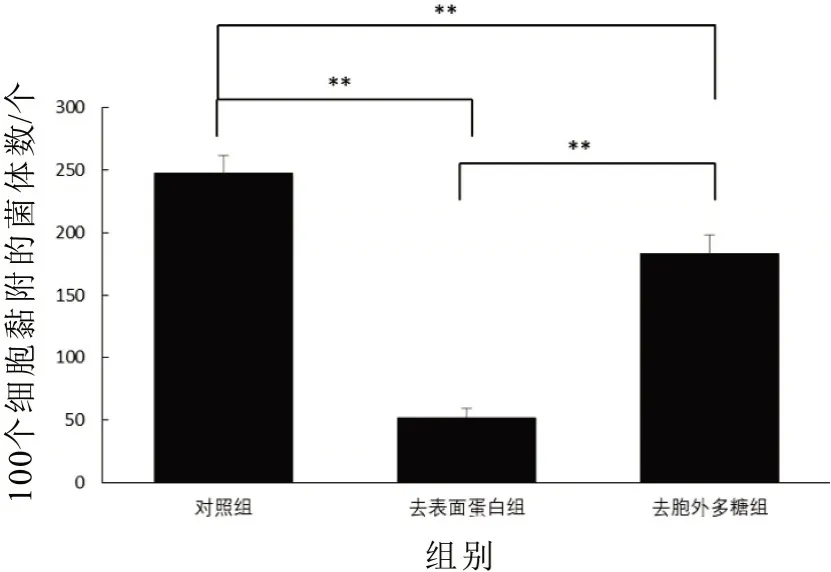
图3 化学和酶处理对L.paracasei BS 08 黏附Caco-2 细胞的影响(×400)
乳酸菌表面存在SLP,这种蛋白呈单分子晶体排列结构,具有方形或六边形对称结构,与菌体黏附肠上皮细胞有关[17-18]。乳酸菌分泌的胞外多糖可以提高菌株对肠道表面的非特异性黏附能力,研究显示乳酸菌合成的胞外多糖与细菌聚集有密切的联系,细菌聚集是生物膜形成的一个整合的过程,而生物膜的形成对黏附有推动作用[19]。此研究去除菌体表面蛋白,去表面蛋白组与对照组相比黏附数显著减少,说明L.paracasei BS 08 的表面蛋白在菌体与细胞黏附的过程中确实起到了重要的作用。且去除菌体表面的胞外多糖后,能显著减低菌体与细胞之间的黏附,说明L.paracasei BS 08 的胞外多糖对菌体与细胞之间的黏附起到了一定的作用,但是不如去表面蛋白组黏附作用效果显著。从扫描电镜的图中我们也可以看出,菌体在去除胞外多糖后聚集成块,而非处理组的菌体独立存在,也证明了胞外多糖与细菌的聚集有一定的联系。
2.5 L.paracasei BS 08对病原菌黏附作用的影响
对于益生菌的作用机理,黏附是其发挥益生作用的前提,经过本研究发现L. paracasei BS 08 对Caco-2细胞有极强的黏附力,而且L. paracasei BS 08 能显著降低E. coli K 8 对Caco-2 细胞的侵袭能力和结合能力(见图4)。本研究发现L. paracasei BS 08 能通过竞争、排斥、置换作用显著抑制E. coli K 8 对Caco-2 细胞的黏附作用。虽然不同乳酸菌对肠道致病菌的黏附抑制作用机制不同,但是很多乳酸菌抑制肠致病菌黏附肠上皮细胞都是通过排斥、竞争或置换作用实现[20]。
L. paracasei BS 08 黏附于肠上皮细胞的过程中,它作为一种细胞外的刺激因素必然会引起靶细胞的跨膜信号传导,启动靶细胞内的生理生化反应过程。一般认为,肠致病性大肠杆菌(EPEC)的黏附过程中通过1,4,5-三磷酸肌醇(IP3)受体系统而触发胞内钙储池释放Ca2+,启动蛋白磷酸化反应,引起肠上皮细胞刷状缘微绒毛局部变性,细胞与EPEC 黏附接触处的细胞骨架聚集,胞膜形成杯状结构。本实验检测到的18 个黏附相关基因所编码的蛋白可能是L. paracasei BS 08 的黏附受体,通过与菌体的相互作用刺激细胞的跨膜信号传导,从而抑制病原菌对宿主的黏附作用。

图4 L.paracasei BS 08对E.coli K 8黏附到Caco-2细胞的影响
3 结 论
通过比较20 株分离自西藏传统发酵乳制品的L.paracasei 菌株对Caco-2 细胞的黏附性能,发现黏附性具有菌株特异性,筛选出高黏附性能的L. paracasei BS 08 为目标菌株。在通过化学和酶处理去除表面黏附素后,菌体表面并未出现异常;L. paracasei BS 08 能黏附于Caco-2 细胞的周围和表面,并且黏附能力良好。而去表面蛋白组和去胞外多糖组都引起菌体黏附数的显著下降,去表面蛋白组引起菌体黏附数的下降显著地低于去胞外多糖组,说明表面蛋白对菌体的黏附影响更明显。通过基因芯片分析注释到了18 个黏附相关基因,包括 prgB/asc10、EF0485、EF0149、Asa1、efaA、Ace、srtC、ebpC、ebpB、lap、esp、clpC 等,并且L. paracasei BS 08 可以通过竞争、排斥和置换三种方式对病原菌E. coli K 8 的黏附具有显著地抑制作用。此研究为深入揭示益生菌黏附机制奠定基础,同时为开发应用微生物制剂提供理论参考。
