维生素B2在胃癌中的作用及机制研究
2020-09-22周俭唐朝亮胡文军田添
周俭,唐朝亮,胡文军△,田添
胃癌是我国最常见的胃肠道恶性肿瘤,2017 年我国胃癌发病率仅次于肺癌而居第2 位(39.78/10万),死亡率居第3 位(25.16/10 万)[1]。尽管外科手术、化疗和靶向药物等治疗手段在胃癌的治疗方面取得了一定的进展,但进展期患者的5 年生存率不足50%[2-3]。维生素B2(Vit B2)又称核黄素,属B 族维生素,是体内黄酶类辅基的重要组成部分。Vit B2积极参与了核苷酸的合成、DNA 甲基化和修复等生化过程,与食管癌[4-5]、结直肠癌[6]、宫颈癌[7]和乳腺癌[8]等恶性肿瘤的发生和发展密切相关。有研究显示,血清高Vit B2 水平可降低胃癌的发病风险[9]。阿帕替尼是我国自主研发的抗肿瘤药物,广泛用于胃癌、乳腺癌和非小细胞肺癌等恶性肿瘤的治疗[10]。目前临床上已将阿帕替尼与其他药物或治疗方法进行同步联合,得到较单药更好的治疗效果[10-11],但阿帕替尼与Vit B2联合用药对胃癌的抗肿瘤效应尚少见相关研究报道。本研究对Vit B2水平与胃癌患者临床病理特征的关系进行分析,并探讨Vit B2 协同阿帕替尼对胃癌MGC-803 细胞增殖活性和凋亡的影响,以期为胃癌的精准治疗提供参考。
1 资料与方法
1.1 临床资料 选择2018 年1 月—2019 年4 月阜阳市人民医院肿瘤科收治的胃癌患者(胃癌组)39例,其中男25例,女14例;年龄35~79岁,平均(51.4±15.8)岁,所有患者均经病理学检查确诊为胃癌,且未接受手术或放化疗等治疗。另择我院体检中心同期健康体检者40例为对照组,其中男21例,女19 例,年龄 36~71 岁,平均(49.2±13.2)岁;2 组性别(χ2=1.093)、年龄(t=0.671)差异均无统计学意义。收集胃癌患者的临床资料,包括病理类型、组织学分型、手术情况和既往病史等。本研究经医院医学伦理委员会批准,且获所有研究对象知情同意并签署知情同意书。
1.2 试剂与仪器 人胃癌MGC-803细胞购自上海中国科学院细胞库。IMDM培养基购自美国Gibco公司;Vit B2购自美国Sigam 公司;阿帕替尼购自江苏恒瑞医药股份有限公司;CCK-8 试剂盒、TRIzol 液和逆转录试剂盒购自瑞士Roche 公司;凋亡试剂盒购自美国BD 公司;乳酸、葡萄糖和琥珀酸脱氢酶检测试剂盒均购自南京建成生物工程研究所。细胞培养箱、分光光度计和高速低温离心机购自美国Thermo 公司;实时荧光定量PCR(qPCR)检测仪购自瑞士Roche公司;流式细胞仪购自美国BD Bioscience公司。
1.3 方法
1.3.1 血样采集与检测 所有研究对象均于清晨空腹抽取静脉血3 mL,送安徽华大医学检验所进行检测。操作步骤如下:低温高速离心机3 000×g离心20 min,吸取血清样本,加入Vit B2样品处理液后置于LVK3000维生素检测仪中,严格按照说明书的步骤进行操作,检测血清Vit B2水平。
1.3.2 细胞培养和氧化磷酸化水平检测 将液氮保存的人胃癌MGC-803细胞解冻复苏后,接种于IMDM培养基并置于37 ℃、5%CO2培养箱中。待细胞融合度为80%~90%时,采用0.25%胰酶消化、传代后,取对数生长期细胞用于实验。按5×103个细胞/孔接种于96 孔板中,实验设5 个不同浓度(0、10、25、50和100 μmol/L)Vit B2组,每组设5个复孔。经不同浓度Vit B2处理24 h后,检测乳酸、葡萄糖、琥珀酸脱氢酶含量,严格按照试剂盒说明书操作。实验重复3次,取均值。
1.3.3 qPCR检测细胞调节糖酵解途径关键酶及葡萄糖转运体1(GLUT1)mRNA表达 药物处理24 h后收集细胞,PBS清洗 3 次。按 500 μL/孔加入 TRIzol 裂解细胞,提取细胞总RNA,逆转录试剂盒将总RNA 逆转录成cDNA。应用SYBR Green 试剂进行 qPCR 检测,反应条件:95 ℃预变性 5 min;95 ℃变性 10 s,59~62 ℃退火30 s,72 ℃延长30 s,共40 个循环;72 ℃延伸10 min。以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,引物序列见表1。采用2-ΔΔCt法计算己糖激酶Ⅱ(HKⅡ)、丙酮酸激酶M2(PKM2)和GLUT1mRNA 表达水平。实验重复3次,取均值。

Tab.1 The information of qPCR primers表1 qPCR引物序列
1.3.4 细胞增殖-毒性检测实验 取对数生长期细胞按5×103个/孔接种于96孔板中,待细胞融合度为80%~90%时,更换为含有不同药物的培养基,将细胞分为4 组,分别为对照组、Vit B2 组(加入50 μmol/L Vit B2)、阿帕替尼组(1 μmol/L阿帕替尼)和联合用药组(加入50 μmol/L Vit B2 和1 μmol/L阿帕替尼),每组设5个复孔。分别于0、12、24、48、72 h后每孔加入10 μL CCK-8 溶液,37 ℃、5%CO2培养箱温育1 h,采用酶标仪(EL-10C,Biobase 公司)于450 nm 波长处测定各组光密度(OD)值。实验重复3次,取均值。
1.3.5 流式细胞术检测细胞凋亡 药物处理24 h 后弃去培养液,预冷的PBS清洗细胞2次,加入适量胰酶消化细胞。吸除胰酶,加入预冷的PBS以重悬细胞,离心后弃去上清,加入500 μL 的1×结合缓冲液,制备单细胞悬液。分别加入5 μL Annexin V-FITC 和 5 μL PI 染色液,混匀后避光孵育 15 min。将离心管置于流式细胞仪(BD FACSCalibur,美国BD Bioscience公司)中,检测细胞凋亡率。实验重复3次,取均值。
1.4 统计学方法 采用SPSS 21.0软件进行统计学处理。计量资料以表示,2组间比较采用独立样本t检验;多组间比较采用单因素方差分析,组间多重比较行LSD-t检验;不同时点多组间比较采用重复测量设计的方差分析。计数资料组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 胃癌组与对照组血清Vit B2水平比较 胃癌组患者血清Vit B2 水平(207.85±39.71)μg/L 显著低于对照组(246.07±45.43)μg/L,差异有统计学意义(t=3.978,P<0.05)。
2.2 血清Vit B2 与胃癌患者临床病理学指标的关系 血清Vit B2 水平与TNM 分期和分化程度有关(P<0.05),而与性别、年龄、肿瘤大小、淋巴结转移、远处转移、吸烟史和饮酒史无关(P>0.05),见表2。
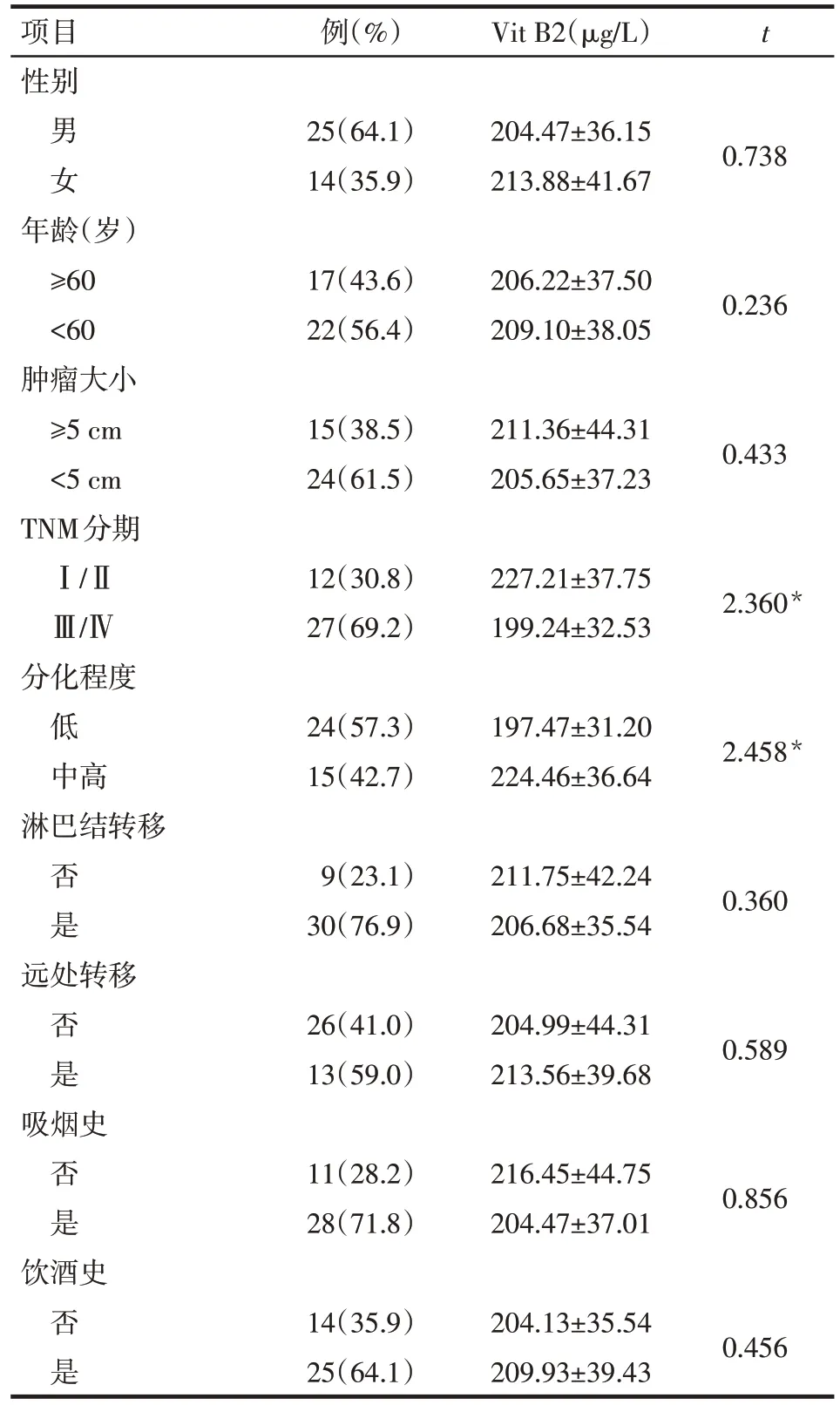
Tab.2 Comparison of serum vitamin B2 between the different clinicopathological characteristics表2 不同临床病理特征患者血液Vit B2水平比较(n=39)
2.3 不同浓度Vit B2组氧化磷酸化水平比较 除0 μmol/L 与10 μmol/L Vit B2 组间差异无统计学意义外,25、50、100 μmol/L Vit B2 组葡萄糖消耗量和乳酸生成量均低于0 μmol/L Vit B2组(均P<0.05),琥珀酸脱氢酶含量均高于0 μmol/L Vit B2 组(均P<0.05);50 μmol/L Vit B2组葡萄糖消耗量和乳酸生成量最低,见表3。
Tab.3 Comparison of activities of mitochondrial respiratory chain complex between five groups表3 各Vit B2组细胞氧化磷酸化指标的比较(n=5,)
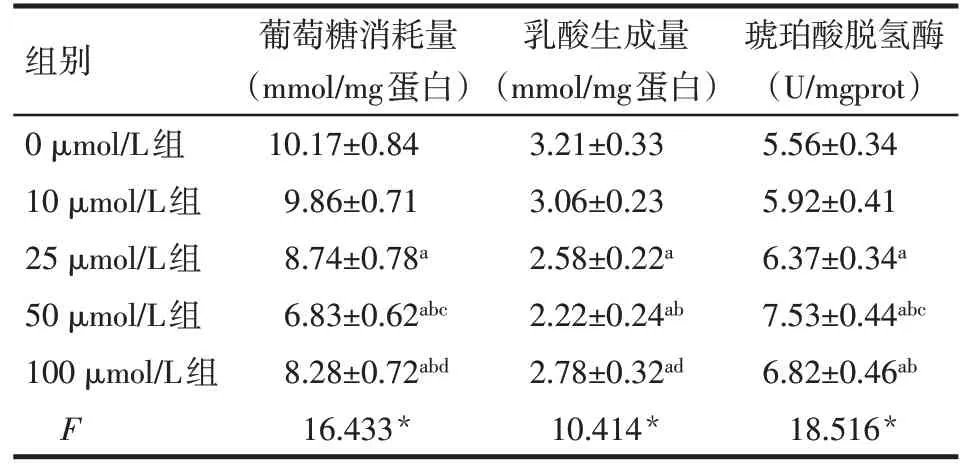
Tab.3 Comparison of activities of mitochondrial respiratory chain complex between five groups表3 各Vit B2组细胞氧化磷酸化指标的比较(n=5,)
*P<0.05;a 与 0 μmol/L 组比较,b 与 10 μmol/L 组比较,c 与 25 μmol/L组比较,d与50 μmol/L组比较,P<0.05
组别0 μmol/L组10 μmol/L组25 μmol/L组50 μmol/L组100 μmol/L组F葡萄糖消耗量(mmol/mg蛋白)10.17±0.84 9.86±0.71 8.74±0.78a 6.83±0.62abc 8.28±0.72abd 16.433*乳酸生成量(mmol/mg蛋白)3.21±0.33 3.06±0.23 2.58±0.22a 2.22±0.24ab 2.78±0.32ad 10.414*琥珀酸脱氢酶(U/mgprot)5.56±0.34 5.92±0.41 6.37±0.34a 7.53±0.44abc 6.82±0.46ab 18.516*
2.4 不同浓度Vit B2 组细胞HKⅡ、PKM2和GLUT1mRNA水平比较 除0 μmol/L与10 μmol/L Vit B2组间差异无统计学意义外,25、50、100 μmol/L Vit B2组细胞HKⅡ、PKM2和GLUT1mRNA 水平均低于0 μmol/L Vit B2 组(均P<0.05),且50 μmol/L Vit B2组GLUT1mRNA水平最低,见表4。
Tab.4 Comparison of relative mRNA expressions between five groups表4 各Vit B2组细胞糖酵解mRNA相对表达量的比较(n=5,)
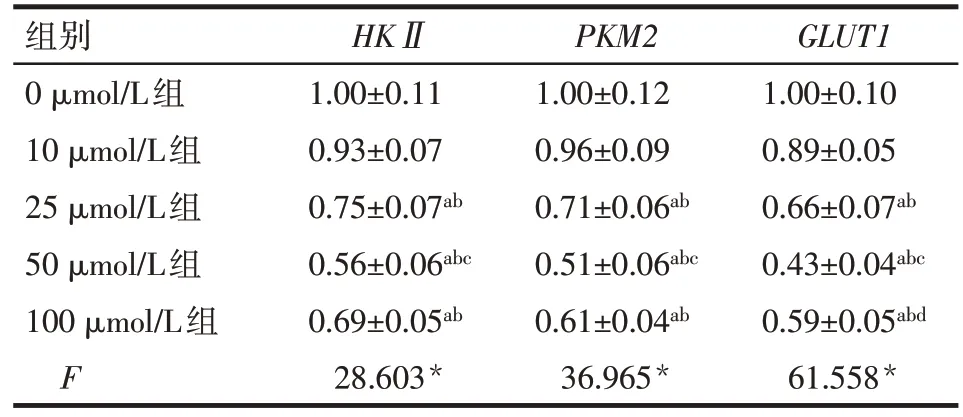
Tab.4 Comparison of relative mRNA expressions between five groups表4 各Vit B2组细胞糖酵解mRNA相对表达量的比较(n=5,)
*P<0.05;a 与 0 μmol/L 组比较,b 与 10 μmol/L 组比较,c 与 25 μmol/L组比较,d与50 μmol/L组比较,P<0.05
组别0 μmol/L组10 μmol/L组25 μmol/L组50 μmol/L组100 μmol/L组F HKⅡ1.00±0.11 0.93±0.07 0.75±0.07ab 0.56±0.06abc 0.69±0.05ab 28.603*PKM2 1.00±0.12 0.96±0.09 0.71±0.06ab 0.51±0.06abc 0.61±0.04ab 36.965*GLUT1 1.00±0.10 0.89±0.05 0.66±0.07ab 0.43±0.04abc 0.59±0.05abd 61.558*
2.5 各组细胞增殖活性比较 各组细胞增殖活性均随时间基本呈增高趋势。0 h 和12 h 时各组间差异无统计学意义;24、48 和72 h 时,对照组、Vit B2组、阿帕替尼组和联合用药组胃癌细胞增殖活性依次降低,组间多重比较差异均有统计学意义(P<0.05),见表5。
2.6 各组胃癌细胞凋亡率比较 对照组、Vit B2组、阿帕替尼组和联合用药组胃癌细胞凋亡率依次升高,组间多重比较差异均有统计学意义(P<0.05),见图1、2。
Tab.5 Comparison of cell proliferation activities between four groups表5 各组细胞增殖活性的比较 (n=5,OD值,)
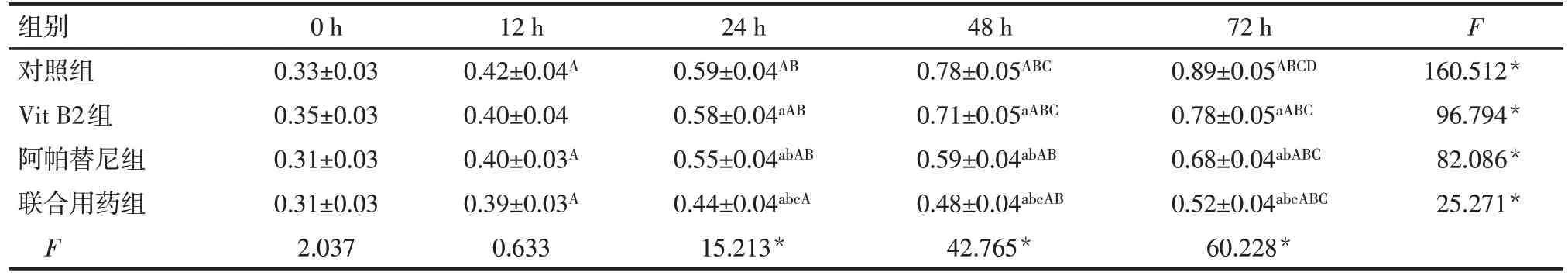
Tab.5 Comparison of cell proliferation activities between four groups表5 各组细胞增殖活性的比较 (n=5,OD值,)
*P<0.05;F组间=93.270,F时间=335.300,F交互=14.590,均P<0.05;组间比较:a与对照组比较,b与Vit B2组比较,c与阿帕替尼组比较,P<0.05;组内比较:A与0 h比较,B与12 h比较,C与24 h比较,D与48 h比较,P<0.05
组别对照组Vit B2组阿帕替尼组联合用药组F 0 h 0.33±0.03 0.35±0.03 0.31±0.03 0.31±0.03 2.037 12 h 0.42±0.04A 0.40±0.04 0.40±0.03A 0.39±0.03A 0.633 24 h 0.59±0.04AB 0.58±0.04aAB 0.55±0.04abAB 0.44±0.04abcA 15.213*48 h 0.78±0.05ABC 0.71±0.05aABC 0.59±0.04abAB 0.48±0.04abcAB 42.765*72 h 0.89±0.05ABCD 0.78±0.05aABC 0.68±0.04abABC 0.52±0.04abcABC 60.228*F 160.512*96.794*82.086*25.271*
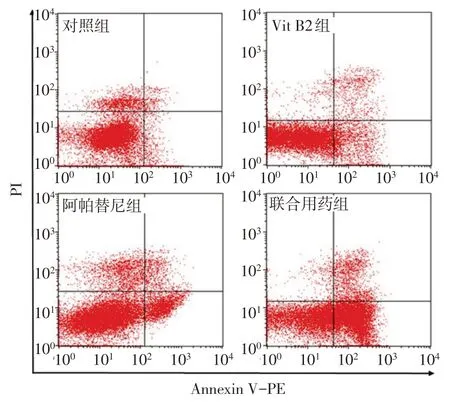
Fig.1 The apoptosis detected by flow cytometry图1 流式细胞术检测各组细胞凋亡情况
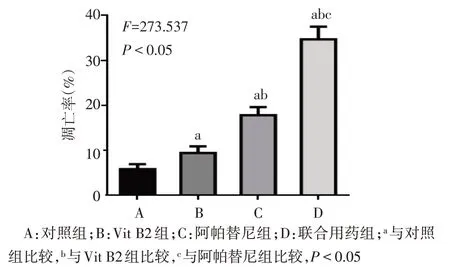
Fig.2 Comparison of apoptosis rate between four groups of cells图2 4组细胞凋亡率比较
3 讨论
哺乳动物肠道内的微生物可合成少量Vit B2,但机体所需的大部分Vit B2 仍需要从食物中获得。在体内,Vit B2 主要有黄素腺嘌呤二核苷酸和黄素单核苷酸2 种形式,为细胞氧化磷酸化反应链中重要的辅因子,与细胞代谢和能量供应密切相关。流行病学研究显示,在食管癌高发地区,居民膳食Vit B2 摄入量显著低于正常水平,且通过补充Vit B2 可显著降低该地食管癌的发生率,提高患者的生存率[5]。此外,有研究指出,高Vit B2摄入可将胃癌的发病风险降低65%[12]。上述研究表明,Vit B2 具有潜在的抗肿瘤效应。但Vit B2在胃癌致病过程中的具体作用尚鲜见报道。本研究结果显示,胃癌患者血清Vit B2 水平显著低于对照组,且血清Vit B2 水平与胃癌患者的TNM 分期和分化程度相关,提示Vit B2可能在胃癌的致病过程中发挥重要作用。
正常细胞的能量供应主要以消耗葡萄糖进行有氧氧化磷酸化为主,这种方式效率高,几乎不产生乳酸。而肿瘤细胞则明显不同,主要以消耗葡萄糖进行糖酵解为主,同时产生大量的乳酸[13-14]。研究表明,肿瘤细胞糖酵解显著增强,而氧化磷酸化功能则明显降低[14-15]。HKⅡ和PKM2是肿瘤细胞的糖酵解代谢的主要限速酶,GLUT1 也是将葡萄糖转运入肿瘤细胞的关键酶[16-17]。琥珀酸脱氢酶是连接氧化磷酸化和线粒体呼吸链的枢纽之一,可作为评价氧化磷酸化的指标。研究表明,Vit B2 缺乏可以降低肝癌HepG2 细胞氧化磷酸化水平,通过加快葡萄糖消耗和产生大量乳酸,促进肝癌细胞的增殖活性[18]。本研究结果显示,25、50、100 μmol/L Vit B2 组葡萄糖消耗量和乳酸生成量均低于0 μmol/L Vit B2 组,琥珀酸脱氢酶含量均高于0 μmol/L Vit B2组;另外,25、50、100 μmol/L Vit B2 组细胞HKⅡ、PKM2和GLUT1mRNA 水平均低于 0 μmol/L Vit B2 组。提示补充Vit B2 可上调琥珀酸脱氢酶的活性,降低葡萄糖消耗量和乳酸生成量;且其作用机制可能与下调胃癌细胞HKⅡ、PKM2和GLUT1的表达水平有关。另外,50 μmol/L Vit B2组葡萄糖消耗量和乳酸生成量最低,且50 μmol/L Vit B2组GLUT1mRNA水平最低。故选择50 μmol/L 维生素这一浓度进行后续实验。
阿帕替尼通过抑制肿瘤血管生成,发挥抗肿瘤效应[10,19]。2014 年,阿帕替尼获得国家食品药品监督管理总局批准上市,主要用于晚期胃癌的治疗。但是,单一用药可提高机体产生抗药性的概率,削弱药物的疗效,而合理的联合用药可以提高抗肿瘤的疗效或减轻不良反应。目前临床已将阿帕替尼与其他药物联合应用,并得到较好的治疗效果[10-11,20]。本研究结果表明,单独使用Vit B2 虽可抑制胃癌细胞增殖,促进胃癌细胞凋亡,但效果不及阿帕替尼。此外,Vit B2 和阿帕替尼联合应用可显著抑制胃癌细胞增殖,诱导胃癌细胞凋亡,其抗肿瘤效果优于单独使用Vit B2或阿帕替尼。
综上所述,胃癌患者血Vit B2水平降低,且与胃癌的TNM 分期和分化程度密切相关;Vit B2 与阿帕替尼联合用药可提高其对胃癌的抗肿瘤效果。
