甲状腺乳头状癌中PBX3和PTEN的表达及其临床意义
2020-09-21曹学全阮正英魏科娜卢洪胜蔡小波戴岳楚周璐青顾华敏
曹学全 阮正英 魏科娜 卢洪胜 蔡小波 戴岳楚 周璐青 顾华敏
甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是内分泌系统最常见的恶性肿瘤,约占甲状腺癌的80%,大多数患者预后良好[1]。然而,10%~15%的PTC表现有侵袭性,容易复发、转移并导致患者死亡。因此,阐明PTC的分子机制可能有助于发现新的治疗靶点[2-3]。前B细胞白血病同源盒基因3(pre-B-cell leukemia homeobox gene 3,PBX3)是PBX家族的一个含有同源结构域的转录因子,在四肢、心脏等早期发育和细胞周期调控、维持胚胎干细胞未分化状态等过程中具有广泛的作用[4]。进一步研究表明,PBX3在胃癌[5]、肝细胞癌[6]和多发性骨髓瘤[7]等多种恶性肿瘤中存在过表达,且上调PBX3可促进肿瘤细胞增殖、侵袭、迁移、细胞周期进展等恶性生物学行为。第10号染色体缺失的磷酸酶和张力蛋白同源物基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)通过去磷酸化磷脂酰肌醇(3,4,5)-三磷酸(PIP3)负性调节磷脂酰肌醇 3 激酶/蛋白激酶 B(PI3K/Akt)信号通路[8],是一种重要的抑癌基因,在抑制肿瘤发生中发挥重要作用[9]。PTC中PBX3和PTEN表达是否存在相关性及PBX3表达与临床病理特征的关系尚不清楚。本研究采用免疫组化En Vision二步法检测PTC组织和癌旁正常甲状腺组织中PBX3和PTEN的表达,分析两者表达的特点及相关性,探讨PBX3和PTEN表达改变与PTC发生、侵袭、转移的关系及临床意义。
1 对象和方法
1.1 对象 选取2017年1月至2018年1月在台州市中心医院(台州学院附属医院)住院行手术切除和石蜡包埋的PTC标本80例,术后常规病理诊断结果为PTC。所有患者术前均未接受放疗、化疗及生物学治疗。80例PTC患者中,男26例,女54例;年龄21~77(45.37±12.04)岁,其中<55岁 59例,≥55岁 21例;肿瘤直径≤2 cm 56例,>2 cm 24例;伴有包膜侵犯28例,无包膜侵犯52例;伴有淋巴结转移47例,无淋巴结转移33例;参照2018年第8版美国癌症联合委员会(AJCC)/国际抗癌联合会(UICC)制定的甲状腺癌分期标准进行TNM分期:Ⅰ~Ⅱ期68例,Ⅲ~Ⅳ期12例。并选取癌旁正常甲状腺组织(距离肿瘤≥2 cm)30例作为对照,经病理诊断均为正常甲状腺组织。本研究经医院医学伦理委员会审查通过,所有患者均知情同意。
1.2 主要试剂 PBX3兔抗人多克隆抗体购自美国Santa Cruz公司,PTEN鼠抗人单克隆抗体、En Vision通用试剂盒及二氨基联苯胺(DAB)均购自福州迈新生物技术有限公司。
1.3 PTC组织和癌旁组织中PBX3和PTEN蛋白表达检测 采用免疫组化En Vision二步法。制作4 μm厚的石蜡切片,常规脱蜡至水。3% H2O2室温孵育阻断内源性过氧化物酶的活性,0.1 mmol/L枸橼酸盐缓冲液高压水浴抗原修复,1%山羊血清封闭,滴加一抗(PBX3稀释浓度为 1∶200,PTEN 为 1∶100)4 ℃冰箱过夜,第 2天滴加二抗(EnVision免疫组化检测试剂),DAB显色,苏木素复染、盐酸分化、梯度乙醇脱水、二甲苯透明和树胶封片,显微镜下观察PBX3和PTEN蛋白表达特点和阳性定位。以PBS代替一抗作阴性对照,PBX3用前列腺癌组织作阳性对照,PTEN用乳腺癌组织作为阳性对照。
1.4 结果判定 阳性细胞表现为淡黄色至棕褐色颗粒,PBX3阳性表达定位于细胞质,PTEN阳性表达定位于细胞核或细胞质。在光学显微镜下,每张切片随机选取至少5个高倍视野(×400),每个视野计数200个细胞进行评分和记录。每张切片根据半定量积分法进行判定,最终积分=染色强度和阳性细胞百分比的乘积。染色强度:无显色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞百分比:<10%为0分,10%~25%为1分,>25%~50%为 2分,>50%~75%为 3分,>75%为4分。最终积分<3分为阴性,≥3分为阳性。
1.5 统计学处理 采用SPSS 19.0统计软件。计数资料组间比较采用χ2检验,PBX3和PTEN蛋白表达的相关性分析采用Spearman等级相关。P<0.05为差异有统计学意义。
2 结果
2.1 PTC组织和癌旁组织中 PBX3、PTEN的表达PTC组织中PBX3阳性表达率为73.75%(59/80),高于癌旁组织的16.67%(5/30),差异有统计学意义(χ2=29.220,P<0.05);PTC 组织中 PTEN 阳性表达率为35.00%(28/80),低于癌旁组织的 83.33%(25/30),差异有统计学意义(χ2=20.415,P<0.05),见图 1(插页)。
2.2 PTC组织中PBX3、PTEN阳性表达与临床病理特征的关系 包膜侵犯、淋巴结转移和Ⅲ~Ⅳ期的PTC组织中PBX3阳性表达率分别高于无包膜侵犯、无淋巴结转移和Ⅰ~Ⅱ期的PTC组织,差异均有统计学意义(均P<0.05),而不同性别、年龄和肿瘤直径PTC组织中PBX3阳性表达率比较差异均无统计学意义(均P>0.05)。包膜侵犯、淋巴结转移和Ⅲ~Ⅳ期的PTC组织中PTEN阳性表达率分别低于无包膜侵犯、无淋巴结转移和Ⅰ~Ⅱ期的PTC组织,差异均有统计学意义(均P<0.05),而不同性别、年龄和肿瘤直径PTC组织中PTEN阳性表达率比较差异均无统计学意义(均P>0.05),见表1。

表1 PTC组织中PBX3、PTEN阳性表达与临床病理特征的关系[例(%)]
2.3 PTC组织中 PBX3、PTEN蛋白表达的相关性Spearman等级相关分析显示PTC组织中PBX3、PTEN蛋白表达呈负相关(r=-0.337,P<0.05),见表 2。
3 讨论
PBX3是PBX家族中的一个重要的转录因子,具有高度保守的同源结构域,通过与其他同源蛋白相互作用及序列5′-ATCAATCA-3′结合,导致转录激活或靶基因沉默[9-10]。近年研究显示,PBX3在一些实体肿瘤及血液系统恶性肿瘤中的作用及分子机制已经成为国内外学者研究的热点。据报道,在核仁磷酸蛋白1(nucle-ophosmin1,NPM1)突变的急性髓系白血病中,PBX3受同源框蛋白 A9(homeobox protein A9,HOXA9)的调控,特别是当HOXA9上调或下调时,PBX3的表达增加或减少。尽管HOXA9的表达不受PBX3的限制,但PBX3或HOXA9的丢失都会导致细胞凋亡,表明上调PBX3和HOXA9表达对NPM1突变细胞的存活至关重要[11]。生存分析显示,高表达的HOXA9或PBX3与胃癌的低生存率相关,Cox回归模型的多因素分析显示PBX3表达是胃癌独立的预后因素[12]。表明PBX3和其他同源蛋白通过调控作用在血液肿瘤及实体肿瘤中过表达,且与肿瘤的发生和预后相关。Li等[13]发现,宫颈癌细胞系及组织中PBX3表达上调,其表达与肿瘤直径、病理分级、淋巴结转移、浸润深度、血管浸润和临床分期有关。PBX3可以通过Akt信号通路促进宫颈癌细胞增殖,并且可以作为预后的标志物。本研究结果显示,PTC组织中PBX3阳性表达率高于癌旁组织,提示PBX3表达上调可能与PTC滤泡上皮癌变的发生有关。包膜侵犯、淋巴结转移和Ⅲ~Ⅳ期的PTC组织中PBX3阳性表达率分别高于无包膜侵犯、无淋巴结转移和Ⅰ~Ⅱ期的PTC组织,差异均有统计学意义。表明PBX3过表达与PTC的包膜侵犯、淋巴结转移和高的临床分期密切相关。而PBX3表达与PTC的直径无关,与Li等[13]在宫颈癌中的研究结果不一致,可能与不同的肿瘤类型或样本量少有关。
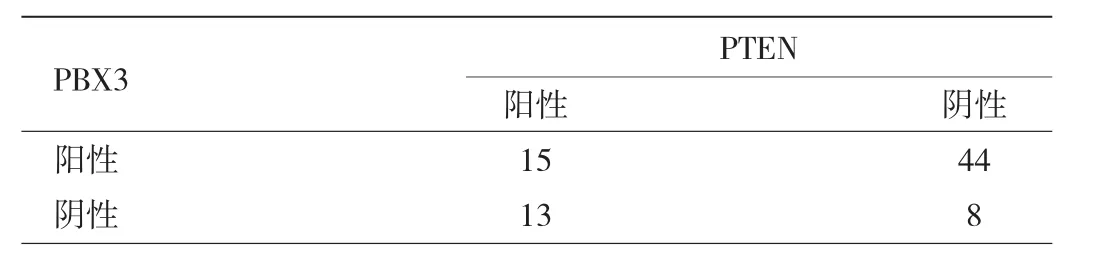
表2 PTC组织中PBX3、PTEN蛋白表达的相关性(例)
PTEN是第一个报道的具有磷酸酶活性的抑癌基因,是继p53和视网膜母细胞瘤基因之后与肿瘤发生密切相关的抑癌基因,它通过阻断PI3K/Akt信号通路调节细胞周期、抑制细胞增殖、促进细胞凋亡[14-15]。PTEN丢失可引起Akt介导的磷酸化和NF-κB活性增加,从而促进p53降解。p53降解降低了细胞凋亡能力并诱导了细胞周期进程[15]。Windarti等[16]对7项研究进行了系统评价,然后通过Meta分析评估PTEN丢失与乳腺癌预后的相关性。发现PTEN丢失与乳腺癌预后不良之间存在相关性,并且纳入的研究没有明显的偏倚。该研究证实PTEN丢失是乳腺癌重要的独立预后因素。本研究显示,PTC组织中PTEN阳性表达率低于癌旁组织,且包膜侵犯、淋巴结转移和Ⅲ~Ⅳ期的PTC组织中PBX3阳性表达率分别低于无包膜侵犯、无淋巴结转移和Ⅰ~Ⅱ期的PTC组织,差异均有统计学意义。提示PTEN表达缺失或低表达在PTC发生、侵袭和转移过程中起促进作用,采用免疫组化检测PTEN蛋白表达特点可用于判断PTC的侵袭、转移能力。
PBX3和PTEN在PTC中的关系如何,目前尚不清楚。本研究采用Spearman等级相关分析从蛋白水平探讨PTC中PBX3和PTEN表达的相关性,发现PBX3高表达,而PTEN低表达,两者表达呈负相关,且与PTC的包膜侵犯、淋巴结转移和临床分期密切相关。综合以上研究结果,PBX3和PTEN异常表达可能在PTC发生、侵袭、转移的过程中起负向调控作用,两者有望成为PTC诊断、预后评估及靶向治疗的生物学指标。
