组蛋白去乙酰化酶抑制剂(HDACi)逆转非小细胞肺癌耐药性的新进展
2020-09-21孟萌李红玲李凤丽
孟萌,李红玲,李凤丽*
(1.天津中医药大学第一附属医院,天津 300193;2.辽宁省凌源市中心医院,辽宁 122500)
当前,在全球范围内肺癌仍是常见的威胁人类健康的恶性肿瘤之一[1-3]。非小细胞肺癌(NSCLC)占肺癌总数的近85%~90%,即使患者对常规化学疗法处于良好反应状态下,总体生存时间为也仅为8~12个月[4,5]。 随着现代肿瘤分子生物学及精准医学的发展,NSCLC可以根据驱动肿瘤发生的特定基因突变、融合的精确分子进行分类,如:EGFR、KRAS、ALK、HER2、BRAF、NRAS等[6]。目前非小细胞肺癌治疗方法主要包括基于铂类的常规化疗,基于精准信号分子的靶向治疗以及基于PD-1/PD-L1免疫检查点的免疫治疗。但越来越多的研究证据表明非小细胞肺癌获得性耐药的产生限制了这些疗法的临床疗效[7-10]。因此,深入研究NSCLC对化疗耐药、靶向治疗耐药以及免疫治疗耐药的分子机制有助于寻找新的分子靶点、新策略以有效克服或逆转非小细胞肺癌获得性耐药[11-13]。
近年来研究发现,组蛋白去乙酰化酶抑制剂(HDCAi)能够显著逆转非小细胞肺癌的获得性耐药,包括对常规化疗、分子靶向治疗以及肿瘤免疫治疗的获得性耐药均展现出潜在的逆转活性。组蛋白乙酰化与DNA甲基化是基因表观遗传调控的主要方式。其中,组蛋白乙酰化途径在多种类型的肿瘤的发生、发展及转移等恶性表型中发挥重要作用,并受组蛋白乙酰基转移酶(histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)两类酶调节[14-16]。组蛋白去乙酰化酶抑制剂(HDAC inhibitors,HDACi)可以通过改变细胞内组蛋白乙酰化程度改变染色质空间结构、染色体重塑,从而抑制目的基因转录,对肿瘤发生、耐药起到关键作用[17]。在此,本文对组蛋白去乙酰化酶家族及其抑制剂、基于HDACi逆转非小细胞肺癌铂类化疗耐药、精准靶向治疗耐药、肿瘤免疫治疗耐药等4个方面予以总结。
1 人组蛋白去乙酰化酶的分类及其抑制剂
目前,根据丝氨酸结合位点、MEF2结合结构域、乙酰化结构域以及核定位、输出结构域等将人组蛋白去乙酰化酶分为Ⅰ、Ⅱ(ⅡA和ⅡB)、Ⅲ和Ⅳ四类。Ⅰ型由HDAC1、2、3、8 组成。ⅡA 型包括 HDAC4、5、7、9;ⅡB型包括HDAC6、10;Ⅲ型为NAD+依赖型组蛋白去乙酰化酶,包括SITR1-7;Ⅳ型只有一种,即HDAC11(如图1所示)[18]。其中Ⅰ型、ⅡA型、ⅡB型以及Ⅳ型属于锌依赖型,Ⅲ型为NAD+依赖型组蛋白去乙酰化酶。
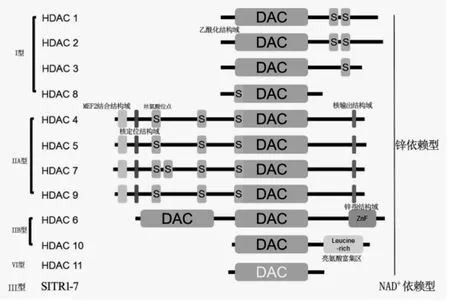
图1 人组蛋白去乙酰化酶的结构与分类
鉴于组蛋白去乙酰化酶在肿瘤发生、发展、侵袭及耐药等生物学功能中发挥重要的作用,研究人员开发出一系列的组蛋白去乙酰化酶抑制剂(HDACi),主要如下:①伏立诺他(vorinostat,SAHA)于2006年第一个被美国FDA批准上市的广谱HDAC抑制剂,用于治疗皮肤 T细胞淋巴瘤[19];②罗米地辛(romidepsin,FK228)于2009年和2011年先后被FDA批准用于治疗皮肤T细胞淋巴瘤和外周T细胞淋巴瘤[20-22];③贝利司他(belinostat,PXD101)2014年被FDA批准用于治疗外周T细胞淋巴瘤[23,24]。这些抑制剂大多都是针对第Ⅰ、Ⅱ和Ⅳ型HDAC的广谱HDAC抑制剂;④短链脂肪酸类的butyrate针对Ⅰ型HDAC和ⅡA型 HDAC[25];⑤苯甲酰胺类的entinostat针对Ⅰ型HDAC亚型[26];⑥异羟肟酸类抑制剂tubacin只有少部分是选择性HDAC6 抑制剂[27];⑦西达本胺(chidamide)是由中国自主研发的新型HDAC抑制剂,选择性针对亚型HDAC1-3及HDAC10,被批准用于治疗外周T细胞淋巴瘤[28];⑧panobinostat(LBH589)为泛组蛋白去乙酰化酶抑制剂于2015年被FDA批准治疗多发性骨髓瘤[29];⑨CUDC-101作为组蛋白去乙酰化酶抑制剂已开展头颈部鳞癌的临床实验[30];(⑩tacedinaline(CI994),已开展针对多发性骨髓瘤和肺癌的临床试验[31];11○Ⅲ型组蛋白去乙酰化酶sirtuin家族是一类NAD+依赖型,其结构及作用机制与其他3种典型的HDAC完全不同。目前对sirtuin蛋白抑制剂的研究相对较少,大部分抑制剂是针对SIRT1和SIRT2的去乙酰化酶活性抑制,也有少量抑制剂能够抑制SIRT3和SIRT5的酶活性。sirtuin抑制剂主要包括:烟酰胺、sirtinol、splitomicin、cambinol及 suramin 等[32]。
2 基于HDACi逆转非小细胞肺癌对铂类常规化疗耐药
尽管铂类疗法仍是非小细胞肺癌的标准治疗方法之一,但是肺癌患者的临床反应率与临床疗效非常有限。其中,非小细胞肺癌(NSCLC)肺癌细胞获得性耐药的产生是NSCLC化疗失败的主要原因之一。越来越多的研究证据表明表观遗传学改变(组蛋白去乙酰化酶修饰)与肺癌的耐药性与侵袭行为密切相关。研究显示两种顺铂耐药NSCLC细胞系(H460/Pt和A549/Pt)胞系与亲代细胞(H460和A549)相比,铂类耐药细胞表现出较强的侵袭特性,这可能与组蛋白去乙酰化酶活性有关。组蛋白去乙酰化酶抑制剂SAHA和ST3595有效抑制顺铂耐药肺癌细胞的侵袭能力,ST3595的作用更强。进一步研究发现两种HDAC抑制剂均在mRNA水平上调转移抑制因子KiSS1。KiSS1上调显着降低了顺铂肺癌耐药细胞的侵袭能力。研究显示,HDAC抑制剂通过上调KiSS1的机制来逆转顺铂肺癌耐药细胞的耐药特性与侵袭能力[33]。
此外,另一项研究表明顺铂而非紫杉醇和阿霉素能诱导癌症干细胞(CSC)的富集,并导致NSCLC细胞产生多药耐药表型。在体内模型研究证实,具有多药耐药特性的非小细胞肺癌中CSC转录因子表达上调。机制研究表明,顺铂导致C/EBP-β依赖性上调TRIB1表达,通过基因沉默实验证实TRIB1在顺铂诱导的CSC富集和耐药中的关键作用。值得注意的是,顺铂治疗也促进了HDAC表达与活性的增加,从而使TRIB1与HDAC相互作用导致p53失活。同样,HDAC沉默导致顺铂诱导的CSC降低,同时敲除HDAC和TRIB1表现出显著的协同作用。另外,在NSCLC细胞模型中HDAC抑制剂和顺铂联合用药以TRIB1依赖性方式协同抗肿瘤作用,并在非小细胞肺癌体内模型中限制降低肿瘤的大小。可见,靶向抑制组蛋白去乙酰化酶联合顺铂治疗为克服非小细胞肺癌耐药性提供了新的思路与方法[34]。
越来越多的证据表明组蛋白脱乙酰基酶(HDACs)的异常表达是多种肿瘤的重要标志之一,并介导肿瘤细胞对细胞毒为基础常规化学疗法的耐药性的产生。研究发现panobinostat(LBH589,一种有效的pan-HDAC抑制剂)与卡铂联合用药在体内、外模型中均可有效杀伤对EGFR-TKI交叉耐药的肺癌细胞,促使肺癌细胞对卡铂化疗敏感性增强[35]。
3 基于HDACi逆转非小细胞肺癌对精准分子靶向治疗耐药的分子机制
基于驱动NSCLC基因组改变并导致肿瘤发生的主要肿瘤生物学事件包括EGFR、KRAS突变和各种ALK融合突变等,NSCLC对精准靶向治疗所产的获得性耐药的机制各异,而组蛋白去乙酰化酶抑制剂能逆转NSCLC精准靶向治疗的耐药性。
3.1 表皮生长因子受体(EGFR)基因突变 表皮生长因子受体(EGFR)基因突变是东亚人群NSCLC最常见的驱动基因突变之一,发生率为30%~40%[36]。表皮生长因子受体-酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors,EGFR-TKIs)单药治疗是EGFR基因突变晚期NSCLC患者的标准治疗方案,但大多数患者会在用药后9~14个月产生耐药,其中EGFR基因第20号外显子发生错义突变(即T790M突变)是第一代TKI耐药突变中最主要的类型[37]。因此,研究人员又开发了第二代、第三代的EGFR-TKIs,但耐药的问题依然存在[38]。研究显示,EGFR T790M突变耐药与旁路激活、下游信号的上调、其他位点的突变、小细胞肺癌转化等有关。三代EGFR-TKIs耐药的可能机制包括EGFR C797S突变伴随MET基因扩增[39],以及除C797S的其他EGFR获得性罕见突变,HER2、KRAS、PIK3CA基因扩增等。如何克服患者EGFR-TKI耐药并提高疗效成为肺癌治疗领域的当前的研究热点。最新研究表明,HDAC抑制剂Panobinostat(LBH589)能有效克服非小细胞肺癌对第三代EGFR-TKI(osimertinib,奥西替尼)产生的获得性耐药。LBH589和奥西替尼联合用药能协同降低不同的奥西替尼耐药细胞系(包括具有C797S突变的细胞系)的存活率,并显著抑制肺癌耐药细胞集落形成与生长。LBH589靶向抑制组蛋白去乙酰化酶联合奥西替尼能增强对非小细胞肺癌对奥西替尼耐药细胞诱导凋亡。重要的是,LBH589与奥西替尼合用后有效抑制了肺癌耐奥西替尼细胞裸鼠异种移植瘤的生长。机制研究表明,LBH589和奥西替尼合用能增强奥西替尼耐药肺癌细胞中Bim的升高。Bim升高对于该组合在诱导奥西替尼耐药细胞凋亡中的关键作用。组蛋白去乙酰化酶抑制剂LBH589在临床前模型中显著逆转非小细胞肺癌对第三代在EGFR-TKI的获得性耐药性,并具潜在临床上克服奥西替尼耐药性[40]。Azusa Tanimoto[41]等研究发现HDAC3选择性抑制剂能够逆转BIM缺失导致的EGFR-TKI耐药,因而认为HDACs可以作为肺癌EGFR-TKI耐药治疗的有效靶点。
3.2 表皮生长因子受体2 表皮生长因子受体2(HER2)无天然配体,但有跨膜区和胞内酪氨酸激酶区,可与家族其他成员形成二聚体发挥生物学功能,HER2胞内段酪氨酸激酶拥有最高的催化活性,形成异二聚体受体后可以通过MAPK或PI3K信号通路对肿瘤细胞的增殖、分化发挥调节作用[42,43]。在所有 NSCLC 病理类型中,HER2 阳性率最高,可达 17%~42%[44]。HER2 基因扩增及蛋白过表达被认为与NSCLC预后不良及EGFR-TKIs耐药相关[45]。有研究证实HER2基因20号外显子突变,如非移码插入性突变(A775YVMA)所引起的ATP结合位点蛋白构象改变被认为与EGFRTKIs耐药相关[46]。值得注意的是,约 10%~50%的NSCLC患者同时存在EGFR及HER2过表达,这部分患者癌症复发可能性更高,总生存(OS)更短[47]。 临床上同一分期、同一病理类型、采用同一治疗方案的恶性肿瘤患者,其疗效及预后却常常明显不同。研究显示疗效、预后及实际转移情况的差异可归因于个体的分子生物学改变的差异。当今肺癌临床诊治过程中,需要从分子水平寻找相关标志物,建立系统有效的疗效判别、预后预测、分子分期诊断(临床分期基础上的预后亚型细分)等检测体系,真正实现根据个体功能基因组学改变而制定肺癌的个体化治疗方案。新型多靶点HDAC抑制剂CUDC-101可以同时抑制组蛋白去乙酰化酶(HDAC)、EGFR以及HER2,还能减少血管生成和调节免疫系统,具有潜在的临床应用价值[48,49]。因此多靶点HDAC抑制剂CUDC-101为结构母核的新型靶向治疗药物研究正在积极开展。在EGFR-TKI耐药的NSCLC细胞,组蛋白去乙酰化酶抑制剂YF454A和埃洛替尼通过阻断细胞周期并诱导细胞凋亡,在抑制细胞生长方面显示出强大的协同作用。与单独的单一药物相比,联合治疗导致肿瘤生长和肿瘤重量显著降低。这种联合疗法在转录和蛋白质水平上均显著下调了几种关键的EGFR-TKI耐药相关受体酪氨酸激酶的表达,例如 Her2、c-Met、IGF1R 和 AXL,从而阻断了下游激活分子Akt和ERK。转录组谱分析进一步显示,YF454A和埃洛替尼协同抑制细胞周期途径,并降低细胞周期相关基因(如MSH6和MCM7)的转录[50]。
3.3 KRAS突变 尽管针对EGFR和ALK精准治疗取得一定的疗效,但对于具有KRAS突变的患者尚无有效的治疗方案。研究表明,RAS-ERK通路调控FOXO3a蛋白的稳定性和定位,而FOXO3a蛋白是细胞死亡和细胞周期的重要调节因子。主要调节凋亡蛋白BIM、FASL及细胞周期调控分子p21Cip1、p27Kip1。研究显示,HDAC抑制剂会影响FOXO3a蛋白的表达和定位,与MEK抑制剂合用后增加NSCLC对KRAS突变的敏感性。在RAS突变的肺癌细胞,MEK抑制剂和HDAC抑制剂的联合用药能靶向抑制FOXO3a活化介导的细胞代谢活性,产生协同作用,进而上调BIM和细胞周期抑制因子。在体内模型中,贝利司他和曲美替尼合用后显著诱导BIM和细胞周期抑制因子p21Cip1、p27Kip1,下调FOXO3a所导致的肿瘤形成。可见,靶向MEK、HDAC双重分子有望作为KRAS突变群体的NSCLC 治疗的新策略[51]。
4 基于HDACi逆转非小细胞肺癌免疫治疗耐药性
组蛋白去乙酰化酶抑制剂能增强neratinib与抗PD-1抗体联合用药的抗非小细胞肺癌活性。机制研究表明,neratinib和HDAC抑制剂联用后通过自噬作用下调多种HDAC蛋白表达,同时导致PD-L1、PD-L2表达降低。在非小细胞肺癌neratinib与HDAC抑制剂联用可有助于激活进抗肿瘤免疫反应[52]。肿瘤免疫检查点抑制剂治疗可用于非小细胞肺癌(NSCLC)治疗。然而,仍有相当大比例的患者没有治疗反应或产生耐药性。研究显示,潜在的免疫治疗耐药机制包括:缺乏程序性死亡配体1(PD-L1)表达;肿瘤抗原表达能力下降;存在抑制免疫的肿瘤微环境。mocetinostat是Ⅰ/Ⅳ型HDACs的选择性抑制剂,这是一类与肿瘤和免疫细胞免疫调节基因表观遗传沉默有关的蛋白质家族。在NSCLC模型中,mocetinostat增强PD-L1和抗原呈递。mocetinostat能减少肿瘤内T调节细胞(Tregs)和潜在的骨髓衍生抑制细胞(MDSC)种群,并上调肿瘤内CD8+种群。在活体检测中,经治疗患者的Tregs也显示出对FOXP3和HELIOS的显著降低调节。mocetinostat调节肿瘤细胞中的免疫相关基因及肿瘤微环境中的免疫细胞类型,增强检查点抑制剂治疗,克服免疫治疗耐药性[53]。
5 小结
本文围绕组蛋白去乙酰酶的结构、组成及基于组蛋白去乙酰化酶抑制剂克服非小细胞肺癌耐药的分子机制,分别探讨了HDACi在非小细胞肺癌对铂类基础的常规化疗、精准分子靶向治疗以及基于免疫检查点PD-1/PD-L1基础的免疫治疗的耐药性(图2),探索靶向表观遗传调控增强化疗、靶向治疗或免疫治疗的敏感性,克服肺癌细胞耐药作用与机理,为克服肺癌多药耐药、EGFR T790M突变耐药、肿瘤免疫耐药等获得性耐药提供新的理论基础与实验依据,为肺癌精准治疗提供新的策略与思路。

图2 HDACi逆转非小细胞肺癌耐药策略
