HL-60/IL-6体外热原检测方法学研究及对细胞治疗产品的适用性考查
2020-09-21华晓东
王 冲,徐 琳,华晓东
(天津市药品检验研究院,天津 300070)
细胞治疗产品主要分为干细胞及免疫细胞治疗产品两大类,作为近年来国际医学的前沿发展领域,在治疗和缓解恶性肿瘤、严重创伤等疑难杂症方面,表现出了其他方法无法企及的疗效,具有广阔的应用前景和巨大的商业价值[1]。热原系指能引起恒温动物体温异常升高的致热物质,主要包括细菌性热原、内源性高分子热原、内源性低分子热原及化学热原等。作为非肠道类给予的药物,热原为《中国药典》规定必须的检测项目[2]。细胞治疗产品在回输患者时,发热反应为最常见的不良反应之一,此现象为肌体免疫机制所致,临床医生也可以根据患者发热情况预估对治疗产品的疗效[3]。因此,此类产品对于控制热原物质的要求尤为突出,否则不但会引起发热效应的叠加,造成严重临床反应,还会干扰临床医生的判断。
家兔法为热原检测的“金标准”,但对于本类产品,却存在种属差异及检品用量大等明显的不适用性。现行版《细胞治疗产品研究与评价技术指导原则》中推荐使用的细菌内毒素法也面临仅对革兰阴性菌敏感、鲎试剂资源紧缺等问题。近年来,各国相继开展新的热原检测方法的研究,单核细胞活化反应测定法(monocyte activation test,MAT)已被《英国药典》和《欧洲药典》收载,但该方法中所载人全血和人外周血法对人血的要求较高,且来源困难;而细胞系法中推荐的MM6和THP-1细胞株在国内又无法获得,限制了MAT法在国内的推广和使用[4]。本文报道人早幼粒白血病细胞株(HL-60)体外热原检测方法,并对相关影响因素进行考查,选取部分细胞治疗产品进行适用性研究,以期为细胞治疗产品建立一种新的热原检测途径。
1 仪器与试药
1.1 仪器 酶标仪,型号SpectiaMax M2,Molecular Devices公司生产;离心机,型号VELOCITY 18R,Dynamica公司生产;Attune NxT流式细胞仪,life technologies公司生产。
1.2 试药 人间充质干细胞(骨髓及脂肪来源MSC)、人树突细胞(DC)、T细胞和嵌合CD19抗原的T细胞(CAR-T)均由天津现代医药开发研究所提供;热原标准物质(细菌内毒素国家标准品,批号150800-201601,规格:9 000 EU/支,中国食品药品检定研究院);细菌内毒素检查用水(批号1708090,规格:50 ml/瓶,湛江安度斯生物有限公司);胎牛血清(FBS,批号 20170420,规格:100 ml/瓶,杭州天杭生物科技股份有限公司);IMDM 培养基(批号 2003791,规格:500 ml/瓶,Biological Industries公司);人IL-6 ELISA试剂盒(批号1807-4,规格:96 T,达科为公司);CD3-APC抗体(批号201808004,规格:2.0 ml/100 T,天津旷博协和生物技术有限公司);CD3-IgG抗体(批号201801052,规格:2.0 ml/100 T,天津旷博协和生物技术有限公司);FITC AnnexinV/Dead Cell凋亡试剂盒(批号1809491,规格:100 T,invitrogen公司)。
1.3 细胞株 人早幼粒白血病细胞株(HL-60)购自中科院上海细胞库,以含20%FBS的IMDM培养基培养,定期传代。
2 方法
2.1 标准曲线的初步建立参考文献报道的方法[5,6],取处于对数生长期的HL-60细胞,1 000 r/min离心5 min,以维持培养基(含2%FBS的IMDM培养基)洗涤1次,重悬后调整至浓度为5×106个/ml的细胞悬液,接种于96孔细胞培养板中,每孔100 μl。细菌内毒素国家标准品作为热原标准品,取1支用1 ml细菌内毒素检测用水复溶,涡旋混合器混合30 min。用维持培养基依次稀释为 0、0.06、0.125、0.25、0.5、1、2及4 EU/ml,每稀释一步需在涡旋混合器上混匀30 s,取100 μl加入96孔培养板内与细胞混合均匀,至终浓度分别为 0、0.03、0.06、0.125、0.25、0.5、1 及 2 EU/ml的热原标准品溶液,每个浓度平行4孔。于37℃、5%二氧化碳条件下培养24 h,1 200 r/min离心5 min,取上清液按照ELISA试剂盒中方法测定IL-6含量。以热原标准品浓度为横坐标,以IL-6吸光度值(A)为纵坐标,拟合标准曲线。
2.2 标准曲线相关影响因素考查
2.2.1 不同细胞代次的影响 分别取第5、10、15、20和25代HL-60细胞,按照“2.1”项下方法接种,每孔加入热原标准品溶液至终浓度为0.125 EU/ml,平行4孔。于37℃、5%二氧化碳条件下培养24 h后测定IL-6含量。
2.2.2 不同孵育时间的影响 按照“2.1”项下方法接种细胞,每孔加入热原标准品溶液至终浓度为0.125 EU/ml,混匀。于37℃、5%二氧化碳条件下分别培养24、48和72 h,每个时间点平行4孔,培养结束后测定IL-6含量。
2.2.3 不同细胞密度的影响 取HL-60细胞,分别调整为 2×106、4×106、6×106、8×106及 10×106个/ml的细胞悬液,按“2.1”项下方法接种,每孔 100 μl,平行 4孔。每孔加入热原标准品溶液至终浓度为0.125 EU/ml。于37℃、5%二氧化碳条件下培养24 h后测定IL-6含量。
2.2.4 不同显色时间的影响 取HL-60细胞调整为2×106个/ml的细胞悬液,按“2.1”项下方法接种,每孔加入热原标准品溶液至终浓度为0.125 EU/ml,混匀。于37℃、5%二氧化碳条件下培养24 h后,按照说明书中方法分别显色 5、10、15、20和 25 min,每个时间点平行4孔,加入反应终止液,测定IL-6含量。
2.2.5 不同胎牛血清含量的影响 取HL-60细胞,以无血清的IMDM培养基洗涤1次,分别以含0%、2%、4%、6%、8%及10%FBS的IMDM培养基重悬,调整为2×106个/ml的细胞悬液,按“2.1”项下方法接种,每个血清浓度平行4孔。每孔加入热原标准品溶液至终浓度为0.125 EU/ml,混匀。于37℃、5%二氧化碳条件下培养24 h后测定IL-6含量。
2.3 干扰试验 干扰试验以供试品溶液对热原物质回收率的影响程度表示。选取浓度为0.125 EU/ml的热原标准品作为干扰试验中添加的热原浓度。将供试品溶液、添加干扰热原的供试品溶液和热原标准溶液测得的热原含量分别记为a、b和c。按下式计算热原的回收率(R):R=(b-a)/c×100%。当R在 50%~200%之间,则认为此试验条件下供试品溶液不存在干扰作用。
2.4 供试品最大有效稀释倍数计算 按照《中国药典》中公式L=K/M确定供试品热原物质限值(L)(计算值),然后按照公式MVD=C·L/λ确定供试品最大有效稀释倍数(maximum valid dilution,MVD)(C为供试品溶液浓度;λ为本方法本次试验的最低检测限)[7]。在实际操作中,对于化学药物的大输液治疗产品,热原限值一般采用比较严格的规定,定为0.50 EU/ml。λ采用0.06,则MVD为8。供试品临用前均使用维持培养基进行稀释。供试品同时按照《中国药典》动态显色法进行检测,与新方法结果进行平行比较。
2.5 供试品的判定标准 供试品稀释液不存在干扰作用下,若供试品稀释液测得的吸光度(A)值小于该方法的检测阈值(0 EU/ml的平均值加上其3倍标准偏差),则规定为未检出;将供试品稀释液测得的A值带入参数方程,求得供试品稀释液的热原含量,乘以其稀释倍数后,得到供试品热原物质含量,如小于限值,判定供试品符合规定,反之,则判定供试品不符合规定。
2.6 对干扰试验进行验证 取处于对数生长期的HL-60细胞,1 000 r/min离心5 min,以维持培养基洗涤1次,重悬后调整为2×106个/ml的细胞悬液,接种于96孔细胞培养板中,每孔100 μl。将T细胞及CART细胞4倍稀释液,每孔100 μl加入培养板中,与HL-60细胞混匀,于37℃、5%二氧化碳条件下共同孵育24 h,镜下观察细胞形态。将孔内细胞悬液移至EP管中,加入 CD3 抗体 10 μl,避光孵育 15 min,1 200 r/min离心5 min,PBS洗涤1次,binding buffer重悬后,依次加入Annexin V-FITC及PI抗体避光染色15 min后,以流式细胞仪进行检测。流式图中CD3阴性群即为HL-60细胞群,分析T及CAR-T细胞对HL-60细胞的影响[8]。
3 结果
3.1 标准曲线的初步建立 HL-60细胞受0.06~2 EU/ml的热原物质刺激后分泌IL-6的量呈现良好的线性关系(R2=0.994 0),见图 1。
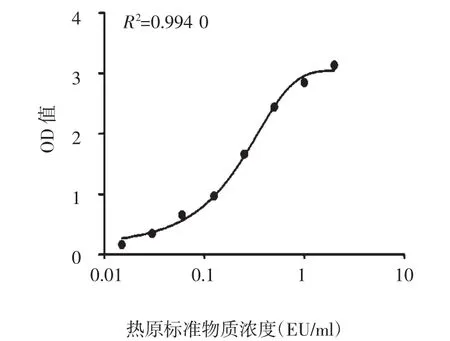
图1 HL-60/IL-6法标准曲线
3.2 标准曲线相关影响因素考查 标准曲线相关影响因素见图2。其中A图结果显示,除第5代细胞外,其他代次的HL-60细胞对热原物质反应敏感性未见明显差异,最佳细胞代次为10~25代细胞;B图表明,孵育24 h,IL-6释放量最大,随着孵育时间的延长,IL-6释放量降低,故最佳孵育时间为24 h;C图表明,孔内接种细胞数量在20×104~100×104范围内,分泌IL-6量与细胞数量呈现良好的线性关系(R2=0.946 8),故每孔接种20×104个细胞最为经济;D图表明,伴随显色时间的延长,IL-6吸光度值增加,每5 min约增加0.1,为尽可能降低背景值,节省操作时间,显色时间选用5~10 min;E图表明,IL-6吸光度值随着血清浓度增加而逐渐降低,说明FBS对IL-6释放存在一定的干扰作用,其中0%血清时,IL-6分泌量最大,与2%血清时比较,有显著性差异(P<0.05),考虑为细胞饥饿导致自发释放率增多现象,故最佳血清浓度选择2%。
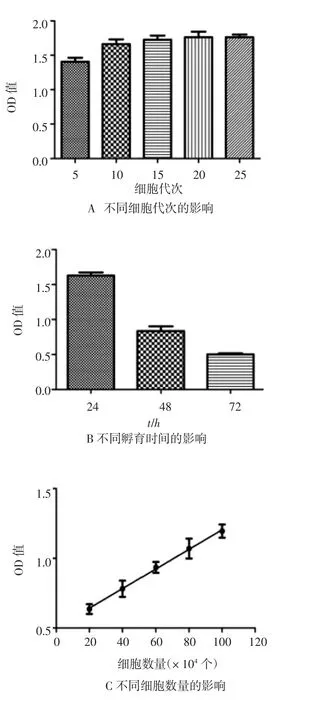
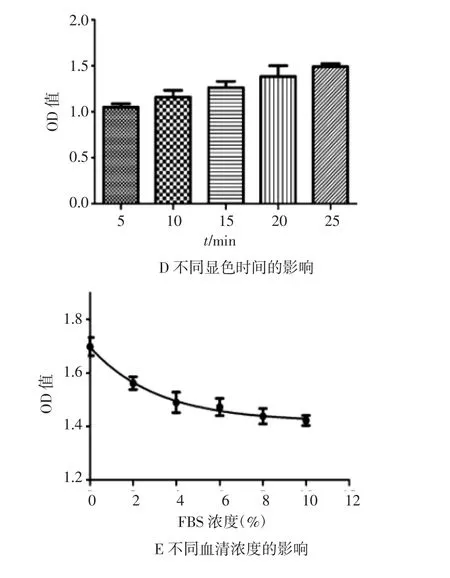
图2 标准曲线影响因素考查
3.3 细胞治疗产品的热原检测 细胞治疗产品干扰试验的回收率均在50%~200%之间,热原物质检测结果均为未检出或阴性,与动态显色方法结果均一致。见表1。
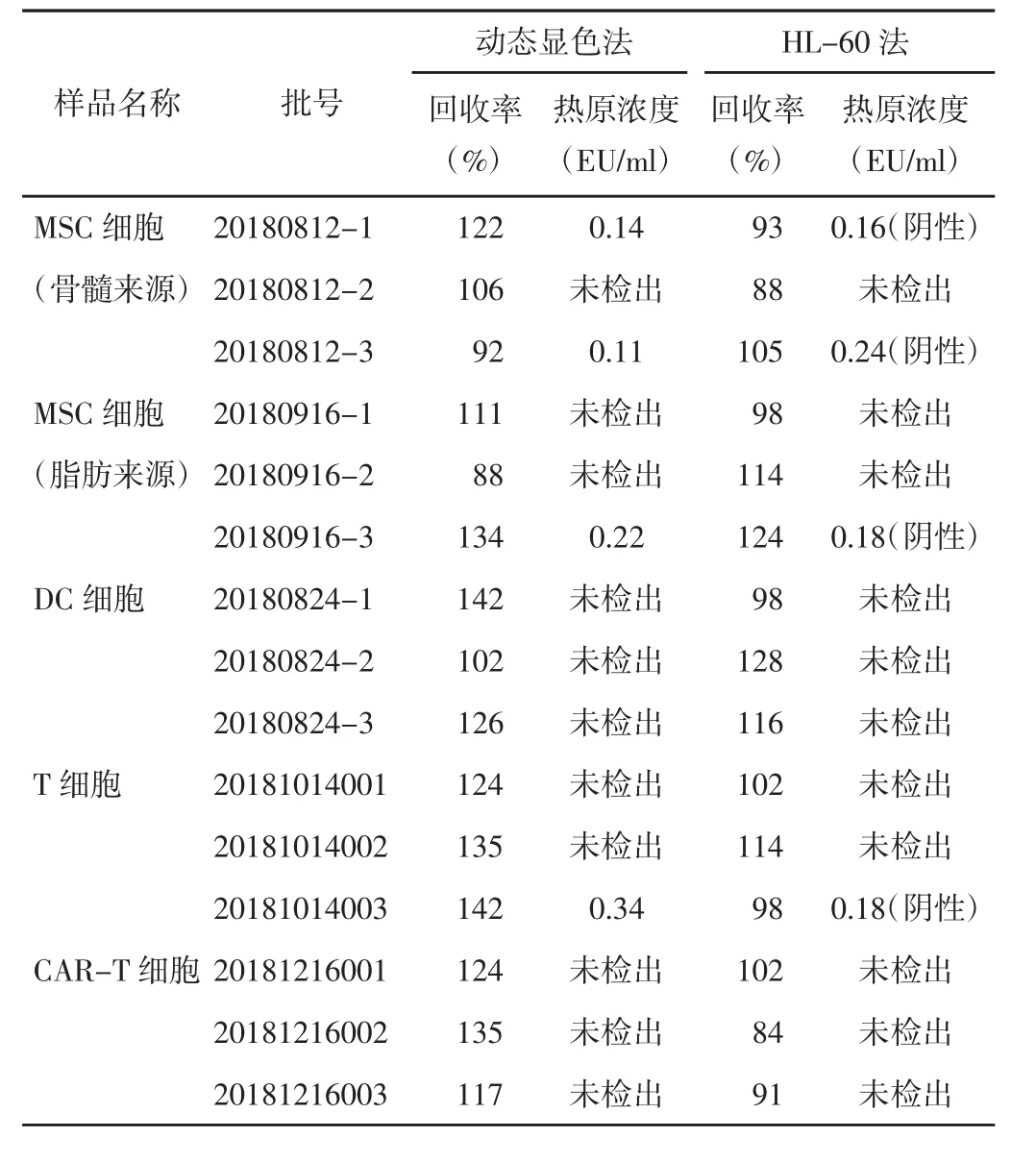
表1 细胞治疗产品热原物质检测结果
3.4 T及CAR-T细胞对干扰试验的验证 试验结果见图3-5。图3结果表明,HL-60细胞CD19的表面抗原表达为阴性,应与本试验中选择的嵌合CD19抗原受体的T细胞(CAR-T细胞)无特异性结合作用。图4镜下观察结果表明,T细胞偶见小的细胞团块(箭头所示),CAR-T明显可见大的细胞团块(箭头所示)。图5流式结果表明,T及CAR-T细胞分别与HL-60细胞孵育24 h,对HL-60细胞的凋亡率(早期凋亡加晚期凋亡)分别为5.67%及13.44%。
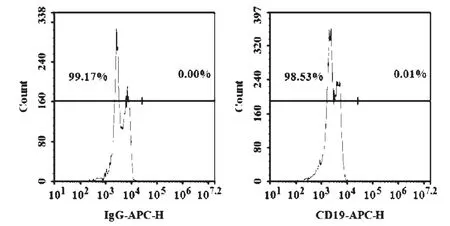
图3 HL-60细胞CD19表达情况鉴定
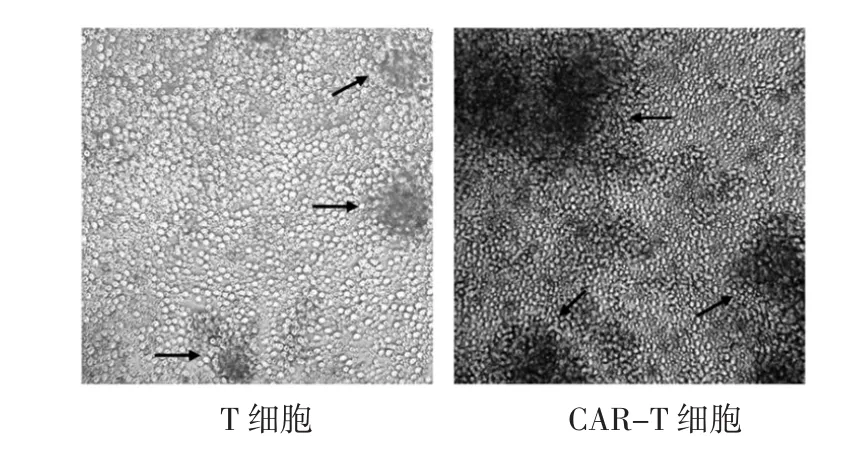
图4 T及CAR-T细胞对HL-60细胞的凋亡作用(显微镜观察结果)
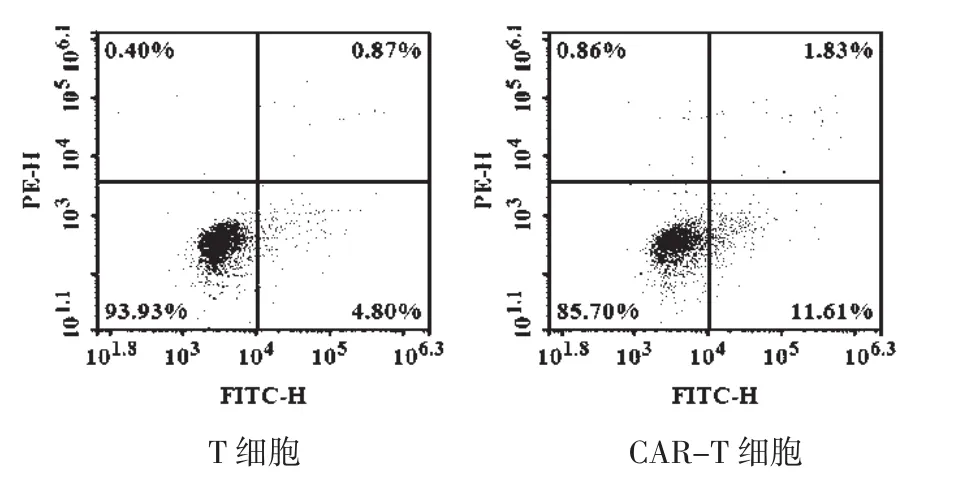
图5 T及CAR-T细胞对HL-60细胞的凋亡作用(流式细胞仪结果)
4 讨论
热原检测是保证非肠道用药,特别是静脉注射用药质量安全的重要检测手段,近年来,各国相继开展新的热原检测方法的研究,作为家兔法和细菌内毒素法的替代和补充[9]。Wang C 等[5]首次报道 HL-60 细胞受热原物质刺激后,释放可引起体内发热反应的因子IL-6,灵敏度高,可用于定量检测所有类型的致热物质,且无种属差异。本试验建立HL-60/IL-6法,对相关影响因素做了研究,并选取部分细胞治疗类产品进行了适用性研究,证实本法可用于细胞治疗类产品的热原检测。
细胞类治疗产品是否具有适用性,关键在于干扰试验是否成立。对检测所用细胞株(HL-60细胞)具有严重杀伤效果或抑制分泌功能的产品,均会对试验产生干扰作用[10]。从HL-60/IL-6法回收率结果看,所选产品的回收率均在50%~200%之间,不会产生干扰作用,本文进一步应用流式细胞仪的方法更加直观地验证了干扰试验的结果。从细胞产品作用机制分析,间充质干细胞具备分化潜能,以修复受损肌体功能为主,对于HL-60细胞应无直接杀伤或抑制作用;T及CAR-T细胞则具有直接的肿瘤细胞杀伤活性,存在结合并杀灭HL-60细胞、产生干扰作用的较大可能性,因此试验中仅选取T及CAR-T细胞进行验证。本试验中用到的CAR-T细胞是嵌合CD19抗原受体的T细胞,对表达CD19的肿瘤细胞株有着特殊的靶向杀伤效果[11]。利用APC-CD19抗体检测HL-60细胞表明其表面CD19抗体阴性表达,不会与CAR-T发生特异性结合。T细胞在发挥杀伤作用时,首先通过与靶细胞紧密结合,随后释放颗粒酶、穿孔素及Fas/FasL途径导致靶细胞凋亡[2]。当供试品稀释8倍时,T细胞偶见细胞团块,CAR-T明显可见细胞团块,但靶细胞凋亡率却仅为5.67%及13.44%,均小于50%的限值要求,考虑细胞团块为高浓度下T及CAR-T细胞自身结合造成的团块,而对HL-60细胞无明显影响。T细胞在发挥杀伤作用时,还需要抗原呈递细胞CD3及CD28因子的共刺激活化作用,使细胞从静息状态转变为活化状态[11]。企业生产的过程中,会加入含CD3及CD28的磁珠模拟体内活化过程,但在生产结束时,考虑磁珠的安全性,会对磁珠进行去除,因此形成终产品的T及CAR-T细胞很可能由于失去共刺激作用而处于静息状态,这可能是T及CAR-T细胞对HL-60细胞体外杀伤效果有限的原因。
综上所述,HL-60/IL-6热原检测法无种属性要求,灵敏度高,稳定性好,方法可靠,能够定量检测细胞治疗类产品中所含热原物质,作为生产厂家的内控方法,成为该类品种细菌内毒素检查方法的补充,更好地保障其临床用药安全。
