毛细管电泳法测定肝素和低分子量肝素平均硫酸化程度
2020-09-18沈煜婷康经武
沈煜婷, 康经武
(中国科学院上海有机化学研究所, 生命有机化学国家重点实验室, 分子合成卓越中心, 上海 200032)
肝素是由α-D-葡糖胺(GlcN)和己糖醛酸(α-L-艾杜糖醛酸(IdoA)或β-D-葡萄糖醛酸(GlcA))以1,4糖苷键连接而成,具有重复二糖单元、高度硫酸化的线性多糖混合物[1,2]。其中,葡糖胺上的氨基可以被硫酸化或乙酰化,且葡糖胺的3位或6位可能发生O-硫酸化;而糖醛酸有两种结构(IdoA和GlcA),且2位也可能发生O-硫酸化[3,4]。多变的硫酸化结构会产生大量不同序列,增加了肝素的复杂性及其微观结构的不均一性[5]。
低分子量肝素(LMWHs)由普通未分级肝素(UHF)通过酶解或化学降解得到[6]。相比于普通肝素,LMWHs作为抗凝血剂,在治疗过程中出血概率低,生物利用度更高,抗凝效果可预测,因而在很大程度上取代了普通肝素,成为预防和治疗血栓的抗凝血剂。临床上最常用的LMWHs是依诺肝素,依诺肝素是由UFH在碱性条件下通过β-消除降解得到的[7]。LMWHs不但相对分子质量与其母体肝素不同,而且在制造过程中,其硫酸基团容易离去,以致硫酸化程度(SD)通常也不同[8,9]。而大量的体外分析实验表明,LMWHs硫酸化程度的不同会致使不同生产工艺生产的LMWHs之间抗凝血活性差异较大[10]。
在过去20年中,科学家们已经开发了许多基于色谱或NMR的分析方法来表征UFH和LMWHs的结构[11-14]。而自2010年美国食品药品管理局(简称FDA)批准依诺肝素仿制药上市后,鉴定仿制药与专利药的化学和生物相似性成为LMWHs类药物生产和质量控制的难点,因此作为相似性评价中对LMWHs的组分和结构分析变得更加重要[15-19]。研究表明,不同厂家生产工艺上的细微差异也会导致LMWHs成分出现差异[19,20],而且制备和储存过程中硫酸根基团的丢失也可能导致LMWHs组分的变化[10,21,22],而组分的变化会直接造成抗凝血活性的波动[23]。因此,硫酸化程度的监测对于UFH和LMWHs的质量控制尤为重要。
一般来说,肝素结构中的硫酸化程度可通过NMR间接确定[16]。Inoue和Nagasawa[24]曾报道了一种使用亚硝酸对肝素进行脱氨处理后测定释放的硫酸根浓度来间接监测肝素中N-硫酸化程度的方法,但该方法仅限于对N-硫酸化程度的确定。最近,Han等[25]提出了利用FT-IR结合NMR的方法来测定肝素的硫酸化程度,该方法需要专业的数据处理所以很难用于质量控制。
鉴于目前对测定UFH和LMWHs硫酸化程度方法的局限性,本文发展了一种基于毛细管电泳测定UFH和LMWHs的平均硫酸化程度的方法。通过测定UFH和LMWHs经混合肝素酶彻底消化后每个寡糖结构单元中硫酸化基团的准确数目,计算出UFH和LMWHs的平均硫酸化程度。基于这一方法,我们比较了不同生产商或同一生产商生产的不同批次LMWHs间的平均硫酸化程度,从而评估产品结构和组分的一致性。该方法可用于产品一致性的研究和质量控制。
1 实验部分
1.1 试剂与材料
三羟甲基氨基甲烷(Tris)、碳酸氢钠、醋酸铵、醋酸钠、氢氧化钠、聚乙二醇10000 (PEG 10000)购自上海阿拉丁有限公司;十二水磷酸氢二钠、磷酸、醋酸钙、无水氯化镁、氯化钠购自中国医药集团;牛血清白蛋白(BSA)购自Sigma-Aldrich公司(美国);醋酸、盐酸购自上海第四试剂厂;甲醇(色谱级)购自Merck公司(德国)。
黄杆菌属肝素酶Ⅰ、Ⅱ、Ⅲ和肝素二糖标准品ΔⅠS、ΔⅡS、ΔⅢS、ΔⅣS、ΔⅠA、ΔⅡA、ΔⅢA和ΔⅣA购自Iduron公司(英国)。8批次依诺肝素,其中7S250、7S267、7S280、7S4084购自生产商1, 0103、0604、0701、0702购自生产商2。5批UFH起始原料S1、S2、S3、S4和S5均购自生产商2。所有溶液均由超纯水配制(18 MΩ·cm, Millipore UV超纯水系统制备,Millipore公司,美国)。所有缓冲溶液在使用前均用0.22 μm的滤膜过滤。
1.2 样品制备
使用含0.2 mg/mL BSA的10 mmol/L NaH2PO4缓冲液(pH 7.0)制备含量为0.13 IU/mL的肝素酶Ⅰ、Ⅱ、Ⅲ混合溶液;配制包含2 mmol/L乙酸钙和0.1 mg/mL BSA的醋酸钠/钙缓冲液;用水溶解依诺肝素和肝素样品,使其质量浓度为20 mg/mL。
取20 mg/mL的依诺肝素溶液20 μL,移取醋酸钠/钙缓冲液70 μL和肝素酶混合液100 μL轻轻混合,于25 ℃水浴中孵育至少48 h。消化后的样品溶液无须进一步处理即可直接进行CE分离。
1.3 分析方法
所有的实验均采用配有UV检测器的P/ACE MDQ毛细管电泳仪(Beckman公司,美国)。数据的采集和处理均采用Beckman公司的CE工作站系统。熔融石英毛细管柱的内径为50 μm (外径365 μm),总长为80 cm,有效长度为69.5 cm,购自河北Xinnuo光纤色谱公司。毛细管电泳的背景电解质为包含1.25%(质量分数)PEG 10000和2.5 mmol/L MgCl2的200 mmol/L Tris-H3PO4缓冲液,用0.5 mol/L H3PO4调节pH值至2.5。
新毛细管安装后,先用0.1 mol/L NaOH溶液预处理30 min,然后分别用去离子水和运行缓冲液冲洗5 min。在每次运行前,用0.1 mol/L NaOH、去离子水和运行缓冲液分别冲洗毛细管3 min。进样方式为压力进样(6 895 Pa×10 s);分离电压为-25 kV,柱温为45 ℃;紫外检测波长为232 nm。由于二糖ΔⅣA没有硫酸基团,在pH 2.5时几乎是电中性的,所以电泳进行33 min后在进样端施加34 475 Pa压力,将中性二糖ΔⅣA推到检测窗口检测。
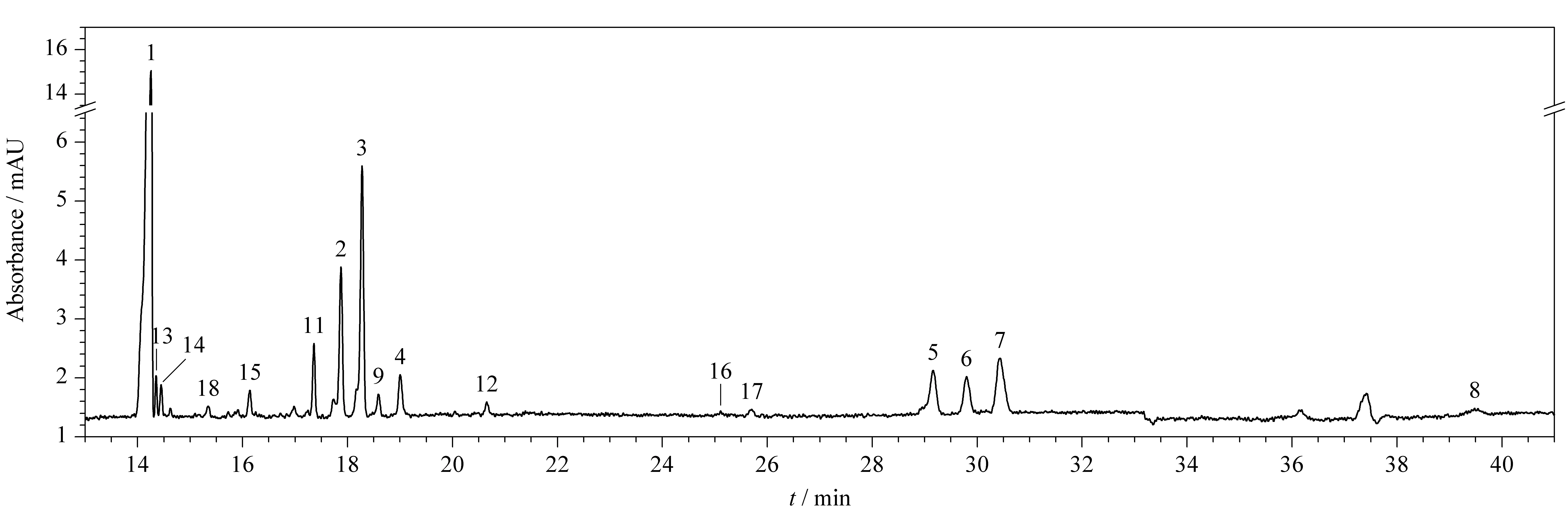
图 1 肝素经肝素酶彻底消化所得18种寡糖的毛细管电泳图Fig. 1 Electropherogram of the 18 oligosaccharides obtained by exhaustively enzymatic digestion of heparinPeaks 1-18 were the same as that in Table 1.
2 结果与讨论
2.1 毛细管电泳法分离肝素的完全酶解产物
在前期工作中,本课题组[17,18]开发了一种CE用于LMWHs的定量分析方法。肝素经肝素酶彻底消化得到18种寡糖构建模块(18种寡糖的结构特征均在表1中列出),包括10种二糖、1种三糖、3种四糖和4种1,6-环苷寡糖。该方法可以实现18种寡糖的基线分离(见图1)。利用高分辨率的CE方法,可以精确地测定LMWHs和UFH各构建模块的百分含量。
2.2 平均硫酸化程度的计算
平均硫酸化程度的测定方法是基于每种寡糖在232 nm紫外线下的摩尔消光系数相同的假设建立的[20],基于此,便可以用峰面积来代替每个寡糖的浓度,每个二糖的平均硫酸化程度可以通过公式(1)计算得到,
(1)
其中,NSi代表寡糖i的分子中硫酸基团(S)的数目,Ai代表寡糖i的峰面积;Adi、Atri、Atetra分别代表二糖、三糖和四糖的峰面积。因为平均硫酸化程度是根据二糖单元定义,所以必须将三糖和四糖转化为1.5和2个二糖单元。

表 1 肝素经彻底酶消化后所得18种寡糖的结构特征
2.3 不同批次肝素样品平均SD的计算与比较
测定了8个依诺肝素样品和5个UFH样品的平均硫酸化程度,每个样品测定3次,表2汇总了计算得到的每个样品硫酸化程度的平均值和相对标准偏差(RSD)的结果。除了总硫酸化程度(T-SD),还确定了各个样本的N-硫酸化程度(N-SD)和O-硫酸化程度(O-SD)(见表2)。结果表明,生产商1生产的依诺肝素一致性(RSD=0.26%)优于生产商2生产产品的一致性(RSD=0.56%)。UFH硫酸化程度批次间的差异相对较大(RSD=1.50%)。由此可见,作为原料,硫酸化程度的波动会传至最终的依诺肝素产品。另外,尽管生产商2产品的平均T-SD和O-SD略高于生产商1的,但平均N-SD略低,反映了两个生产商生产产品之间的成分差异。

表 2 不同批次依诺肝素和肝素之间的T-SD、O-SD和N-SD
3 结论
基于毛细管电泳技术结合肝素酶彻底消化的方法,本文开发了一种新的平均硫酸化程度的测定方法。通过该方法可以准确测定来自不同生产商依诺肝素产品的硫酸化程度,从而详细地分析不同生产商之间产品的组分差异。此外该方法还可用于评估不同批次产品的一致性。对于LMWHs的定量组分分析,CE方法还具分离效率高、自动化、分析时间短以及样品和试剂的消耗少等优势,在大规模测试中有很大的应用潜力。
