芯片毛细管电泳用于人乳头瘤病毒分析的研究进展
2020-09-18林雪霞王晨境林金明
林雪霞, 王晨境, 林金明
(1. 华侨大学化工学院, 福建 厦门 361021; 2. 微量分析测试和仪器研制北京重点实验室, 清华大学化学系, 北京 100084)
人乳头瘤病毒(human papillomavirus, HPV)是一种常见的球形DNA病毒,属于乳头瘤病毒科,通过直接或间接接触方式传播并感染人体的皮肤与黏膜,从而引起一系列疾病,如宫颈癌、直肠癌、阴茎癌和疣等。目前已知的HPV亚型已经超过200种,不同类型的HPV危险程度有所不同。根据其致癌能力,分为高危型和低危型。高危型HPV(hrHPV)主要包括HPV16、18、31、33、35、39、45、51、52、56、58、59、68和70型,平均感染持续时间大约8个月。低危型HPV(lrHPV)包括HPV6、11、42、43、44型,感染平均持续时间为4~8个月。HPV感染后,感染者大多没有临床表现,绝大部分感染会被机体免疫系统自动清除,只有持续的hrHPV感染才会发生癌前病变或使感染者患宫颈癌等。因此,可以采用HPV分型检测的方式区分持续(重复)感染、多重感染和一次感染,明确治疗方向;可以针对不同分型的感染采取不同的治疗方案,有利于受检者尽快恢复健康,避免过度治疗,也有利于预测受检者发病的风险度,确定筛查间隔。
在HPV疾病的诊断过程中,快速、可靠和准确的样品分析是患者、医生以及检测人员的要求和目标。然而,由于大多数样品都很复杂,在对样品分析之前,分析工作者需要完成对样品的充分处理和分离等一系列操作,步骤烦琐。因此,在实际诊断分析中很难同时实现快速而可靠的检测。分离是提高分析速度的一个难点,也是分析信息的关键。微流控芯片(microfluidic chip)又称微全分析系统或芯片实验室,其能够在一块几平方厘米(甚至更小)的芯片上高度集成化学和生物等领域中所涉及的样品制备、反应、分离、检测等基本操作单元,获得了人们的极大关注,并得到快速发展。微流控芯片技术的进步也促进了芯片毛细管电泳(microchip capillary electrophoresis, MCE)技术的诞生和发展。MCE是一种将传统毛细管电泳与微机电加工技术相结合,然后集成在一个芯片上的分离技术。在HPV的检测中,MCE主要是利用玻璃、石英或各种聚合物材料加工成微米级通道,以高压直流电场为驱动力,利用分离缓冲液的筛分效应,根据DNA/RNA分子的大小进行HPV核酸快速分离检测。与传统的凝胶电泳以及毛细管电泳相比,MCE具有高度集成以及自动化的优点,可以将检测时间缩短到几分钟,在分析速度方面具有显著优势。本文主要分为两部分进行综述:(1)MCE系统和芯片的设计制作;(2)MCE在HPV核酸检测中的应用。
1 芯片毛细管电泳
MCE是在制作好的芯片通道中进行物质的分离。它的分离原理与毛细管电泳类似,在电场的作用下,由于待分离样品中各种分子带电性质以及分子本身大小、形状等差异,分子产生不同的迁移速度,经过一定时间后,根据移动距离不同而达到分离的效果。芯片通道的设计和电场的应用不仅可以实现样品的快速、高效分离,还可用于对样品进行前处理,比如样品的纯化和富集。HPV核酸的检测也从传统的PCR凝胶电泳分析向PCR-MCE转化,极大地提高了HPV的检测速度,节省了大量的劳动力。

图 1 芯片毛细管电泳用于人乳头瘤病毒DNA/mRNA的检测Fig. 1 Human papillomavirus (HPV) DNA/mRNA detection based on the microchip capillary electrophoresis (MCE) a. composition of the MCE system; b. schematic diagram of the MCE chip commonly used; c. test result report by MCE. S, SW, B and BW indicated sample solution, sample waste, buffer and buffer waste, respectively.
1.1 MCE系统
典型MCE装置的核心单元包含微流控进样通道、分离通道、检测单元和电源供应等(见图1a)。芯片电泳系统主要由高压电源、芯片、电解液池、进样系统、检测系统等构成。如图1b所示,MCE芯片的微通道结构一般包含了样品流动的微通道、样品和缓冲液储存池、分离缓冲液或者凝胶等。高压电源是组成芯片电泳装置的重要设备,是样品在溶液中迁移的动力来源。目前常用的进样系统为电动或者动液压进样系统。不同的进样方式需要的通道结构也不同。电动进样操作简单,并适用于大多数微通道设计,因此是MCE的首选进样方式。在电动进样模式下,样品的进样量主要取决通道交叉口的体积。动液压进样是通过样品和样品废水池的液位差,或者施加压力或抽真空来完成的。这种进样方式是通过辅助设备(如泵或移液管)实现样品进样。因此,这种进样方式目前使用较少。新的动液压进样注射常通过喷墨和阵列技术控制液滴注射[1,2]。这种液滴注射法不仅能够进行高通量进样,而且能精确地控制体积为nL到pL的样品进样。此外,目前商品化MCE仪器中检测器主要以紫外-可见光检测器和激光诱导荧光检测器为主,也发展了发光二极管荧光检测器、电化学检测器等多种其他检测器,能够获得如图1c所示的色谱分离图。同时,为了获得足够的光信号,常常使用光电倍增管(PMT)或电荷耦合器件(CCD),提高检测灵敏度。
常见制作MCE芯片的材料包括玻璃、陶瓷和各种聚合物。其中聚合物包含聚二甲基硅氧烷(polydimethylsiloxane, PDMS)、聚甲基丙烯酸甲酯(polymethylmethacrylate, PMMA)、环烯烃共聚物、聚苯乙烯和聚碳酸酯等。通过光刻法制作的PDMS芯片由于价格低廉、光学透明、无毒、制作相对简单的优点而被广泛使用。然而,PDMS具有一定的疏水性,能够在通道表面吸附疏水性物质,并且不容易控制电渗流,从而降低了芯片的分离效果。因此,一部分研究者一直致力于PDMS芯片表面的修饰。除了PDMS外,另一种常用的聚合物是PMMA,它主要是通过热压成型的方式来制作芯片。这种通过热压形成的PMMA芯片能够实现MCE芯片的快速、大规模生产。近年来,纸基芯片以及纤维芯片由于结构相对简单和制造成本低廉等优势越来越受到人们的关注。与此同时,芯片的制作技术也快速发展起来。喷墨法、绘图法、等离子体法以及激光打印等一些其他制作工艺虽然没有达到光刻的精度和分辨率,但是这些工艺的制作程序具有简单、成本低的优点。尽管大规模芯片制作方法在一定程度上降低了生产成本,但是芯片电极的加入却大大提高了MCE器件的成本。Henderson等[3]通过激光焊接技术在聚苯胺导电膜上制备了一种用于电容耦合非接触电导检测(capacitively coupled contactless conductivity detection, C4D)的电极。然后在PMMA基底上涂覆C4D电极涂层。最后将PMMA基底与带有微通道的PDMS芯片键合,得到MCE芯片,极大地降低了芯片制造成本。Tang等[4]通过微接触电化学蚀刻技术,可以在不到2 min的时间内完成MCE芯片的制作。尽管如此,玻璃仍然是MCE芯片制作最常用的理想基质。Donora等[5]通过湿法刻蚀和激光雕刻烧蚀制作玻璃MCE芯片。这些芯片的分离效率明显低于光刻蚀制作的芯片。与此同时,使用玻璃芯片的商品化MCE系统也发展起来,如岛津公司MutiNA MCE、安捷伦公司2100生物分析仪、Perkin Elmer公司LabChip®分离系统和Bio Rad公司ExperionTM自动电泳系统。
1.2 MCE芯片结构
MCE芯片结构的设计,最初是一条直微通道作为分离通道,后来出现了多种不同的通道设计。经典的MCE芯片设计包括两条交叉通道及4个缓冲池(样品池、废液池、阳极池和阴极池,见图2a)。T型微通道可以进行样品富集,是MCE最常用的结构(见图2b)。商品化的岛津MCE-202 MultiNA芯片就是采用这种通道[6]。它包含1个样品槽、1个试剂和缓冲液入口槽、2个废液槽。为了能够开展多个样品分析,系统可以允许同时使用4个芯片。为了能够更好地进行复杂样品的研究,实现复杂样品的高度分离,Bottenus等[7]和Zhuang等[8]设计了蛇形通道来增加分离通道的长度,从而提高了样品分离效果(见图2c)。除此之外,还有双T型、十字型以及其他类型的芯片(见图2d和图2e)[9,10]。双T型芯片通道的设计,使样品可以在MCE芯片中连续流动,从而实现对样品的连续分析。同步循环MCE芯片的设计能够使分子通过环形通道延长迁移距离,获得更好的分离度[11]。

图 2 4种常见芯片通道的示意图Fig. 2 Schematic diagrams of four common chip channels a. straight channel; b. T channel; c. serpentine channel; d. dual channel; e. double channels.
此外,通过对MCE芯片通道的设计,能够将样品的前处理集成在一张芯片上。Kumar等[12]在MCE芯片上集成了固相萃取装置。他们将聚合物溶液填充在芯片通道中,并通过原位光聚合制备芯片内的固相萃取柱。制作的固相萃取柱不仅能够进行目标物的萃取,还能将目标物的浓度富集高达80倍。对于核酸检测,Ma等[13]在MCE芯片上集成等温扩增单元,开展高灵敏检测的研究。Liu等[14]在芯片上集成PCR单元,然后通过MCE分离进行phiX174噬菌体序列和大肠杆菌PCR产物的高灵敏检测。通过这种方法能够实现50拷贝DNA的样品分析,而且整个样品处理过程和样品分析过程在45 min内完成。通过对芯片结构的设计和电极的应用,在MCE芯片上集成不同样品处理功能,不仅能够实现高灵敏、快速的样品分析,而且易于自动化和微型化,减少试剂使用量和降低成本。
1.3 芯片电泳分离方式
样品的电泳分离是通过在通道上施加电场来实现的。电场的施加将促进带电分子的迁移。在MCE中,最常用的电泳方式是区带电泳、凝胶电泳和介电泳。
在区带电泳中,带电物质在电场作用下在背景溶液中迁移,并根据电泳迁移率的不同实现分离。待测物质除了受到电场作用之外,还受到溶质颗粒与固相载体吸附作用的影响。区带电泳在药物、代谢产物等小分子的分离方面有着广泛的应用。
介电泳,也称双向电泳,是介电常数较低的物体在非匀强电场中受力的现象,常用于颗粒和细胞的分离。Sun等[15]通过自组装离子液体电极和介电泳技术将聚苯乙烯微球和PC-3细胞分离。
凝胶电泳技术发展历史悠久。在凝胶电泳中,电场的施加是沿着筛分基质进行的。电泳中使用了无反应活性的筛分基质,如琼脂糖凝胶和聚丙烯酰胺胶等,从而提高了分析物的分离效果。同时,电泳的迁移率同分子的大小、极性及介质黏度、凝胶形状的差异和分子所带的净电荷密切相关。随着凝胶电泳技术的发展,近年来基于凝胶电泳的微芯片装置也逐步发展应用。分离速度从原来的几个小时缩短到10 min以内。Lin等[6,16]通过使用商品化的岛津MultiNA MCE分析仪开展了多种蛋白质的分析和核酸分析。在核酸分析中,Lin等[6,16]针对经过PCR扩增后的短串联片段和白血病相关的BCR-ABL片段进行基于MCE的凝胶电泳分析,均可以在90 s内完成分析。在多种蛋白质的检测中,主要是结合功能适配体调节蛋白质分子的大小和改变净电荷的数目进行多种蛋白质快速高灵敏的检测[17]。随着MCE的发展,各种不同的MCE分离技术被进一步开发和利用。Wang等[18]将MCE与适配体技术相结合,对牛奶中的抗生素实现了快速高灵敏的检测。Qin等[19]将MCE和荧光信号放大技术相结合,用于人血浆中γ干扰素(IFN-γ)的高灵敏检测。
2 MCE在HPV检测中的应用
HPV是一种DNA病毒,感染人类表皮及黏膜组织,目前约有200种类型的HPV被鉴别出来。流行病学研究已经证实,HPV病毒持续感染是引发癌变的主要原因。其中,16型(HPV16)和18型(HPV18)是世界范围内感染率最高的亚型。目前,HPV的商业化检测方法主要包括德国Qiagen公司生产的杂交捕获Ⅱ代 (HC2) 检测法和瑞士Roche 公司建立的酶切信号放大法(LA法)等。其中,HC2检测是HPV检测的金标准。然而这两种方法受到核酸探针的影响,成本较高,难以被大量推广使用。此外,HPV分型检测常用的方法还有细胞学检查、PCR、实时荧光定量PCR、印迹杂交法等技术。细胞学检查灵敏度低,观察范围有限,在病毒感染早期往往难发现,出现假阴性的概率较高。基于传统PCR的HPV分型检测和PCR产物常用琼脂糖凝胶电泳检测,耗时较长,操作也比较复杂。而MCE能够在几分钟内完成PCR产物鉴定,极大地降低了分析时间。本文主要介绍核酸扩增技术和MCE技术用于HPV分型的检查方法,其中包括PCR和MCE结合用于HPV的检测技术、环介导等温扩增(loop-mediated isothermal amplification, LAMP)技术的HPV检测方法、基于PCR结合限制性片段长度多态性(restriction fragment length polymorphism, RFLP)技术用于HPV分型的DNA检测、基于核酸序列扩增(nucleic acid sequence based amplification, NASBA)技术检测HPV mRNA等。
2.1 PCR-MCE检测的HPV分型
HPV分型的检测经历了很长的发展阶段。由于存在许多不同的HPV亚型,近20多年来,HPV的检测主要是利用PCR技术开发出在一次实验中检测多种不同HPV亚型的检测方法。这些检测方法主要是在衣壳蛋白晚期转录期L1或早期转录期E1开放读码框中,通过选择针对HPV基因组的高度保留序列的通用型引物来实现这一目的。最早的通用型PCR实验是IU/IWD0、MY09/11和GP5/6-PCR体系(PGMY体系),扩增出包含450个或150个碱基对的目标物。在此基础上,建立了基于PGMY引物的第二代HPV的PCR检测技术。近些年,出现了许多新的PCR HPV分型检测技术,包括把病毒的L1或E1区域内其他保存区域作为目标。针对不同HPV分型,以不同病毒区域为目标,研究者也开发了多种不同引物。然而,大多数HPV分型的PCR产物均通过凝胶电泳进行分析,只有极少量的HPV PCR产物通过MCE进行检测分析。

图 3 PCR-MCE用于HPV分型检测Fig. 3 Detection of HPV types by PCR-MCE a. DNA extraction and PCR assay; b. HPV analysis based on MCE; c. simultaneous detection of HPV16 and HPV18. PCR: polymerase chain reaction.
基于PCR的HPV分型检测方法多有报道。然而,利用GP5+/GP6+通用引物对目标物进行扩增,往往需要进一步利用分型探针与PCR产物杂交,才能够得到准确的HPV分型[20-22]。目前HPV分型的探针并不能完全覆盖HPV的所有分型。传统的HPV分型检测中,由于受到探针的影响,HPV检测只能检查出已知的HPV分型,不能达到预测其致病程度的作用,方法的使用也受到限制。为了避免受到探针的限制,一些研究者[23,24]通过MCE检测HPV PCR产物的大小,进行HPV16和HPV18分型的鉴定(见图3)。为了能够获得准确的PCR产物大小,在MCE检测中使用2%羟乙基纤维素为筛分介质,Tris-硼酸(TBE)为缓冲液,通过在线混合方式对HPV PCR产物进行荧光检测。同时,为了提高分析的准确度,以低片段和高片段DNA标志物为内标物进行扩增片段大小的校正。与传统的HPV分型检测相比,此方法不需要检测探针就可以实现HPV16和HPV18分型的检测。同时,MCE技术在HPV分型检测中的应用极大地简化了操作步骤,也缩短了分析时间,检测灵敏度也比传统染色方法高出10倍以上,检测样品所需的缓冲液及样品量很少,大大降低了HPV检测的成本。与细胞学检查相比,此方法大大提高了检测灵敏度,降低了检测成本,有助于HPV相关癌症的早期筛查,降低检测的假阴性概率,具有实际应用价值。在前期实验的基础上,林金明等[23]又提出了一种能够同时检测HPV16和HPV18,并且能够有效区分两种高危型HPV亚型的MCE检测方法。该方法已成功应用于HPV的检测,测序结果显示了良好的可靠性。鉴于全球对妇女健康认识的不断提高,以及最近推出的宫颈癌疫苗,对于HPV的检测将成为科研人员未来更加关注的研究方向。为了进一步提高HPV检测的灵敏度,Fan等[24]还提出了一种基于环介导等温扩增(LAMP)技术的HPV检测方法。该方法采用可视化方法,通过肉眼对HPV16和HPV18进行鉴别,无须昂贵的专用仪器。实验结果表明,该方法具有良好的可靠性,与细胞学方法相比,假阴性率降低。相比之下,目测LAMP法的结果与PCR MCE法的结果一致,表明目测LAMP法可成功用于检测两种高危型HPV。因此,这种操作简便、结果可以直接通过肉眼判断的LAMP检测方法可以用于宫颈癌的现场检测。由于减少了对仪器的依赖,这种方法更有利于偏远地区HPV的普查。
2.2 RFLP-MCE自动分型法用于HPV分型筛查
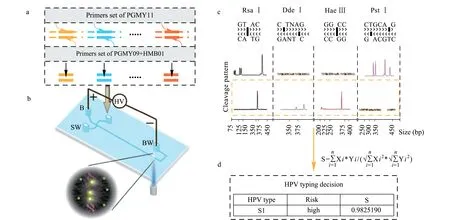
图 4 PCR-RFLP-MCE自动HPV分型检测示意图[26]Fig. 4 Schematic diagram of PCR-RFLP-MCE for automatic detection of HPV[26] a. PGMY09/11 primes for the amplification of the potential multiple HPV DNAs; b. DNA analysis on MCE; c. the sites of different restriction endonucleases and the sizes of RFLP; d. automatic typing software for RFLP fragments. RFLP: restriction fragment length polymorphism.
基于PCR的HPV检测方法虽然灵敏度高,但需要特异性的探针,成本相对昂贵,且只能检测出已知分型,无法满足实际需要。其中,采用常规PCR-MCE方法对HPV分型进行检测,只能利用PCR引物和MCE检测到PCR产物的大小,初步判断HPV分型,无法进行精准判断。因此,为了实现自动化快速HPV分型的筛查,近年来,发展了PCR-RFLP技术用于HPV分型的检测。RFLP技术是通过将PCR产物酶切成不同长度的DNA片段,然后通过筛分介质或凝胶电泳分离进行片段大小的分离。Tawe等[25]通过PCR-RFLP开展宫颈癌中HPV分型检测。然而,这种RFLP常常只使用一种酶进行少量HPV分型的酶切,无法对多种HPV分型进行筛查。为了能够实现多种分型的筛查,Yi等[26]利用多种酶对HPV的PCR扩增产物进行酶切(见图4),然后利用MCE分离得到HPV分型的指纹特征,再利用开发的HPV分型软件,能够一次实现47种HPV分型的识别。其中,多种酶和HPV指纹特征的应用,极大地提高了HPV分型检测的准确度,降低了假阴性和假阳性概率。相比于传统的PCR检测技术和PCR-MCE检测,PCR-RFLP-MCE的方法不仅可以检测出已知HPV分型,还可以通过指纹特征检查出未知的HPV分型。这种方法不需要特异性探针,可以进行在线荧光标记,具有更高的自动化性能。此外,自动化分型分析软件的开发不仅节省了分析时间,而且减小了主观误差率,克服了传统HPV分型分析烦琐操作的缺点,为HPV分型的全自动化检测奠定了基础。Yi等[26]将PCR-RFLP-MCE自动分型法获得的结果与细胞学检查和DNA测序方法对比,结果显示阳性检出率是传统的细胞形态学检查的4倍,检测出单一感染占2/3,分型准确度大于90%。证明了PCR-RFLP-MCE自动分型方法的优越性以及用于辅助宫颈癌早期诊断HPV筛查的可能性。
2.3 MCE用于HPV病毒mRNA的检测
对于HPV感染相关疾病的分子生物学检测,最直接的方法莫过于直接对PCR产物进行测序。这样不仅能进行HPV分型的确认,还可以发现新的亚型。该方法对测序样品的纯度要求高,一般的PCR扩增体系成分复杂,容易导致测序有误。充分利用酶切技术,根据不同类型HPV DNA特定内切酶的酶切片段长度的不同,也可实现HPV的筛査和分型。但多种酶的使用容易产生大量的DNA短片段,使HPV分型难以确定。此外,有研究表明基于PCR的HPV DNA检测无法识别转录活性病毒,是引起假阴性的一个重要原因。据报道[27],有14% HPV DNA检测阳性的口咽和舌根鳞状细胞癌在hrHPV E6/E7 mRNA的检测中表达为阴性和低的HPV DNA病毒载量。因此,HPV的DNA检测只可作为“旁观者”检测分型。PCR检测的结果用于HPV分型的鉴定受到了一定的质疑。mRNA的转录水平能够相对准确地反映出细胞内癌蛋白的表达。因此,检测编码癌蛋白的mRNA可作为蛋白质直接检测的方法。有研究表明,在高级别的宫颈病变中,宫颈刮片中利用E6/E7 mRNA的阳性检出率高于HPV DNA的检出率,其主要原因可能是因为HPV mRNA的表达水平能够更好地体现具有细胞转化潜能的HPV激活感染程度,而HPV DNA的筛査容易受到临床无关条件的影响[28]。
各种各样的HPV E6/E7 mRNA检测方法逐渐发展起来,包含了原位荧光杂交技术和自取样技术的HPV mRNA分析[29-31]。其中,HPV mRNA的高灵敏检测主要通过扩增技术进行检测,如利用反转录-聚合酶链反应(RT-PCR)技术以及后来发展的依赖核酸序列扩增(NASBA)技术对HPV mRNA目标片段进行扩增[32]。
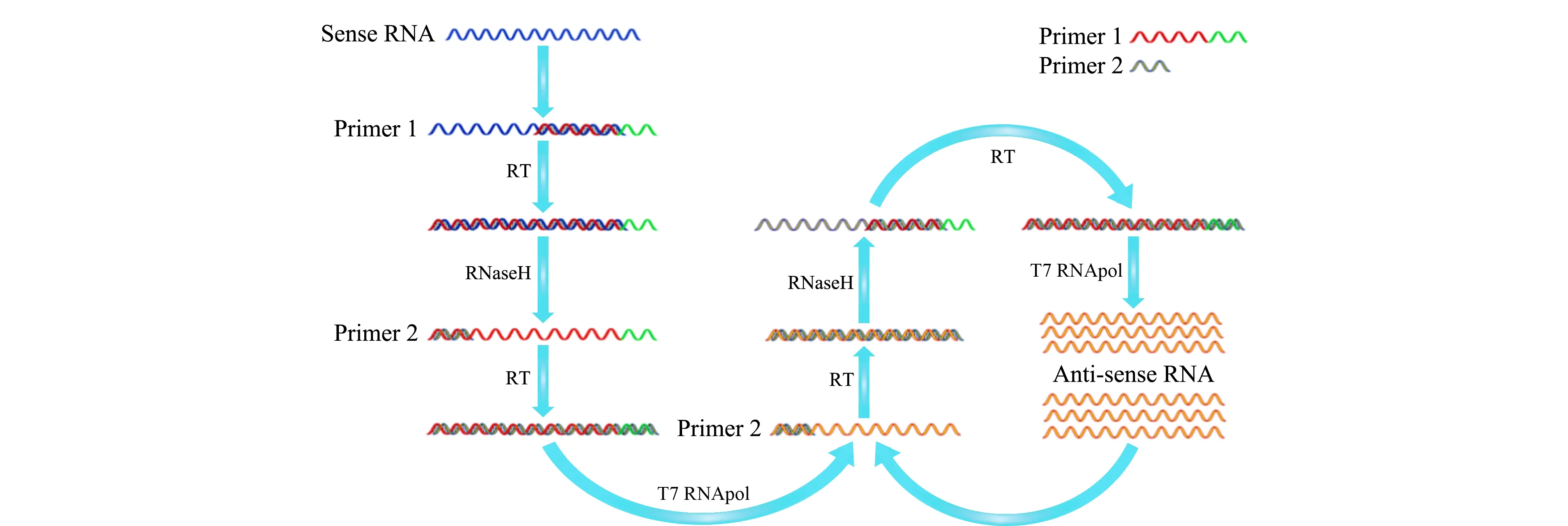
图 5 NASBA用于HPV E6/E7 mRNA的扩增Fig. 5 Amplification of HPV E6/E7 mRNA based on nucleic acid sequence based amplification (NASBA)

图 6 NASBA-MCE用于HPV16、18型的E6/E7 mRNA的检测Fig. 6 Detection of E6/E7 mRNA of HPV16 and HPV18 by NASBA-MCE
在这两种扩增技术中,RT-PCR是一种发展成熟的RNA扩增方法,扩增的过程需要借助温度循环装置来保证目标片段的选择性扩增。NASBA是一种等温扩增技术,扩增过程中所需的温度变化较少,不需要复杂的变温过程(见图5)。然而NASBA的扩增过程以RNA作为对象,对实验条件和实验环境要求严格。Liu等[33]分别对HPV16、18型的E6/E7 mRNA的3种常用扩增方法(NASBA、一步法RT-PCR和两步法RT-PCR)进行了比较,发现尽管NASBA-MCE(见图6)操作简单,具有较好的灵敏度和特异性,但该方法的重现性不够理想。此外,一步法RT-PCR操作相对简单,但引物的特异性不高,导致非特异性扩增现象严重。采用降落(Touch Down)的一步法RT-PCR用于HPV mRNA的扩增,通过MCE分析,发现利用Touch Down的RT-PCR能够较大地提高方法的灵敏度,但是非特异性扩增并没有得到明显改善,非特异性扩增仍然严重。利用MCE比较3种不同扩增方法的结果,发现目标物的MCE迁移时间明显受到一步法RT-PCR和NASBA扩增体系的影响。但是两步法RT-PCR扩增产物的MCE迁移时间并不受体系影响,也较少受到样品基质的影响。因此,两步法RT-PCR-MCE非常有利于实际样品的HPV mRNA检测。Liu等[33]推测这可能是因为两步法RT-PCR降低了非特异性扩增,从而改善了分析的稳定性。将3种HPV16和18型E6/E7 mRNA结果相比,还发现,两步法RT-PCR-MCE具有更高的灵敏度和特异性,能够进行更准确的半定量分析[33]。
2.4 其他HPV检测方法
HPV的检测在宫颈癌、直肠癌、阴茎癌等疾病早期筛查中扮演着重要角色,很大程度上提高了癌前病变的检出效果。随着人们对HPV和相关癌症病变关系的深入了解,HPV-DNA/RNA检测在癌症病变如宫颈病变预防、筛查、诊治及随访检测中的作用日益显现,也由最初的细胞学检查发展了多种不同的检测技术,除了MCE外,还包含了傅立叶变换红外光谱(FT-IR)[34]、电化学法[35,36]、电化学发光检测法[37]、比色法[38]等,具体见表1。Viana等[34]通过PCR进行HPV DNA目标片段的扩增后,通过FI-IR技术进行HPV分子的识别和检测。Mahmoodi等[35]为了提高HPV DNA检测的灵敏度,以HPV 18 DNA为检测对象,将还原氧化石墨烯和多壁碳纳米管沉积在丝网印刷碳上的电极上,进一步将金纳米粒子沉积到改性的电极上,再将单链DNA捕获探针通过金-巯基键合到电极上,最后通过脉冲伏安法实现了HPV18 DNA的高灵敏检测。Avelino等[36]则利用含金纳米粒子的聚苯胺膜结合阻抗分析技术实现了多种HPV DNA的检测。此外,Nie等[37]利用锌掺杂的二硫化钼量子点和亚铜粒子氧化还原羟基形成水,结合T7外切酶,成功建立了HPV16 DNA的电化学发光检测方法。Mukama等[39]通过LAMP技术对HPV16和HPV18的目的片段进行扩增后,利用CRISPR/Cas12a的分裂和侧流生物传感器实现了超高灵敏的检测。比色法由于无需专门仪器、检测方法简便而被广泛使用。在HPV检测中为了能够实现简便分析,Fan等[24]不仅利用环介导扩增技术,还结合甜菜碱、氯化锰和钙黄绿素实现了可视化检测。HPV mRNA检测大部分是基于原位杂交的检测方法[40,41]以及部分基于DNA酶的比色法[38]。

表 1 信号放大技术与除MCE外的其他检测方法用于HPV检测
3 MCE在HPV检测的挑战与展望
近年来,将微流控芯片技术和电泳技术完美地结合在一起的MCE已成为当今临床疾病检测的一个相对成熟的分析技术。MCE的快速发展为生物标志物的研究提供了有力的解决方案和方法。一些课题组[42-44]将PCR装置器件和MCE器件集成在一个芯片上,并开展了短串联重复序列测定和原位病原体诊断研究工作。然而,高集成的MCE在HPV分析检测中仍存在一些挑战。首先,虽然MCE装置可以很好地进行HPV的分离检测,但目前的MCE技术本身却无法实现HPV的高灵敏和高选择性检测。其次,即使有部分研究者成功地将PCR和MCE集成在一个芯片上,但是在HPV检测方面仍然没有集成化的PCR-MCE芯片。由于每一种目标物扩增时所需要的温度不同,微小的温度差异可能会带来完全不同的结果。因此,无法将已经开发的PCR-MCE芯片直接用于HPV分型的检测。MCE芯片技术的另一个瓶颈是微型化、自动化MCE器件的研制。微型化器件的制造常常需要专业的多学科团队的合作和一系列复杂加工的制造工艺。因此,MCE器件仍然无法实现大规模低成本生产。虽然MCE在HPV的检测以及其他生物标志物的检测方面仍存在着重重挑战。但是我们相信,未来MCE将向微型化、高集成化以及自动化方向发展。此外,由于个性化诊断和现场检测技术的发展,我们相信MCE技术在将来能够实现对HPV实时快速的现场检测,也能够发展出低成本、简单、高通量的便携式现场诊断技术甚至是穿戴式的HPV检测技术。
4 结论
MCE技术是一种快速、实时、可实现复杂物质现场分析的强有力技术。因此,越来越多的研究者们致力于MCE技术的集成化、微型化、自动化和高通量研究。首先,随着MCE技术的逐渐成熟,用于HPV自动化检测的标准化MCE芯片和平台将逐步实现。其次,各种不同的高选择性HPV探针和高灵敏的检测方法将再次发展并得到进一步的推广和应用。最后,人们不仅能够将PCR平台集成在MCE芯片上,未来还将集成更多的功能,如样品前处理中的萃取浓缩等技术。此外,高通量的MCE HPV检测技术在未来将得到人们越来越多的关注。因此,虽然目前MCE在HPV分型检测中仍然不成熟,存在着一些挑战,但在未来,MCE将继续得到发展和应用。
