亲和毛细管电泳技术在蛋白质-DNA相互作用研究中的应用
2020-09-18余方志章大鹏汪海林
余方志, 章大鹏, 袁 征, 赵 强, 汪海林*
(1. 中国科学院生态环境研究中心, 环境化学与生态毒理学国家重点实验室,北京 100085; 2. 中国科学院大学, 北京 100049)
DNA是生物遗传信息的载体,蛋白质是相关生物功能的执行者,蛋白质-DNA的相互作用在许多生命过程中至关重要。例如,DNA复制、转录及损伤修复等基本生命过程都需要一系列蛋白质的共同参与;DNA甲基化状态改变及生物学意义也需要通过相关的功能蛋白实现。另一方面,利用已经鉴定出与DNA作用的功能蛋白质分子,可以开发出许多先进的技术用于生物工程和生命分析等领域。比如,Cas9蛋白已经不仅是一种实验室常用的基因编辑工具,还有望成为临床上进行基因治疗的一种手段[1,2];基于甲基化识别蛋白/抗体相互作用的免疫沉淀技术为更深层次的DNA甲基化测序分析奠定了基础[3]。因此,对蛋白质-DNA的相互作用研究不仅有利于更好地认识基本的生命过程,而且可以帮助开发、改进许多重要的生物工程和生命分析技术。
建立和发展灵敏、快速、多样化的分析技术是进行蛋白质-DNA相互作用研究的首要问题。目前,常用的蛋白质-DNA相互作用分析方法有凝胶电泳迁移实验(electrophoretic mobility shift assay, EMSA)、染色质免疫共沉淀(chromatin immunoprecipitation, ChIP)、表面等离子体共振(surface plasmon resonance, SPR)、等温量热滴定(isothermal titration calorimetry, ITC)、酶联免疫吸附测定(enzyme-linked immunosorbent assay, ELISA),核磁共振(nuclear magnetic resonance, NMR)、冷冻电镜(cryo-electron microscopy, cryo-EM)以及亲和毛细管电泳(affinity capillary electrophoresis, ACE)等技术。每种技术都有其独特的优势和局限,研究者需要根据研究对象和研究目的进行灵活选择。毛细管电泳(CE)技术因其超高的分离效率、极低的样品消耗与较短的分析时间等优势已经被广泛应用于分离分析,在食品安全、药物筛选、环境监测、生命分析等领域发挥着重要作用。根据不同的分离原理,毛细管电泳技术具有多种分离模式。其中,亲和毛细管电泳技术利用迁移速率的变化可以对分子间的相互作用进行多参数表征,包括结合常数,解离速率常数,结合计量比等。另外,由于毛细管电泳技术操作简单,可以在生理相关的条件下进行,使其非常适合用于研究生物大分子间的相互作用。另一方面,毛细管电泳技术又可以反过来利用一些已知的相互作用发展新的分析方法用于相关目标分子及目标反应的分析检测[4]。本文对亲和毛细管电泳技术的研究进展做了简要介绍,对其在蛋白质-DNA相互作用研究中的应用进行了总结,并对该领域的未来发展趋势进行了展望与探讨。
1 亲和毛细管电泳简介
高效毛细管电泳技术主要利用不同荷质比的物质在强电场中的迁移速度差异从而将其在毛细管中进行高效的分离分析。得益于微米级别毛细管(内径约20~100 μm)的使用,带电粒子在电场中运动所产生的焦耳热可及时散发,因此可使用高电压(高场强)。同时,由于高场强的施加,带电粒子的扩散时间缩短,且扩散有可能受到强电场的“笼子效应”限制,带电粒子的峰展宽极小,分离效率显著提高。亲和毛细管电泳广义涉及各种复合物在毛细管电泳中的分离与分析。由于不同分子通过亲和相互作用形成的复合物通常具有与原来分子不同的荷质比,其电泳迁移速度会发生改变,所以理论上利用毛细管电泳技术可以对这种亲和相互作用进行分析检测。亲和毛细管电泳的概念由哈佛大学Whitesides教授研究团队于1992年提出[5],他们将不同浓度的带电配体加入电泳缓冲液中,通过检测目标蛋白质的迁移时间变化,从而计算出蛋白质-配体相互作用的结合常数。此后,亲和毛细管电泳技术被广泛应用于蛋白质-蛋白质、蛋白质-核酸、蛋白质-药物分子、抗原-抗体、受体-配体等之间的相互作用研究。亲和毛细管电泳技术可测得的亲和力范围非常广泛,相互作用体系的平衡解离常数(Kd)可以从mmol/L级到nmol/L级变化[4]。
亲和作用机制可以被引入各种类型的毛细管电泳分离模式,包括毛细管区带电泳、毛细管凝胶电泳、毛细管电色谱等。而根据进样方式或互作分子空间分布的不同,可以将亲和毛细管电泳技术总结为3种主要模式:(1)狭义的亲和毛细管电泳,其将互作分子之一作为添加剂添加至电泳缓冲液中,通过检测另一分子的迁移时间变化从而计算出相互作用的结合常数;(2)动力学亲和毛细管电泳,也称为预平衡毛细管区带电泳或亲和探针毛细管电泳,其将互作的分子提前孵育至反应平衡,再将样品进样至毛细管电泳进行分离分析,通过检测游离探针、稳定复合物及电泳过程中解离的复合物的峰面积与迁移时间可以计算出相互作用的结合常数及互作后形成复合物的解离速度常数[6,7]; (3)配体固定化的亲和毛细管电泳,其将亲和配体固定在毛细管中,受体分子在进样至毛细管后经过亲和捕获-洗脱过程以实现分离分析。前两类为均相作用体系,第三类为非均相作用体系。动力学亲和毛细管电泳本身还包括许多不同的分析方法,如空峰法、前沿分析、部分填充亲和毛细管电泳等,由于篇幅所限,本文在此不再一一介绍,感兴趣的读者可以参考综述文献[8,9]以了解详细的分类标准、方法原理及适用范围。
在实际的应用过程中,研究者们还发展了多种策略以增强亲和毛细管电泳技术的分析能力,包括竞争亲和分析策略,优化电泳缓冲液、分离电压、分离时间,降低分离温度,抑制毛细管壁的吸附效应等[10,11]。Kennedy教授实验室系统考察了电泳缓冲液、分离电压、分离时间、分离温度等对亲和作用分析的影响[12,13],他们认为短的分离时间和低的分离温度更有利于非共价复合物的检测。他们还发展了蛋白质交联毛细管电泳技术(protein cross-linking capillary electrophoresis, PXCE),以更准确地考察蛋白质之间的相互作用[14]。PXCE技术不仅降低了亲和毛细管电泳对分离条件的要求,还极大地缩短了单个样品的分析时间,从而提高了实验通量[15]。作者实验室发现在样品中加入适量的甘油、蔗糖、聚乙醇等有机渗透剂(organic osmolyte)不仅可以增强蛋白质-DNA的结合亲和力,还可以降低复合物的解离速率,增强复合物的稳定性[16]。最近,EL-Hady等[17,18]将短链咪唑类离子液体形成的两相体系引入亲和毛细管电泳以保护作用蛋白的活性从而增强其与药物分子的结合。
2 蛋白质-DNA相互作用机制研究
蛋白质-DNA的相互作用在基因选择性表达、基因组复制及基因组稳定性维持等重要的生命过程中起到不可或缺的作用。因此,对蛋白质-DNA相互作用的基础分子机制研究是亲和毛细管电泳的重要应用领域。Heegaard等[19]在1993年就利用亲和毛细管电泳技术对人血清淀粉样蛋白(SAP)中的肽段与DNA的相互作用进行了定性和定量分析。通过分别改变DNA探针的长度,肽段的长度及序列,他们确定了SAP蛋白与DNA相互作用的最小长度要求及序列特异性;通过改变DNA探针浓度建立结合曲线,他们估算了肽段与DNA的结合常数。但是目标肽段呈碱性(pI=8.55),在近中性的电泳缓冲液(pH=7.3)中极易被带负电的毛细管内壁吸附,他们因此选用DNA作为分析物质,并将其在上样前与目标肽段孵育。需要注意的是,由于毛细管内壁的吸附作用,作者并未检测到复合物的峰,只能通过未结合的游离DNA探针峰进行定性和定量分析。
Stebbins等[20]发展了毛细管电泳迁移实验(capillary electrophoresis mobility shift assay, CEMSA)用于蛋白质-DNA的相互作用研究。作者通过考察经典的阻遏蛋白与大肠杆菌色氨酸操纵子的结合证实了该方法的可靠性与优势。加州理工学院的发育生物学家Davidson教授研究组利用CEMSA技术考察了海胆胚胎转录因子SpP3A2蛋白与靶标DNA位点的相互作用[21]。为了抑制毛细管内壁的吸附作用,作者选用中性涂层修饰的毛细管用于CEMSA实验,可以在20 min内检测到SpP3A2-DNA复合物。另外,结合激光诱导荧光(laser-induced fluorescence, LIF)技术,该方法具有超高的检测灵敏度,可以检测到低至数百万个荧光标记的DNA分子,这比常规EMSA技术的灵敏度提高了至少100倍。超高的检测灵敏度使得该方法不仅可以用于DNA与高纯度重组蛋白的相互作用,还可以直接考察DNA探针与细胞核提取物、卵细胞裂解液、甚至单个海胆卵细胞裂解液的相互作用。
类似地,Foulds等[22]利用CEMSA-LIF技术在自由水溶液中测定了酵母转录因子GCN4蛋白的GCNK58结构域与靶标DNA位点结合的解离常数;Fraga等[23]采用CEMSA-LIF技术系统考察了甲基化胞嘧啶(5mC)结合蛋白(MBD家族)与甲基化DNA的结合亲和力,并据此推测了不同结合蛋白被招募至特定启动子区域的内在驱动力。作者团队也利用实验室自制的CE-LIF装置对5mC结合蛋白MBD2b与DNA的结合计量学及识别特异性进行了系统研究,首次从结合计量学的角度阐述了分子间相互作用特异性的内在分子机制[24,25]。
值得注意的是,自Dovichi教授将激光诱导荧光应用于毛细管电泳技术[26], LIF检测器因其超高的灵敏度与很好的兼容性已成为毛细管电泳技术最重要的检测手段之一。尤其是在蛋白质-DNA相互作用机制的研究中对检测方法的广泛性要求不高,通常都是对DNA或蛋白质分子进行荧光标记,利用LIF检测技术测定相关参数。除了荧光强度,荧光偏振(fluorescence polarization, FP)是荧光的另一个重要性质。荧光偏振响应由荧光分子的旋转速度决定,与分子的大小及局部环境密切相关。如果荧光分子在溶液中快速转动,其被一束偏振光激发后发射的荧光在很大程度上会发生去偏振现象,荧光偏振响应较低;相反,当荧光分子受到外界的限制转动速度降低时,其发射的荧光具有与激发的偏振光相似的偏振特性,荧光偏振响应较高。根据这一原理,荧光偏振响应常被用于分析分子间的相互作用及生物大分子的结构变化。阿尔伯塔大学X. Chris Le教授研究组在LIF检测的基础上将荧光偏振检测技术引入毛细管电泳发展了高灵敏的毛细管电泳-激光诱导荧光偏振(CE-LIFP)装置[27-29]。由于可以同时通过电泳迁移时间变化和荧光偏振响应表征分子间的结合与解离状态及可能的构象变化,CE-LIFP技术已经成为亲和作用分析与生物物理结构分析的重要工具[30-34]。

图 1 近距离作用引起的荧光偏振增强效应示意图Fig. 1 Schematic illustration of close contact-enhanced fluorescence polarization (FP)
作者实验室利用CE-LIFP技术对多种蛋白质-DNA相互作用体系的分子机制及结构基础进行了系统研究,包括DNA损伤位点与修复蛋白[32],核酸适配体与靶蛋白[33], DNA底物与同源重组酶等[34]。核苷酸切除修复(nucleotide excision repair, NER)是一种能够识别广谱DNA损伤的修复系统,可以修复DNA交联、DNA加合物等多种损伤形式,在降低基因突变概率、防止细胞癌变等方面具有重要意义。Wang等[32]在利用修复酶检测DNA损伤时意外发现一种非相对分子质量依赖的荧光偏振响应增强现象,通过设计多种DNA荧光探针证明这一荧光偏振增强效应与DNA缠绕有关。由于DNA缠绕于大肠杆菌修复酶UvrB蛋白会造成多位点的密切接触,使得标记在DNA上的荧光基团转动受到束缚,故而显著增强了其荧光偏振响应。我们进一步利用这种近距离作用引起的荧光偏振增强效应(见图1)对DNA缠绕在NER机制中的作用进行了研究,实验结果表明UvrA蛋白介导的DNA-UvrB缠绕作用是NER通路中的一个早期事件,可能会诱导DNA损伤位点的局部解旋以便UvrB蛋白的插入,形成稳定的损伤修复前复合体。在此基础上,我们提出了大肠杆菌NER机制的DNA缠绕-解链模型,为认识NER的广谱DNA损伤识别能力提供了结构基础。Zhang等[33]随后利用这种近距离作用引起的荧光偏振增强效应考察了核酸适配体TA29与靶标蛋白凝血酶的相互作用情况。通过对TA29的单个核苷酸进行选择性标记并检测其与凝血酶结合前后的荧光偏振响应差异,即可鉴定出TA29适配体结合靶标分子的关键位点。相比于经典的结构解析技术(如X射线衍射、NMR等), CE-LIFP技术十分方便,不依赖昂贵仪器,且耗时非常短。这一方法不仅对理解核酸适配体与靶分子作用的结构基础具有重要意义,还可以快速评价并指导人工进化核酸适配体,从而提高其亲和力与特异性,以更好地服务于生物分析及靶标分子检测。
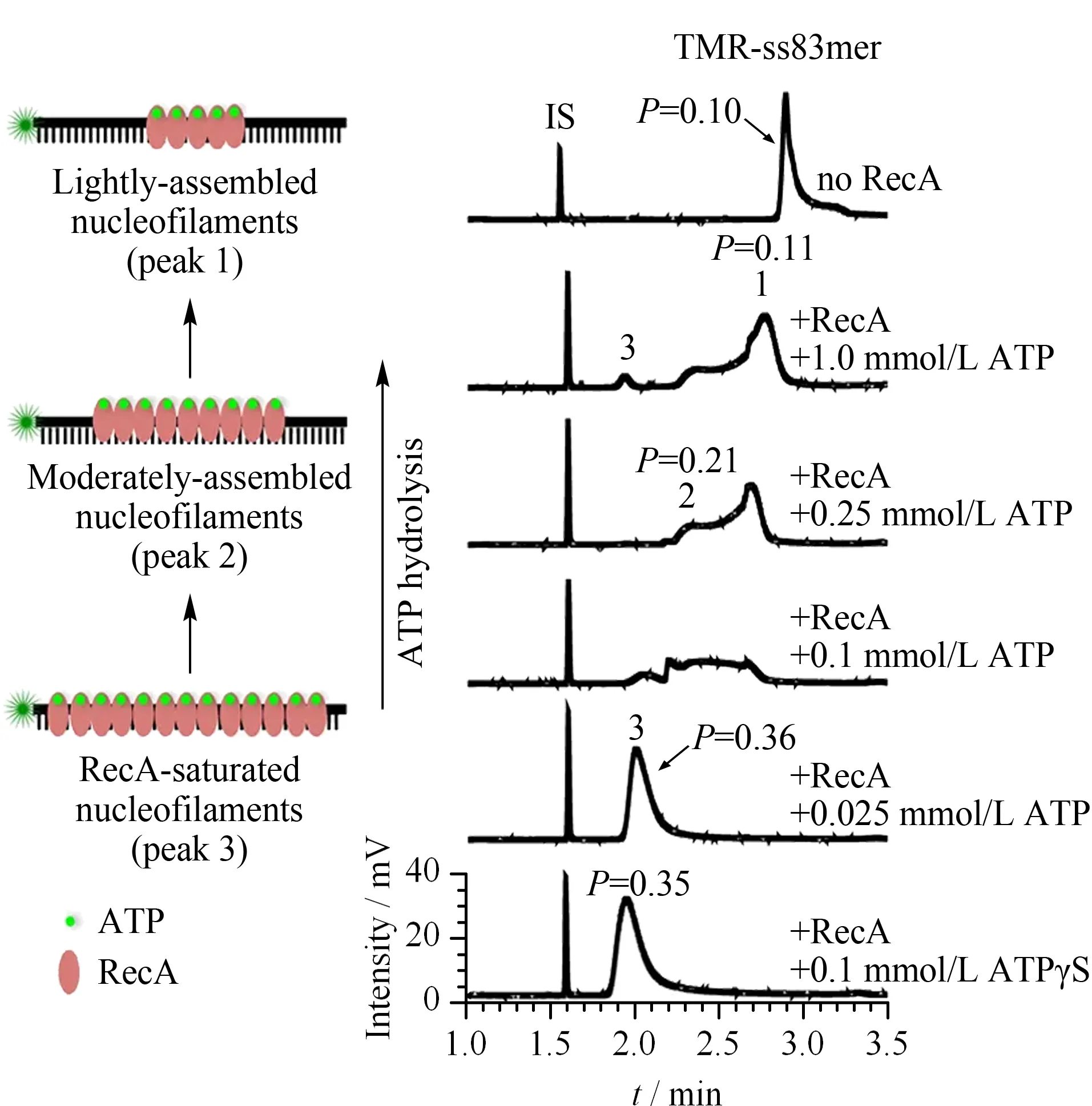
图 2 CE-LIFP鉴定3种RecA核蛋白纤维复合物的形成[34]Fig. 2 Capillary electrophoresis-laser-induced fluorescence polarization (CE-LIFP) identification of the formation of three types of RecA nucleofilaments[34]
同源重组通路不仅可以通过修复DNA双链断裂维持基因组的稳定性,还可以导致等位基因交换促进生物遗传多样性。RecA/Rad51家族蛋白是同源重组过程的核心功能分子,其在介导同源重组时首先需要在单链DNA上组装形成核蛋白纤维复合物,然后以此寻找同源的双链DNA并与之发生链交换以启动DNA合成实现双链断裂的精准修复。Zhao等[34]利用CE-LIFP技术对大肠杆菌同源重组酶RecA蛋白在单链DNA上的组装情况行了深入研究,发现其在生理条件下可以通过自身DNA依赖的ATP水解活性紧密调控组装过程,形成不同结合计量比的高、中、低3种密度的核蛋白纤维复合物(见图2)。ATP水解会促进RecA在单链DNA上的解离,形成极低密度的不饱和RecA核蛋白纤维复合物。在这种不饱和的RecA核蛋白纤维复合物结构中,单链DNA的绝大部分核苷未被RecA结合,电镜成像及酶切保护等分析一致证明了这一结果。进一步的体外链交换和体内同源重组实验均表明这种低密度、不饱和的核蛋白纤维复合物是成功介导大肠杆菌同源重组的活性形式。这一发现改变了对传统同源重组通路中关键核蛋白纤维复合物基础结构的认识,为深入理解同源重组修复机制提供了理论依据。
3 基于蛋白质-DNA相互作用的应用研究
亲和毛细管电泳技术不仅可以探索未知相互作用的分子机制,还可以利用一些已知的特异性相互作用发展新的分析方法用于相关目标分子及目标反应的检测。目前,在亲和毛细管电泳中用到的蛋白质-DNA相互作用主要包括3类:抗原-抗体,DNA结合蛋白与底物,核酸适配体与靶蛋白。
3.1 基于抗体的毛细管电泳分析
基于抗原-抗体特异性相互作用的免疫分析是生化实验室最为常见的定性定量及可视化分析手段。Heegaard[35]利用毛细管电泳技术考察了磷酸化酪氨酸与不同抗体的结合亲和力,并据此证明了免疫亲和毛细管电泳技术的可行性。Le等[36]结合免疫亲和毛细管电泳与LIF检测技术发展了一种快速超灵敏的DNA胸腺嘧啶二醇分析方法,检出限低至3×10-21mol,比原来的检测灵敏度提高了4~5个数量级。他们还利用此方法研究了A549细胞经辐射诱导后胸腺嘧啶二醇的修复过程,并提出了一种诱导修复机制。Carnelley等[37]制备了一种90个碱基长度的含有一个邻二醇环氧苯并[a]芘(BPDE)加合物的DNA探针(BPDE-90 mer),并利用CE-LIF技术考察了3种单克隆抗体与该探针的结合亲和力。Tan等[38]利用该探针发展了一种竞争性免疫亲和毛细管电泳方法用于检测A549细胞基因组中BPDE加合物水平。Wang等[39]利用这种竞争性免疫亲和毛细管电泳方法对BPDE加合物探针与其抗体结合的化学计量学进行了研究,结果表明抗BPDE-dG的IgG型抗体的两个半抗原结合位点可以分别与两个探针分子结合,形成1∶2(抗体∶BPDE加合物)的三元复合物,但形成三元复合物的比例与DNA探针的长度及加合物与抗体的相对浓度有关。作者实验室在此基础上制备了4种不同的立体异构BPDE-DNA加合物荧光探针,并利用特异性抗体和免疫亲和毛细管电泳技术对它们进行了系统表征,证明了每个探针分子上都只有单个BPDE加合物[40-43]。

图 3 (a)竞争性免疫实验与(b)非竞争性免疫实验检测BPDE-DNA加合物Fig. 3 (a) Competitive and (b) non-competitiveimmuno-assay to detect BPDE-DNA adducts
Wang等[44]进一步发展了更加灵敏的非竞争性免疫亲和毛细管电泳技术检测基因组的BPDE加合物水平。与竞争性免疫分析(见图3a)不同,在非竞争性免疫分析(见图3b)中,除了需要加入能特异性识别DNA加合物的一级抗体(一抗)外,还需要加入荧光标记的二级抗体(二抗)。需要注意的是,在这一反应体系中存在3种荧光标记的物质:游离的二抗、二抗-一抗二元复合物、二抗-一抗-DNA加合物三元复合物。由于DNA的等电点更低,很容易通过高效毛细管电泳将含有DNA加合物的三元复合物从混合体系中分离出来从而实现定性定量分析。Shen等[45]利用这种非竞争性的免疫分析方法研究了砷和苯并[a]芘在细胞水平的相互作用,结果显示三价无机砷可通过增强BPDE的细胞吸收促进BPDE-DNA加合物的形成。为了增强免疫亲和毛细管电泳技术的稳定性,提高检测灵敏度,作者团队在研究过程中还提出了许多策略,如在样品中加入牛血清白蛋白(BSA)或免疫球蛋白(IgG)等非特异性蛋白可增强免疫复合物的形成,显著提高实验的重现性[46];利用DNA聚焦方法可将较低浓度的免疫复合物富集于一狭窄区带,从而显著提高分离效率和检测灵敏度[47];利用量子点标记的二抗可将BPDE-DNA加合物的检测灵敏度提高至6.6×10-21mol,从而实现体内痕量DNA加合物的定量分析[48]。
除了DNA加合物,免疫亲和毛细管电泳技术还可用于DNA修饰的分析。Wang等[49]利用CE-LIFP技术发展了一种非竞争性的免疫亲和毛细管电泳方法用于基因组DNA整体5mC水平的检测。由于荧光偏振检测可以反映相对分子质量的大小,高灵敏的LIFP检测可以在无需进一步分离的情况下排除脱落的小分子荧光染料对待测免疫复合物荧光信号的干扰。与之前的胶束毛细管电泳方法相比[50-52],这种免疫亲和毛细管电泳方法具有很多优势:(1)样品前处理简单,DNA样品只需经过简单的变性处理,无需经过耗时的酶解消化处理,更不需要经过复杂的共价衍生化处理;(2)分析时间短,每针样品的分离时间不到1.2 min; (3)检测灵敏度更高,样品消耗量更低,仅需消耗0.1 ng的基因组DNA。利用这种免疫亲和毛细管电泳方法可以对环境污染物的表观遗传毒性进行快速评价,Wang等[53]进一步考察了4种醛类化合物和6种苯醌类化合物对DNA甲基转移酶(DNMT)活性的影响,结果显示卤代苯醌对DNMT酶活的抑制作用最强。
3.2 基于DNA结合蛋白的毛细管电泳分析
生命体系中存在一系列参与DNA代谢的蛋白质,具有不同的DNA结合能力,可以被用于发展多种生物工程或生命分析的工具。单链DNA结合蛋白(single-stranded DNA binding protein, SSB)就是这其中一类典型的蛋白质,其选择性地与代谢过程中产生的单链DNA结合。Berezovski等[54]通过将SSB蛋白添加到电泳缓冲液中发展了一种SSB介导的亲和毛细管电泳方法用于加速DNA或RNA的杂交检测。在这一方法中,首先将高浓度荧光标记的DNA杂交探针与待测DNA或RNA充分孵育形成双链分子,然后进样至毛细管电泳进行分离分析,通过在电泳缓冲液中添加SSB蛋白与剩余的单链DNA探针结合从而改变其迁移速率。这种方法已经被成功应用于聚合酶链式反应(polymerase chain reaction, PCR)产物、胞内信使RNA(message RNA, mRNA)、microRNA(miRNA)的快速定量分析[55-58]。Wegman等[58]利用这种技术发展了可以同时定量分析多种miRNA的方法(DQAMmiR)。为了实现多种miRNA的同时直接定量分析,除了在电泳缓冲液中添加SSB蛋白以外,还需要对不同序列的DNA探针修饰不同的标签(生物素、氨基酸等)以改变杂交后双链分子的荷质比从而实现分离分析。通过不断优化探针浓度、缓冲液组成、分离温度等实验条件,DQAMmiR方法的检出限已经可以低至1 pmol/L,并且可以实现单核苷差异的miRNA检测[59-63]。Hu等[64]利用此方法对细胞裂解原液的miRNA进行了准确的定量分析,并将其与实验室的标准方法——定量逆转录聚合酶链式反应(quantitative reverse transcription-polymerase chain reaction, qRT-PCR)技术进行了比较,结果显示DQAMmiR方法具有更好的测量准确度与精度。Hu等[65]还在此基础上利用中性的肽核酸(peptide nucleic acids)探针发展了不需要添加SSB的第二代DQAMmiR方法。
作者团队最近利用亲和毛细管电泳技术考察了不同长度单链DNA与SSB蛋白的结合亲和力及解离速率,发现当单链DNA大于30个碱基长度时,其与SSB形成的复合物非常稳定,在CE分离过程中几乎不会解离(koff< 0.004/s)[66]。我们进一步利用这种超稳定的相互作用发展了一种高亲和力且不解离的ACE分析方法并将其成功应用于DNA分子杂交及链交换反应的快速高灵敏检测。如图4所示,只需将SSB蛋白加入反应完成后的样品中,待孵育达到平衡后,即可利用CE-LIF对样品进行快速分离分析。与传统的凝胶电泳技术相比,这种高亲和力且不解离的ACE分析方法在分析时间和样品消耗等方面显示出巨大的优势。另外,结合在线LIF检测技术,该方法具超高的灵敏度,可以检测到50 pmol/L的单链DNA介导的链交换反应。
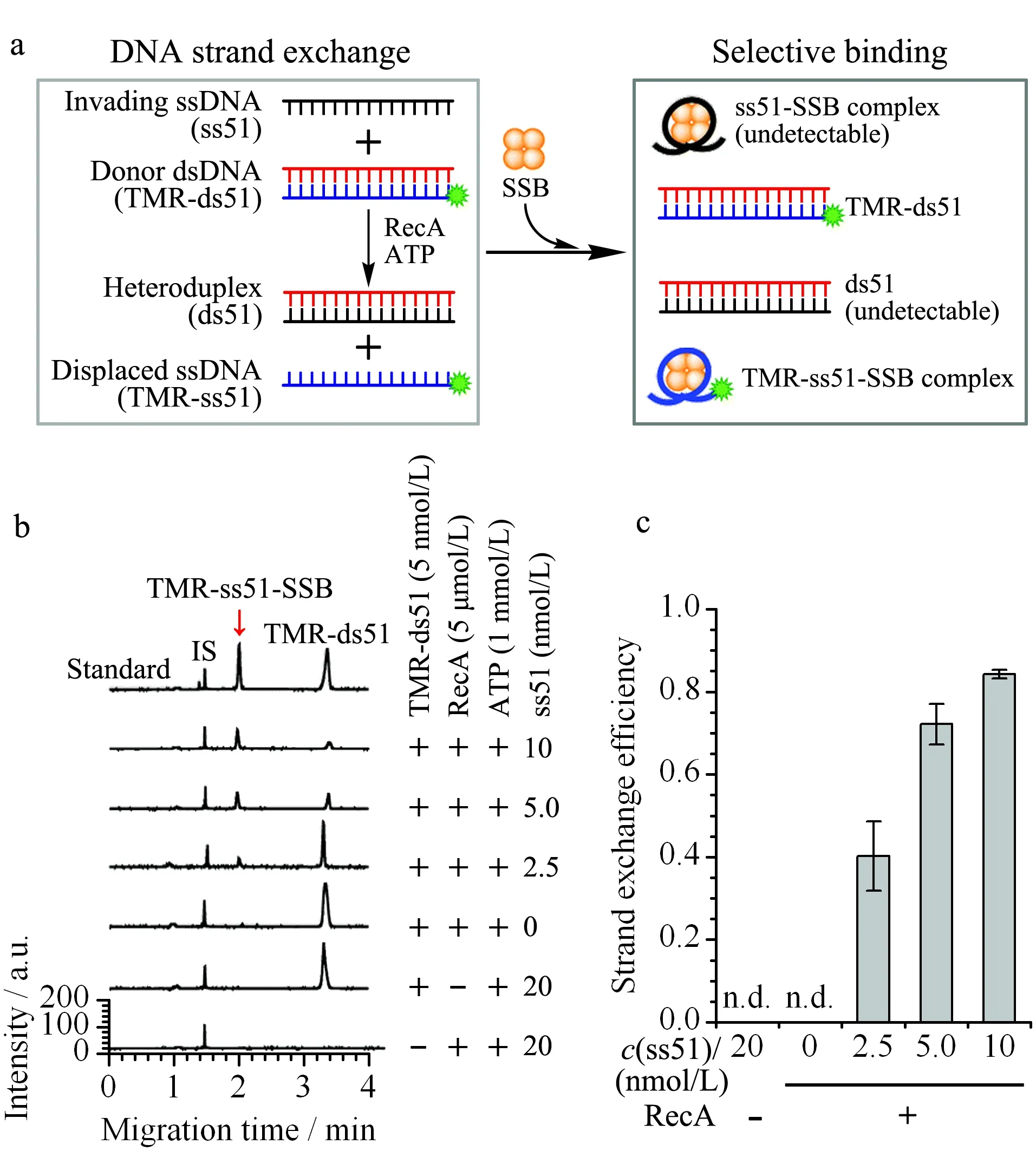
图 4 超稳定SSB蛋白介导的毛细管电泳快速分析DNA链交换反应[66]Fig. 4 Undissociated SSB binding-mediated capillary electrophoresis for rapid analysis of DNA strand exchange reactions[66] a. schematic illustration of the DNA strand exchange reaction (left panel) and the selective binding of SSB for the subsequent CE-LIF analysis (right panel); b. representative electropherograms obtained from the CE-LIF analysis of RecA-catalysed DNA strand exchange reactions; c. bar plot of the detected strand exchange efficiency.
单核苷酸多态性(single nucleotide polymorphism, SNP)是基因组DNA中广泛存在的由单个核苷酸突变引起的一种DNA序列多态性,与许多遗传疾病的发生有关。SNP的分析检测在机理研究、临床诊断及药物开发等方面具有重要意义。Drabovich等[67]利用DNA碱基错配修复通路中MutS蛋白与单碱基错配位点的特异性结合能力发展了一种亲和毛细管电泳方法用于对目的片段特定位点的SNP进行快速检测。该方法首先需要将目的片段与荧光标记的双链DNA探针混合,通过变性再复性等操作获得含有碱基错配的双链DNA。由于MutS蛋白与不同类型单碱基错配的结合亲和力差异,该方法只需通过双链DNA片段的电泳迁移时间而不需要通过DNA测序技术即可识别目的位点的碱基类型。
3.3 基于核酸适配体的毛细管电泳分析
核酸适配体是一类对靶标分子可特异性结合的单链DNA或RNA寡核苷酸序列,通常由15到80个核苷酸组成。作为一种新型的生物识别分子,核酸适配体具有廉价易得、稳定性好、易改造修饰等优点,已经被广泛用于发展各类生物传感器及分析方法,包括亲和毛细管电泳技术[68-85]。German等[67]将荧光标记的核酸适配体作为亲和探针引入毛细管电泳实现了对靶蛋白IgE的分离分析。该方法的线性范围达5个数量级,最低检出限低至46 pmol/L,并且特异性非常好,不受IgG蛋白的干扰,可以用于血清样品的直接检测。他们进一步利用凝血酶的检测实验证明了核酸适配体作为亲和探针的可靠性。X. Chris Le教授研究组[69]利用荧光标记的核酸适配体RT26作为亲和探针结合CE-LIF技术发展了一种特异性检测人免疫缺陷病毒逆转录酶(human immunodeficiency virus-reverse transcriptase, HIV-RT)的方法,该方法可以实现未结合自由探针与结合复合物的基线分离。他们在此基础上结合PCR技术进一步发展了一种超灵敏的检测痕量蛋白质的方法[72]。该方法首先通过高效毛细管电泳将靶蛋白-核酸适配体复合物从自由探针中分离并收集,然后将收集到的组分作为模板加入PCR体系,通过检测PCR的扩增产物即可实现对靶蛋白的痕量分析。由于PCR的信号放大作用,该方法的检出限低至180个分子,为蛋白组学研究及临床诊断提供了强有力的技术支撑。此外,该课题组还发展了一种可调适配体毛细管电泳方法用于多种蛋白质的同时检测[76,78]。虽然改变DNA的长度并不会改变其自身的荷质比,但可以改变核酸适配体-靶蛋白复合物的荷质比。因此,可以通过调节各个核酸适配体的长度改变其与靶蛋白结合后复合物的电泳迁移速率,实现多种蛋白质的分离检测。Lin等[81]利用这种可调适配体毛细管电泳方法结合微流控芯片技术同时对3种蛋白质进行了快速定量分析。Zhu等[85]将特异性的核酸适配体引入通用的微芯片毛细管电泳(microchip capillary electrophoresis, MCE)装置发展了一种快速检测细胞色素C的方法,可以在135 s内对低至0.4 nmol/L的靶标蛋白进行定量分析。Zhao[86]利用MCE装置结合核酸适配体触发的荧光信号放大技术可以检测出人血清中低丰度的癌胚抗原。
核酸适配体与靶蛋白的结合亲和力直接影响亲和毛细管电泳方法的分离效率、检测灵敏度及特异性,因此提高核酸适配体的亲和力对于分析方法的发展十分重要。值得注意的是,已经发展了多种基于CE的核酸适配体筛选方法并得到了广泛应用[87-101]。传统的指数富集配体系统进化(systematic evolution of ligands by exponential enrichment, SELEX)技术需要将靶标分子固定在固相基质(如磁珠等)表面,通过固液分离将具有靶标结合能力的核酸适配体从核酸文库中筛选出来。基于固相基质的SELEX技术很容易引起核酸文库的非特异性吸附,降低筛选效率;另外,靶标分子的固定化也可能带来空间位阻效应,不利于适配体与靶标的结合。而基于CE的SELEX技术能避免上述问题,提高筛选效率。Zhu等[102]发展了基于在线反应的一步CE法用于快速筛选靶标蛋白的核酸适配体,该方法通过控制分离电压实现了核酸适配体与靶标蛋白的在线反应及反应后生成复合物的分离鉴定。Li等[103]将磁珠筛选技术与CE筛选技术相结合,充分发挥各自的优势,通过多轮筛选获得了高亲和力和高选择性的糖蛋白适配体。最近,Le等[104,105]发展了一种理想过滤毛细管电泳技术(ideal-filter capillary electrophoresis, IFCE)只需一步筛选即可获得针对靶蛋白的高亲和力核酸适配体。该方法通过调节电泳缓冲液的离子强度控制电渗流速度,使结合靶标的核酸适配体与未结合靶标的核酸适配体在毛细管中的迁移方向相反,从而极大地提高了筛选效率。另一方面,Bai等[106]通过CE-LIF技术发现在核酸适配体Apt15的3’末端增加18~25个重复T碱基可以将其结合凝血酶的亲和力提高100倍以上,从而在电泳过程中检测到稳定的复合物峰。作者在此基础上提出了一种多重协同作用增强核酸适配体亲和力的策略,并将其成功应用于IgE核酸适配体的亲和力增强。
4 总结与展望
蛋白质-DNA相互作用的分子机制研究不仅有利于我们更好地认识基本的生命过程,还可以帮助开发新的分析检测技术与方法。鉴于毛细管电泳技术分离效率高、分析时间短、样品消耗少、操作简便等诸多优势,其已在蛋白质-DNA的相互作用研究中发挥了重要作用。由于DNA的荧光标记相对简单,高灵敏的LIF检测器是蛋白质-DNA相互作用研究中最常用的检测手段。CE-LIF(P)技术在成功应用于核苷酸切除修复、同源重组修复等生命过程中蛋白质-DNA相互作用研究的同时,还发展了多种高灵敏分析方法用于痕量DNA加合物、碱基修饰、重要蛋白质等生物标志物的检测。但是截至目前,毛细管电泳技术样品消耗少和高通量的优势尚未在此领域的研究中得到充分发挥。在未来的研究中,可充分利用这两点优势,分别发展用于少量珍贵生物样品的高灵敏检测方法和用于大量未知因素筛选评价的高通量分析方法。鉴于其在核酸适配体筛选方面的成功应用,亲和毛细管电泳技术在蛋白质作用位点的快速筛选方面应该也大有可为。例如,结合测序技术鉴定转录因子、甲基转移酶等蛋白质与基因组DNA的特异性结合位点。另外,还需注意结合先进的质谱技术或蛋白组学研究手段以鉴定可与DNA发生特异性相互作用的未知蛋白质。
致谢 感谢汪海林教授课题组博士研究生刘艳同学在图片绘制过程中提供的帮助。
