水牛SIRT6 基因shRNA 干扰慢病毒载体构建与验证
2020-09-18程隽如杨素芳崔佳瑜石德顺邓彦飞
程隽如,杨素芳,崔佳瑜,石德顺,邓彦飞
(广西大学亚热带农业生物资源保护与利用国家重点实验室,广西南宁 530004)
Sirtuins 是一类高度保守的烟酰胺腺嘌呤二核苷酸(NAD+)依赖性酶,哺乳动物有7 个不同的Sirtuins(SIRT1、SIRT2、SIRT3、SIRT4、SIRT5、SIRT6、SIRT7),它们位于不同的细胞区室,具有多种催化活性。其中,SIRT6定位于细胞核,目前已知具有3 种酶活性,即NAD+依赖性组蛋白去乙酰化酶[1]、单ADP核糖基转移酶[2]和长链脂肪酸酯酶[3],SIRT6通过数种催化功能在细胞及生物个体上参与多项生理活动。一方面,SIRT6基因是哺乳动物重要的长寿基因之一。Mostoslavsky 等[4]在缺乏SIRT6基因的小鼠中观察到脊柱弯曲异常、皮下脂肪急性损失、淋巴细胞严重减少、代谢紊乱、寿命缩短等早衰症状,而SIRT6过表达可延长雄性(而非雌性)的寿命15%[5]。另一方面,SIRT6 通过维护端粒、促进DNA 双链损伤修复和碱基切除修复维持基因的稳定性[6]。同时,SIRT6 是能量代谢的关键调节剂,SIRT6 通过降低Hif1α的活性抑制糖酵解[7],通过抑制肝脏糖异生减少葡萄糖的生成[8]、抑制甘油三酯的合成和脂肪酸的摄取、促进脂肪酸的β-氧化等代谢活动,从而维持代谢稳态[9-10]。此外,SIRT6 还参与干细胞的重编程[11]、癌症的发生和发展[12]、炎症反应[13]等生物活动。目前,研究人员正在确定靶向SIRT6 的治疗剂,这些治疗剂可能在衰老、癌症、神经退行性疾病,心脏病、肥胖症和糖尿病[14-18]等多种人类疾病中具有广泛的用途。
不仅如此,SIRT6 在畜牧业中也有应用性研究。Gui 等[19]在秦川牛SIRT6基因外显子区发现4 个SNP位点并证实SIRT6 多态性与个体的背膘厚度、肌内脂肪含量和眼肌面积等胴体质量性状有关。Rincon 等[20]研究也表明SIRT6基因的多态性与育肥牛的胴体品质和生长效率性状有关。此外,SIRT6 启动子区的SNP 位点与肉牛脂肪沉积有关[21]。这些研究表明SIRT6 在牛群标记辅助选择以及改善肉质方面至关重要。
目前,SIRT6 在人与小鼠上的研究较为广泛,在家畜上研究较少,并且尚未有水牛SIRT6 相关研究报道,故水牛SIRT6基因对细胞功能的研究具有重要意义。本研究以水牛胎儿成纤维细胞作为研究模型,构建SIRT6基因RNA 干扰慢病毒载体,并鉴定转染的有效性,为该基因在水牛上的研究与运用奠定基础。
1 材料与方法
1.1 主要材料 大肠杆菌DH5α感受态细胞、水牛胎儿成纤维细胞、293T 细胞、Psi-LVRU6GP 慢病毒质粒、VSVG 包膜质粒及NRF 包装质粒均为广西大学亚热带农业生物保护与利用国家重点实验室保存。
1.2 主要试剂 Trizol 试剂购自Invitrogen 公司;PCR试剂金牌 Mix(green) Golden Star T6 Super PCR Mix购自北京擎科新业生物公司;琼脂糖凝胶DNA 回收试剂盒、质粒提取试剂盒均购自北京天根化科技有限公司;反转录试剂盒、SYBR 定量试剂均购自诺唯赞公司;去内毒质粒提取试剂盒购自OMEGA 公司;LB 培养基购自北京金桥科技公司;Taq 酶、内切酶(EcoRI和BamHI)和T4 连接酶购自TaKaRa 公司;胎牛血清(FBS)、DMEM 细胞完全培养基、胰蛋白酶、PBS 缓冲液、青链霉素等购自Gibco 公司;多聚赖氨酸(Poly-D-lysine)购自Sigma 公司;罗氏转染试剂(X-tremeGENE HP DNA)购自Rhoce 公司;引物合成和序列测定在上海生工进行。
1.3 实验方法
1.3.1 shRNA 的设计与合成 根据THEROMO FISHER 公司的siRNA 在线设计网站(http://rnaidesigner.thermofisher.com/rnaiexpress/),针对本实验室前期扩增出的水牛SIRT6基因的CDS(Coding Sequence)序列[22]筛选干扰序列,由于该网站没有牛和水牛的基因库,于是比对了人、鼠的基因库,最后挑选出2 条保守性较好、分值较高的目标序列进行shRNA 设计,目标序列见表1。shRNA 序列设计原则:F 链5'→3'按照酶切位点(BamHI)、干扰序列、loop 环(TCAAGAG)、干扰序列的反向互补序列、中止信号(TTTTTT)、酶切位点(EcoRI)的顺序;R 链5' →3' 按照酶切位点(EcoRI)、中止序列的互补序列(AAAAAA)、干扰序列、loop 环的反向互补序列(CTCTTGA)、干扰序列的反向互补序列、酶切位点(BamHI)的顺序。
1.3.2 慢病毒干扰载体的构建及验证 将合成好的寡核苷酸单链经退火后形成双链shRNA,产物与Psi-LVRU6GP 载体分别用BamHI 和EcoRI 限制性内切酶进行双酶切反应,分别回收酶切产物,利用T4 连接酶将回收的双链shRNA 与线性化的Psi-LVRU6GP 载体进行连接反应。连接体系:线性化的Psi-LVRU6GP 载体100 ng、双链shRNA 500~1 000 ng、T4 DNA ligase1 µL、10×T4 DNA ligase Buffer 2 µL、50% PEG 4000 solution 2 µL,ddH2O 补至20 µL,混匀后置于16 ℃环境过夜。连接产物分别命名为Psi-sh1-LVRU6GP、Psi-sh2-LVRU6GP,设未连接干扰序列的空白质粒为阴性对照(Negative Control,NC),命名为Psi-NC-LVRU6GP。连接完后进行转化、挑菌,以菌液为模板进行PCR 鉴定、测序验证,重组质粒验证成功后可进行去内毒素质粒提取。
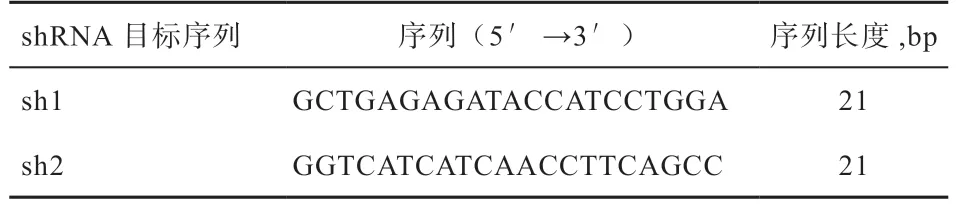
表1 水牛SIRT6 shRNA 干扰序列
1.3.3 慢病毒包装 293T 细胞和水牛胎儿成纤维细胞37℃复苏后,在37℃、5% CO2环境中培养,待细胞汇合度达60%~70%时转染。取500 µL 无血清无抗生素的DMEM,目的质粒与慢病毒包装载体NRF、VSVG 按照质量比5:3:2 混合,再加入转染试剂X-treme GENE HP DNA Transfection Reagent(目的质粒∶转染试剂=1:1.5),混匀,室温孵育15 min 后,逐滴加入293T细胞培养液中;12~24 h 内更换新鲜的细胞培养液,转染60 h 后收集细胞培养液,即病毒液,用0.45 µm 的滤器过滤、分装后置于-80℃备用。
1.3.4 慢病毒感染水牛成纤维细胞 将BFF 解冻复苏后,传至第4 代,待细胞汇合度为60% 左右时,每皿细胞分别加入1 mL 病毒液和2 mL 细胞培养液,再添加6 µg/mL Polybrene 促进感染。在第1 次病毒感染16~18 h 后弃细胞培养液进行第2 次感染,加入1 mL 病毒液和2 mL 细胞培养液重新感染至细胞汇合度至95%以上,观察绿色荧光表达情况,并传代进行后续实验。每处理重复3 次,以未转染外源基因的细胞为空白对照组,转染Psi-LVRU6GP 空载体作为质粒对照组。
1.3.5 水牛成纤维细胞SIRT6基因的mRNA 表达 用Trizol法分别提取2 个处理组与2 个对照组水牛成纤维细胞的RNA,反转录获得cDNA,以β-actin为内参基因,通过qRT-PCR 反应检测SIRT6基因的mRNA 表达量。反应体系20 µL:上、下游引物各0.4 µL,模板(100 ng/µL)1 µL,2× chamQ Universal SYBR qPCR Master Mix 10 µL,三蒸水补至20 µL。反应程序为95℃预变性5 min,95℃变性15 s、60℃退火50 s,变性、退火40 个循环。引物序列见表2。每个样本重复3 次,采用2-△△CT方法计算目的基因的表达情况。

表2 引物序列
1.4 统计分析 荧光定量PCR 采用2-△△CT方法进行计算,每处理重复3 次;数值用SPSS Statistics 软件单因素方差分析进行统计学分析;以P<0.05 为差异显著,具有统计学意义。
2 结果
2.1 慢病毒干扰载体的构建及验证 用限制性内切酶BamHI 和EcoRI 双酶切Psi-LVRU6GP 空白载体,回收线性化的载体。用T4 连接酶将shRNA 目的序列与线性化载体连接后,重组质粒进行琼脂糖凝胶电泳(图1-A)及测序验证(图1-B),成功获得Psi-sh1-LVRU6GP,Psi-sh2-LVRU6GP 2 个干扰载体。

图1 Psi-shRNA 重组载体序列鉴定
2.2 慢病毒包装 将Psi-sh1-LVRU6GP、Psi-sh2-LVRU6GP及Psi-NC-LVRU6GP 质粒分别与NRF 和VSVG 共转染293T 细胞,进行慢病毒包装。转染48 h 后,荧光显微镜观察到明显的绿色荧光蛋白(Green Fluorescent Protein,GFP)表达(图2),转染效率达70%以上,细胞状态正常。

图2 慢病毒包装48 h 后GFP 表达(100
2.3 慢病毒感染水牛成纤维细胞 收集病毒悬×)液,分别感染第4 代水牛胎儿成纤维细胞,感染36 h 后,2 个shRNA 干扰组与质粒对照组均可观察到GFP 表达,而空白对照组无GFP 表达(图3)。以上结果表明,所构建的shRNA 干扰载体能成功转入水牛胎儿成纤维细胞,并表达。

图3 病毒液感染BFF 36h 后GFP 表达(100
2.4 水牛SIRT6基因shRNA 干扰效率的鉴定× ) 分别收集2 个shRNA 干扰组、质粒对照组和空白对照组中BFF,通过qRT-PCR 检测SIRT6表达水平来判断shRNA 的干扰效率。如图4 所示,干扰质粒均能够有效抑制BFF 细胞中SIRT6基因的表达,blank、Psi-NCLVRU6GP、Psi-sh1-LVRU6GP、Psi-sh2-LVRU6GP 表达量分别为1.00、0.86、0.34、0.06,2 个shRNA 干扰与质粒对照组相比均差异显著。其中Psi-sh2-LVRU6GP感染组SIRT6表达量最低,干扰效率最高。
3 讨 论
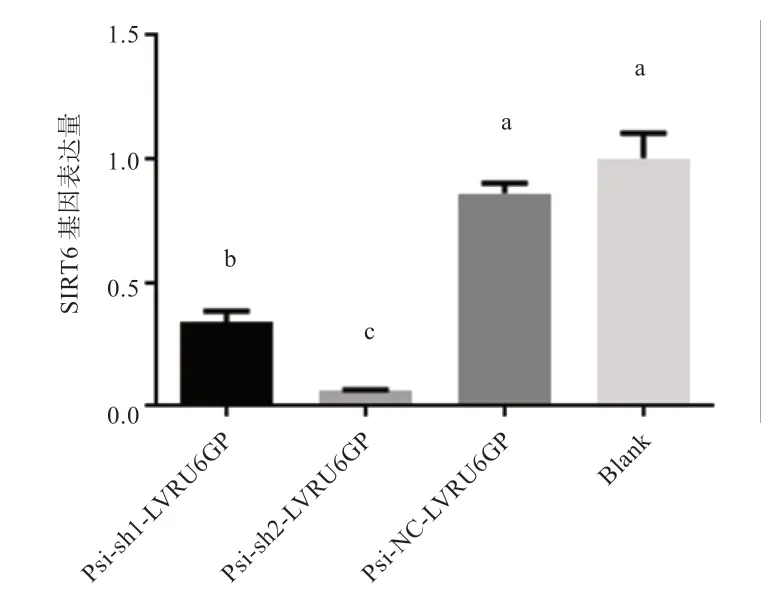
图4 慢病毒感染后SIRT6 表达差异
SIRT6 是一种复杂的酶,具有多种底物和催化活性,最主要的是NAD+依赖性组蛋白去乙酰化酶活性。目前已知的底物有组蛋白H3 第9 位赖氨酸残基(H3K9)[23]、组蛋白H3 第56 位赖氨酸残基(H3K56)[24]、组蛋白H3第18 位赖氨酸残基(H3K18)[25]。Michishita 等[23]研究发现,敲低人的胚胎肺成纤维细胞(WI-38)SIRT6基因之后H3K9 超乙酰化,H3K9 成为首个被发现的SIRT6 酶活底物。随后有研究表明,H3K56 乙酰化水平在SIRT6基因敲除的小鼠胚胎成纤维细胞(MEF)中显著增加[24]。近年来,人们发现细胞中SIRT6 的失活导致H3K18 过度乙酰化和异染色质周围转录物的异常积累[25]。SIRT6对这些靶点的去乙酰化作用对于染色质压缩、转录抑制和DNA 损伤修复非常重要[1]。此外,SIRT6 还具有其他酶促机制和底物,它参与DNA 修复和葡萄糖稳态的几种非组蛋白去乙酰化[26],促进某些DNA 修复和染色质沉默因子的ADP-核糖基化[2]、催化长链脂肪酰基的脱酰作用[3],参与调节多种细胞生物过程。
慢病毒载体是以人类免疫缺陷型病毒(HIV)为基础发展起来的新型基因载体,干扰载体包装后感染目的细胞是目前基因沉默中较为直接高效的办法。shRNA在细胞内转录为siRNA,siRNA 可以定位同源目的序列,与之结合并切割达到基因沉默目的,siRNA 具有放大效应,因此只需要少许siRNA 便可高效沉默[27]。慢病毒感染不分细胞时期,相对逆转录病毒以及腺病毒具有制毒周期短、感染效率和外源基因整合效率高的优点,是导入外源基因高效有力的方法[28]。
基于上述情况,本研究利用慢病毒载体干扰技术,设计2 条针对SIRT6基因的shRNA 干扰序列,构建2 种抑制SIRT6基因表达的慢病毒载体,经慢病毒包装,感染细胞后通过实时定量PCR 在mRNA 水平上检验其转染的有效性,筛选出干扰效率最优的Psi-sh2-LVRU6GP 慢病毒载体。此外,本实验的慢病毒载体携带 GFP,可以直观地通过绿色荧光的数量和强度观察转染效率。病毒液感染细胞后可得抑制SIRT6基因表达的细胞株,为后续实验中对比BFF 过表达SIRT6基因和正常表达SIRT6基因细胞株中基因稳定性、细胞衰老、代谢功能等提供依据,也为该基因在水牛上的研究与运用奠定基础。
4 结 论
本研究成功构建了2 种RNA 干扰SIRT6基因表达的慢病毒重组质粒,经慢病毒包装感染水牛成纤维细胞后检测SIRT6mRNA 表达水平,2 个干扰质粒均能显著下调SIRT6的表达,最终筛选出干扰效率最高的载体:Psi-sh2-LVRU6GP。为进一步研究SIRT6在BFF 细胞上的功能提供良好的手段和工具。
