影响附植期猪胚胎形态转变相关基因研究进展
2020-09-18臧旭鹏吴珍芳蔡更元黄思秀洪林君
臧旭鹏,胡 群,吴珍芳,蔡更元,黄思秀,洪林君
(华南农业大学动物科学学院,国家生猪种业工程技术研究中心,广东广州 510642)
窝产仔数是养猪生产中最重要的经济性状之一,从排卵到受精、附植,胚胎生长过程中的每一步都会影响窝产仔数,而附植期对窝产仔数的影响最大。在排卵和受精过程完成后,猪胚胎产前死亡率在20%~46%[1],胚胎发生死亡主要在胚胎附植期[2]。在胚胎附植期,妊娠第12 天是影响胚胎存活的关键时间点,中国太湖猪在其妊娠第12 天时胚胎具有良好的附植状态,降低了胚胎最终死亡率[3]。胚胎死亡率越高,其窝产仔数越少。因此,研究调控附植期胚胎死亡的关键基因及其分子机制具有重要的理论和实践意义。本文综述了猪附植期胚胎发育过程及影响猪胚胎形态转变关键基因,为进一步研究猪早期胚胎附植过程调控机制提供参考。
1 猪附植期胚胎发育过程
猪早期胚胎的正常发育和妊娠的成功建立伴随着相关基因的表达,随着胚胎的发育,不同的基因表现出不同的表达模式,包括周期性的表达等,该阶段共涉及大约10 000 种基因表达模式[4]。在早期妊娠过程中,猪胚胎在附植到子宫表面(即子宫内膜腔上皮)前会经历一个形态学过程上的转变,这个转变会使胚胎与母体建立相互联系时有一个最大的接触面积,这对于母体妊娠的识别和胚胎在附植前的正常发育至关重要,是猪胚胎成功附植、母体成功妊娠的必要前提条件[5]。此外胚胎与母体子宫接触面积增大也促进了胚胎从子宫获取更多的营养物质[2]。猪胚胎从成功受精形成合子后开始正常发育,大约在受精后的第60~72 小时即发育到桑葚胚阶段,胚胎开始进入子宫。在妊娠的第5 天左右发育至囊胚阶段,并在第8天左右开始孵化[6]。孵化后,猪胚胎继续生长,在第10 天左右形成一个直径为2~6 mm 的球形胚胎,随后转变成卵圆形并进一步转变为管形胚胎[7],在妊娠第11~12 天,管形胚胎在1~2 h 内迅速伸长转变为细长的丝状胚胎,长度为100~150 mm(图1)[8]。胚胎的伸长涉及外胚层的分化和中胚层的生长,滋养外胚层接头复合物的松动使得细胞可以相互移动,有利于内胚层细胞的迁移和重塑,进而促进丝状胚胎的形成[9]。之后胚胎继续发育,不过此时的胚胎不会再像第11~12 天时那样迅速伸长,而是进入一个相对缓慢的伸长发育阶段,直到第18 天左右胚胎与子宫上皮内膜相接触,引发上皮绒毛膜胎盘的形成[10]。猪胚胎的快速伸长、形态学上发生剧烈转变的阶段,被称之为胚胎的形态转变期。由于猪胚胎从球形到丝状胚胎的形态转变主要靠滋养层细胞的迁移和重组,因此又被称为猪胚胎滋养层的快速伸长期[11]。
2 调控猪胚胎形态转变的关键基因
猪胚胎的成功附植受到一系列生物学过程的调控,包括猪胚胎发育及形态转变,胚胎-母体相互作用以及母体妊娠识别[12-14]。其中,猪胚胎形态转变是影响猪胚胎能否成功附植的关键,近年来,调控胚胎形态转变的关键基因被陆续发现,如成纤维细胞生长因子4(Fibroblast Growth Factor 4,FGF4)、白细胞介素-1β亚型2(IL1B2)以及干扰素(IFNs)基因。
2.1FGF4基因 FGF4 是由外胚层(Epiblast)产生[15]的一个多能性生长因子,其化学成分是一个小的多肽,属于肝素结合生长因子家族成员[16],能够诱发多种类型的组织和细胞完成不同的生物学功能,被证实能够促进滋养层细胞的增殖[17],在妊娠第12 天时表达量增加[18]。研究表明,胚胎的生长伴随着旁分泌信号所引发的正反馈回路(Feed-Back Loop),该反馈回路可以促进细胞的特定分化[19]。FGF4 和骨形态发生蛋白4(Bone Morphogenesis Protein 4,BMP4)都是诱导型信号,参与正在发育的胚胎外胚层和胚外胚层(Extraembryonic Ectoderm,ExE)之间的信号交流[20]。FGF4 在滋养外胚层细胞上的受体成纤维细胞生长因子受体2(Fibroblast Growth Factor Receptor 2,FGRFR2)的激活是胚胎或子宫内膜通过磷脂酰肌醇3-激酶/AKT 通路来转导FGF4信号完成的,AKT 信号通路中p-AKT、p-P90RSK、p-RPS6 蛋白的增加与滋养外胚层细胞的迁移活动相关联,对胚胎发育至关重要[21]。外胚层产生的FGF4 与滋养外胚层上FGRFR2 的结合,会诱导丝裂原活化蛋白激酶(MAPK/ERK)的磷酸化来激活MAPK/ERK,这将触发一个信号转导通路反应,从而刺激CDX2 的表达,诱导中胚层细胞(Mesoderm)产生BMP4[22]。AKT 和MAPK 细胞信号通路的传导,能够调节脂联素的表达[23],涉及细胞增殖、细胞死亡、细胞黏附等过程来影响胚胎的附植[24]。CDX2 将和Eomes、ELF5 一起构成1 个基因调节网络的一部分,能够促进胚外胚层(ExE)滋养层细胞的发生[25]。CDX2 也将促进BMP4 的表达[26],通过反馈回路,反馈回外胚层来诱导中胚层的分化[27],由新生的中胚层细胞来产生BMP4,产生的BMP4 将激活CDX2 和ELF5,使得滋养外胚层细胞中SMAD1/5/8磷酸化增加,活化发挥作用[20]。敲除FGF4和FGFR2后,胚胎不会形成内胚层细胞系,同时该时期FGF4-FGFR2信号体系的表达,与胚胎附植期死亡率最高这一时间吻合,表明了FGF4-FGFR2 信号体系对胚胎发育的重要性[28-29]。
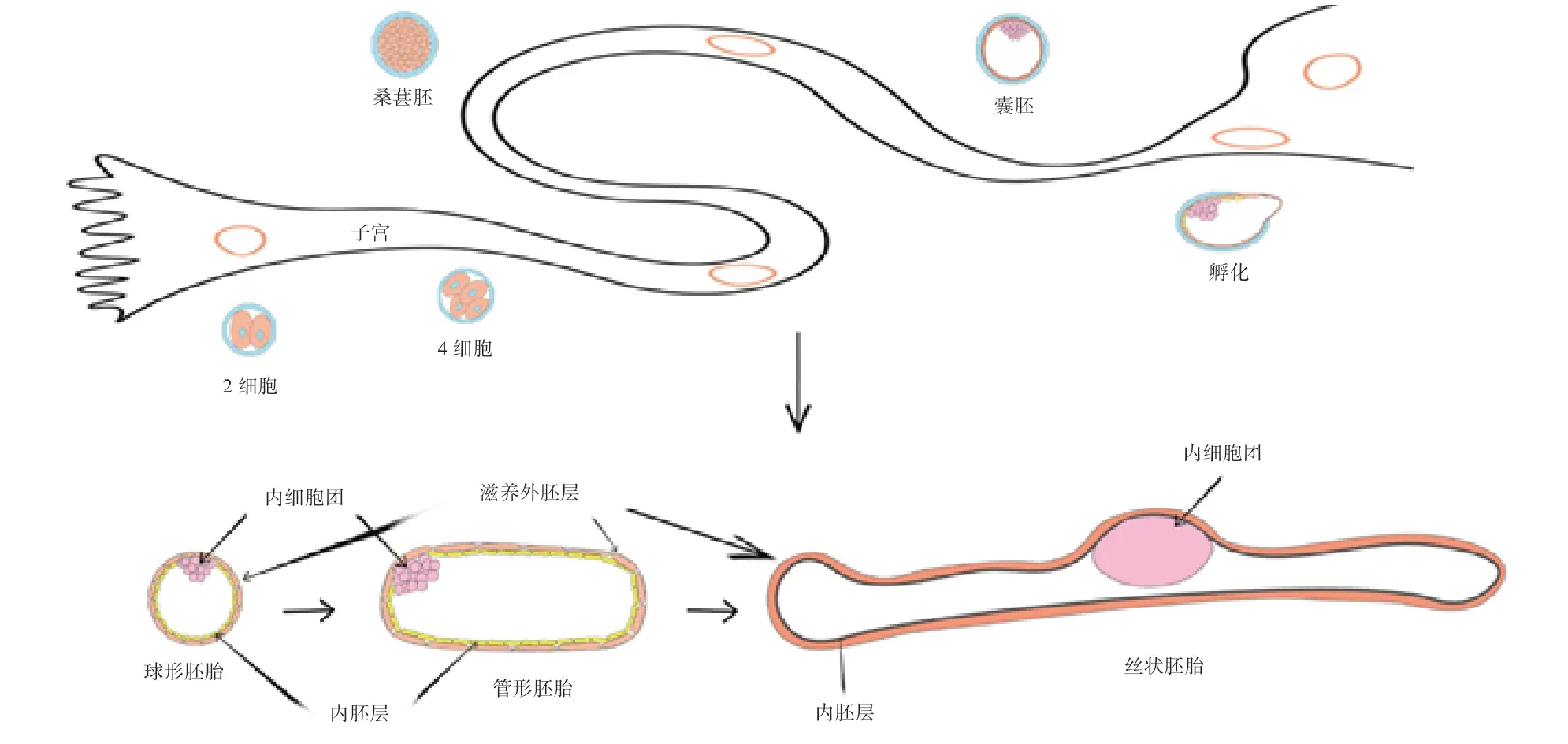
图1 妊娠过程中猪胚胎发育模式图
2.2IL1B2基因 促炎反应因子会作用于妊娠期间的胚胎和子宫内膜,是影响妊娠过程中胚胎附植失败和死亡的一个主要因素[30]。而白细胞介素-1β(Interleukin-1β)参加机体促炎反应(Proinflammatory),是一个主要的促炎反应因子,在附植前期,由囊胚释放,可以通过促进胚胎与子宫内膜的接触和附植来促进妊娠的建立[31]。研究发现,猪胚胎快速伸长期间,滋养层IL1B表达量增加,即胚胎在形态学上从管形到丝状阶段的转变过程中,IL1BmRNA 和蛋白质表达丰度明显增加,出现了一个表达和分泌峰,但当滋养层快速伸长期结束时,IL1B表达量会出现一个瞬时的降低,较之前大约降低了2 000 倍[32]。IL1B基因在猪胚胎中表达量倍增是由于猪胚胎中表达了1 个IL1B的新亚型IL1B2。IL1B1与IL1B2对比发现,它们都有7 个外显子,分布于第3号染色体上,但IL1B2中包含1 个可变外显子能够提供不同的转录调节。研究通过把IL1B分别从妊娠12 天的猪胚胎和周边血液白血球(PBLs)的mRNA 中克隆分离出来,发现了只有在猪胚胎中才会表达这个新亚型(IL1B2)[33]。通过使用CRISPR/Cas9 技术敲除猪胚胎中的IL1B2基因,发现胚胎滋养层不会出现伸长,同时胚胎芳香酶的表达和雌激素分泌减少,表明了IL1B2可能涉及胚胎妊娠建立过程中所需雌激素在时空上的合成,同时,其能够调节胚胎的伸长和与子宫表面相接触时子宫内膜的促炎反应[34]。白细胞介素1(IL1)的信号系统很复杂,共含白细胞介素1 及其受体共22 种分子,包括促炎因子IL1B 和IL1A、功能性受体IL1RⅠ、诱饵受体IL1RⅡ、拮抗分子IL1RA 和IL1 受体辅助蛋白IL1RAP 等[35]。IL1RⅠ和IL1RAP Toll 样受体的并置激活了1 个第二信使蛋白相互作用的级联反应,此时附植前期猪胚胎表达的IL1B 新亚型(IL1B2)能够激活子宫上皮表面的核因子κB(Nuclear Factor-kappa B,NFKB)。核因子κB 是一个转录因子,由保守亚基组成,能够控制先天的和自适应的免疫反应[36],这就如同在猪妊娠建立期间创造了一个促炎反应的微环境[33],通过IL1B2 的激活,NFKB 可以进入细胞核,调节超过100种基因的表达[37],这对哺乳动物妊娠的建立是必要的[38]。
2.3IFNs基因 在胚胎快速伸长期结束后,IL1B2基因的表达量迅速减少,在妊娠的第12~20 天,猪胚胎滋养外胚层分泌Ⅰ类型的干扰素-δ(IFND)和Ⅱ类型的干扰素-γ(IFNG),其在妊娠第14~16 天时会达到一个最大的分泌水平[5],与球形胚胎相比,第14 天的丝状胚胎中IFNG 的mRNA 表达量增加了567 倍[39]。与反刍动物胚胎产生的干扰素-τ(IFNT)不同,IFNT 会抑制子宫内膜产生PGF2α,作为反刍动物的妊娠识别信号[40],其与猪妊娠过程中产生的雌激素的功能相一致,但猪胚胎产生的IFNs 并不表现出抑制黄体溶解的作用[41]。Ⅰ类型的IFNs,通过与它们的异质二聚体Ⅰ类型IFN 受体(包括IFNAR1 和IFNAR2)结合,转导信号进入细胞[42]。IFNAR1 和IFNAR2 的mRNA 在子宫内膜中表达,妊娠第12 天时表达丰度最大,雌二醇(Estradiol)和IL1B 可以影响其在时空上的表达量[43]。IFND 通过和IFNAR2 亚基相互作用,与IFNAR1 链一起形成1 个三聚体复合物,从而引发细胞内的信号级联反应[44]。由猪胚胎分泌的雌激素、IFND 和IFNG 可以同子宫腔和基质中激活的信号转导子和转录激活因子1(Signal Transducer and Activator of Transcription 1,STAT1)一起诱导细胞通路,来完成滋养层的附植和对母体免疫应答的调节[45]。基质细胞中STAT1 的激活会诱导胚胎来表达IFNG,胚胎在附植期的死亡与IFNG 表达的缺失,使得其过早与雌激素接触有关[46]。而IFNG 作为一个滋养层信号,可以诱导子宫内膜细胞来表达一些趋化因子,包括涉及子宫内膜与滋养层之间信号交流的CCL2、CCL5、CCL11、CXCL12 和涉及胚胎-母体之间免疫容受环境的CXCL9 和CXCL10 等[47]。
3 小结与展望
综上所述,在早期妊娠过程中,猪胚胎为了成功完成与母体的识别和附植,其经历了一个在形态学上从球形到丝状的剧烈变化,以获得足够的表面积来与母体子宫内膜相接触,进行妊娠信号的交换及营养物质的获取。在胚胎形态转变期,成纤维细胞生长因子4、白细胞介素-1β亚型2 和干扰素3 个关键基因影响胚胎的正常发育及胚胎形态的成功转变,敲除这些基因将导致囊胚内胚层的不分化、滋养层不能伸长等,从而导致胚胎发育失败而死亡。虽然目前国内外的学者对影响胚胎附植期形态转变的相关基因有了一定研究,但对于具体的分子调控机制仍不清楚,只有较少的候选基因被鉴定出来,对该阶段导致高胚胎死亡率的原因仍有待进一步了解。因此,深入研究猪胚胎附植阶段基因的动态转录过程及其调控机制将是今后的研究重点,若能鉴定出显著影响胚胎附植成功率的功能基因,可为高繁殖力猪种的培育提供育种基因素材。
