CT特征联合癌胚抗原对磨玻璃结节的浸润前和浸润性鉴别诊断价值的研究*
2020-09-18华东疗养院放射科江苏无锡214065
华东疗养院放射科(江苏 无锡 214065)
黄海峡 徐国厚 左 翔 蒋 磊 罗 杨 吴建彬
随着健康体检的普及,CT对肺部微小病变的检出率明显提高,其中磨玻璃结节(ground-glass nodule, GGN)诊疗受到各界的广泛关注[1]。GGN是指在高分辨率CT(high resolution CT,HRCT)图像上表现为一种密度低于血管支管束的局灶性结节病变,但其内支气管血管束仍可显示。目前发现GGN既可是良性病变,如炎症、水肿或纤维化等;也可是恶性病变的早期活动期或进展期,并且GGN的恶性率要高于实性肺结节[2]。GGN发病率高,无明显的临床特征,缺乏相应的特异性。通过非病理学的手段鉴别肿瘤相关GGN是浸润前还是浸润性病变存在一定的困难。对于无远处转移且无手术禁忌症的浸润性病变,手术或微创治疗仍是首选的治疗方式。GGN需要根据具体的影像特征、实验室检查等结果选择合适的治疗方案。本研究选取了比较容易量化的CT特征和癌胚抗原纳入观察指标进行比较分析,探讨CT联合肿瘤指标鉴别诊断GGN是浸润前还是浸润性病变的临床价值,为肺癌的早期诊断和治疗提供相应的临床依据。
1 资料与方法
1.1 一般资料
回顾性搜集自2015年1月至2017年5月间来华东疗养院体检后经发现的在106例肿瘤相关的GGN患者。入选标准:(1)检出前均无明显的相关临床症状;(2)就诊前在外院未进行任何相关治疗;(3)所有病例均为孤立性病灶;(4)均经手术病理证实的肺腺癌。在106例GGN中,结果发现浸润前病变54例(其中9例AAH,45例AIS),男12例,女42例,平均年龄(47.22±9.35)岁;浸润性病变51例(其中24例MIA,27例IAC),男18例,女33例,(52.76±11.22)岁。体重指数基本相似(见表1)。本研究经过华东疗养院伦理委员会审查许可,所有患者均签署知情同意书。
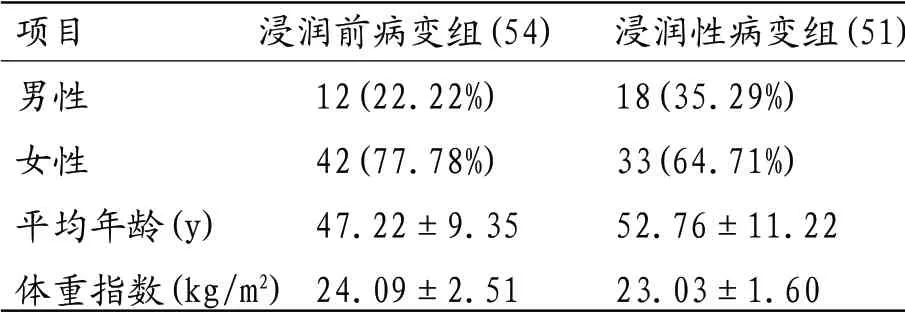
表1106例GGN基本计量资料的结果(例,%)
1.2 研究方法
1.2.1 CT检查方法[3]:采用Philips iCT256层螺旋CT检查。所有受检者均采取仰卧位,深吸气后屏气末进行扫描,扫描范围从肺尖覆盖至肺底进行扫描;未进行靶扫描。扫描参数:管电压120kV,管电流80~160mAs,螺距1.0,准直128×0.625,矩阵1024×1024;重建层厚/间隔为1.25mm/0.625mm。所有CT图像传至Philips后处理工作站,运用多平面重组(MPR)等技术进行处理。)
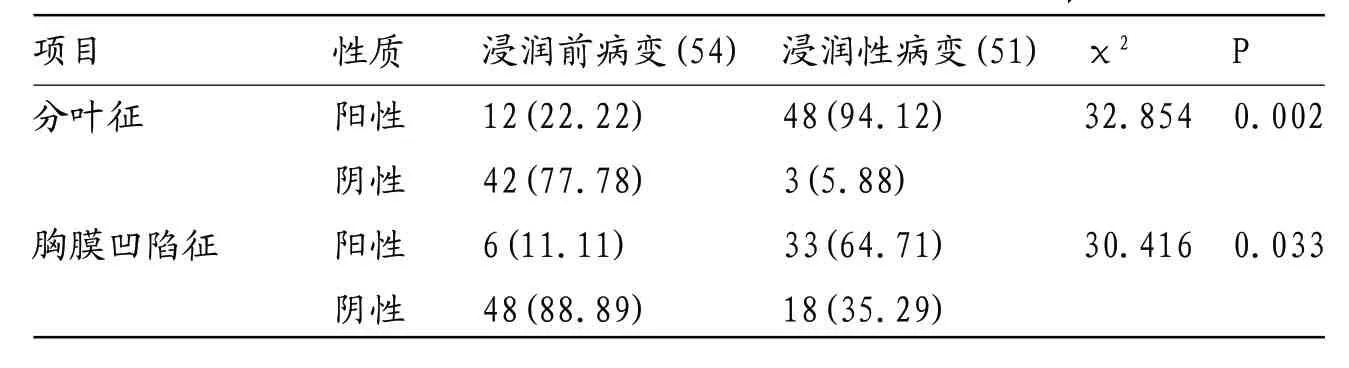
表2 浸润前和浸润性病变的CT征象比较(例,%)
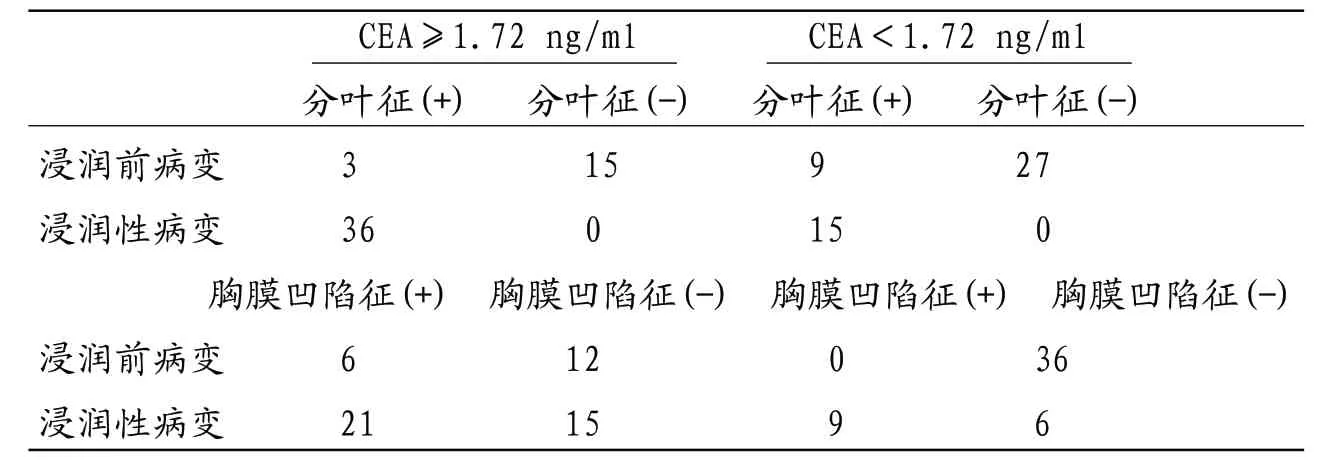
表3 血清CEA浓度值与GGN的分叶征、胸膜凹陷征联合诊断结果
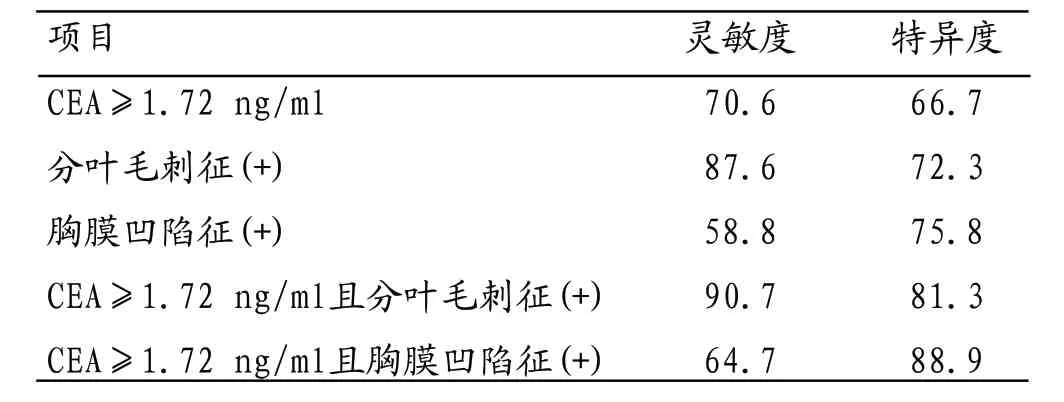
表4 各项指标对浸润性病变诊断的灵敏度和特异度
1.2.2 图像评价内容[4]:在Philips后处理工作站进行重建,在不知病理结果的情况下由2位高年资诊断医师对病变的薄层CT进行独立阅片,意见有差异时经协商会诊达成一致意见。测量并记录相关的影像特征:①病灶边缘的分叶征;②病灶周边胸膜牵拉征。
1.2.3 实验室检查[5]:在胸部CT检查前一天早上7:00空腹采集静脉血。室温静置,凝聚后以3000r/min,离心15min,离心半径10cm,使用化学发光法检测癌胚抗原(CEA),使用仪器为宝迪科技ADVIA厂家生产。由专人按说明书操作。
1.2.4 手术病理分析:所有患者均采用胸腔镜或开胸手术切除。标本甲酸固定,所见病灶全部取材,石蜡包埋、制片。常规采用HE染色,必要时行免疫组织化学染色。病理切片由两名诊断经验丰富的高年资医生审阅,意见不统一时共同商议进行。主要标准参照2015年WHO肺癌亚型分类标 准[6]。
(1)不典型腺瘤样增生(AAH):病变局限(≤5mm),增生细胞为II型肺泡上皮或/和Clara细胞,呈轻中度不典型增生,增生的细胞为圆形、立方形或低柱状,核圆形或卵圆形,细胞之间有间隙,不互相延续。
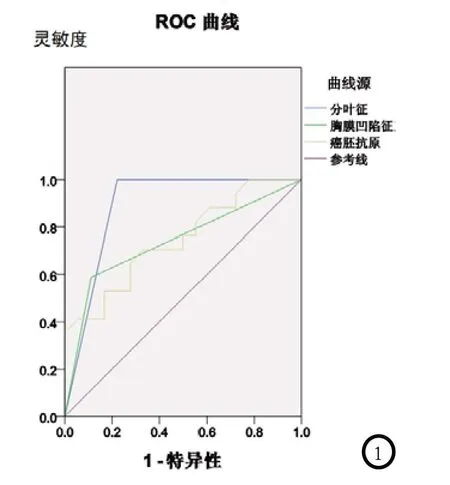
图1 分叶征、胸膜凹陷征及CEA浓度诊断浸润性病变价值的ROC曲线分析
(2)原位腺癌(AIS):小于3cm局灶性病变,肿瘤细胞沿着以前存在的肺泡壁生长,无间质、血管或胸膜浸润。肺泡间隔可增宽伴硬化,但是无瘤质细胞浸润。几乎所有AIS为非黏液性细胞,由II型肺泡上皮细胞或Clara细胞组成,黏液性细胞较少。癌细胞呈高柱状,细胞核位于基部,胞浆内富含粘液。
(3)微浸润腺癌(MIA):肿瘤细胞明显沿着肺泡壁生长的孤立性、≤3cm的小腺癌,伴有一个或多个小于5mm浸润灶,多个浸润灶以最大直径用浸润性病灶为准。大多数MIA也可为非粘液性。
(4)浸润性腺癌(IAC):浸润灶的最大径大于5mm。肿瘤细胞气道播散或坏死;肿瘤细胞周围间质有肌纤维母细胞反应;胸膜、血管淋巴管受到侵犯;存在着腺泡型、乳头型、实体型和微乳头型癌的成分。
1.2.5 研究分组:根据肺腺癌的分类将其分为浸润前病变(AAH+AIS)和浸润性病变(MIA+IAC)两组,比较两组患者的基本计量资料、CT影像学的特征及癌胚抗原的差异。
1.3 统计学方法采用SPSS17.0统计软件包统计分析,以病理结果为分组标准,对计量资料(病灶大小、体重指数及 CEA的平均浓度)采用(±s)表示;对分类资料的描述,用频率和构成比(n%)来表示;二分类资料(选取分叶征及胸膜凹陷征)的统计采用χ2检验,假设检验选取0.05为显著水平,以P<0.05为差异有统计学意义。绘制受检者的特征性曲线(ROC曲线),寻找最佳阈值,评估其诊断价值。
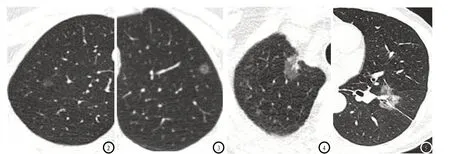
图2 -3 浸润前病变:边缘规整,无明显毛刺和胸膜凹陷征。图3 女,32岁,右肺上叶,pGGN,长径约6mm,病理:不典型腺瘤样增生。图4 女,47岁,左肺上叶,pGGN,长径约7mm,病理:原位腺癌。图4-5 浸润性病变 :边缘毛糙,有明显的毛刺和胸膜凹陷征。图4 女,47岁,右肺上叶,mGGN,长径约12mm,病理:微浸润性腺癌。图5 男,59岁,左肺下叶,mGGN,长径约30mm,病理:浸润性腺癌。
2 结 果
2.1 基本计量资料及CT征象对比结果在106例GGN中,54例浸润前GGN出现分叶征12例(22.22%)、胸膜凹陷征6例(11.11%);51例浸润性GGN出现分叶征48例(94.12%)、胸膜凹陷征33例(64.71%);浸润性病变的阳性率明显高于浸润前病变,差异有统计学意义(P<0.05),见表2和图2。
根据ROC 曲线分析,其中分叶征的AUC=0.889(95% CI为0.755~1.000,P=0.000),以其诊断浸润性病变的灵敏度和特异度分别87.6%和72.3%;其中胸膜凹陷征的AUC=0.739(95% CI为0.567~0.910,P=0.016),以其诊断浸润性病变的灵敏度和特异度分别58.8%和75.8%。见图1。
2.2 受检者体内癌胚抗原值结果显示,浸润前病变患者的CEA平均浓度值为1.49±0.71 ng/ml,浸润性病变的患者的CEA平均浓度值为(2.71±1.58)ng/ml;根据ROC曲线(见图1)分析,浸润性病变的AUC=0.745(95% CI为0.583~0.907,P=0.013),最佳阈值为1.72 ng/ml;其诊断浸润性病变的灵敏度和特异度分别70.6%和66.7%。见表3。
2.3 联合诊断GGN的分叶征及胸膜牵拉征和血液肿瘤指标CEA对浸润性病变诊断的灵敏度和特异度偏低,考虑两者联合应用诊断,其诊断的灵敏度和特异度明显提高,见表3。其中CEA联合分叶征的灵敏度和特异度提高最为明显,分别为90.7%、81.3%,见表4。
3 讨 论
当前,肺癌在全球的发生率和致死率一直居高不下,已成为我国危害最为严重的恶性病变之一。由于肺癌早期临床症状不明显,容易错过最佳的治疗时间,5年生存率较低[7]。其中肺癌组织学亚型中最常见的是腺癌,其恶性程度高、预后差[8]。越来越多的研究发现,GGN与早期肺癌有一定的相关性;其生长速度较慢,属于一种惰性结节,持续存在的GGN病理上属于肺腺癌可能比较大[9]。研究发现[10],肺腺癌形成需要经过一个漫长的过程,其过程一般由非典型腺瘤样增生发展到原位腺癌,再局部肺组织受累的微浸润腺癌(局部受累<5mm),最后转变为浸润性腺癌。其在CT影像也会出现相关定量指标数据和影像学特征的方面变化。
GGN的边缘的影像特征对其良恶性的鉴别诊断具有重要价值。许多研究表明[11],分叶征、胸膜凹陷征是诊断恶性GGN的重要征象。其中,分叶征是指病灶的表面呈现凹凸不平的波浪状改变。其形成的机制是分化程度不同细胞的生长速度不一样,被邻近走行肺间质阻挡或被其内纤维组织牵拉形成[12]。潘江峰等[13]对85例纯GGN研究发现,浸润性肺腺癌出现分叶征的比例约为55.8%,明显高于浸润前病变的27.2%,分叶征提示浸润性肺腺癌的特异性约为81.2%。本研究发现浸润性GGN出现分叶征比例(94.12%)明显高于浸润前GGN(22.22%),分叶征诊断浸润性病变的灵敏度和特异度分别87.6%和72.3%。
胸膜凹陷征是受到牵拉的局部胸膜无增厚粘连,此征象主要出现在含有实性成分的肺腺癌中。其形成主要是由于结节本身纤维瘢痕对胸膜的牵拉或实性成分引起的纤维组织反应所致[14]。因此,浸润性病变出现胸膜凹陷征的几率更大。本研究51例浸润性GGN出现胸膜牵拉征33例(64.71%),而54例浸润前GGN仅有6例(11.11%)出现,其诊断浸润性病变的灵敏度和特异度分别58.8%和75.8%。
CEA是一种大分子糖蛋白,主要存在于胚胎胃肠黏膜上皮细胞与一些恶性肿瘤细胞表面。以往,把CEA作为早期诊断结直肠癌的特异性标志物,经过大量的临床试验证明[15],在肺癌、乳腺癌等其他恶性肿瘤的血清中也会升高。CEA作为一种广谱肿瘤标志物,虽然不能作为诊断恶性肿瘤的特异性标志物,但广泛应用于恶性病变的鉴别诊断、病情发展、疗效判断及预后评估等方面。左震华等[16]研究发现,肺腺癌组CEA水平显著高于正常对照组,以5.34ug/L为诊断肺腺癌的临界点,曲线下面积为0.881,其敏感度及特异性分别为97.5% 和84.0%。本研究发现,以CEA为1.72ng/ml为鉴别诊断的最佳阈值,浸润性病变的曲线下面积为0.745,诊断浸润性病变的灵敏度和特异度分别70.6%和66.7%。CEA的浓度对辅助诊断GGN的性质有一定参考价值,可作为肺腺癌诊断及筛查的肿瘤标记物之一,但需结合其他检查手段。
分叶征和胸膜牵拉征提供了病变的形态征象,而CEA则是从血液中提供了病变的以外的信息。因此,要兼顾两者的灵敏度和敏感度。本研究显示将两者联合,其诊断浸润性病变灵敏度和特异度明显提高,其中CEA联合分叶征的灵敏度和特异度最高,分别为90.7%、81.3%。本研究推荐CEA浓度值≥1.72ng/ml与病灶的分叶征联合诊断GGN的浸润性病变,有助于提高临床诊断的信息,选择合适的治疗方案。
综上所述,本研究还存有不足之处,样本量偏少,可能会导致两组间统计学结果存在一定偏倚;另外,缺乏纵向动态的对比研究。总之,通过术前影像特征分析联合实验室检查指标,可有助于鉴别GGN病变性质,为我们的临床医师提供合理化建议,选择不同的治疗方式,避免过度诊断与治疗。