一种席夫碱荧光探针的合成及对Zn2+选择性识别
2020-09-17宋丽雪姚媛君
宋丽雪, 姚媛君, 董 川, 韩 辉*, 王 丽*
(1.山西大学化学化工学院,山西太原 030006;2.山西大学环境科学研究所,山西太原 030006)
组成人体的元素有60多种,而锌在人体内的含量约为0.004%,是仅次于铁的第二大微量元素[1,2]。Zn2+在基因表达、金属酶调节、DNA合成和细胞新陈代谢等多种生理过程中均起着重要作用[3 - 5]。研究发现过量的排放含锌污染物,会对环境造成危害,同时也会危害人们健康。土壤中含有过量Zn2+会使微生物活性降低,进而对环境造成不良影响。如果人体内Zn2+代谢紊乱,会导致多种疾病,如糖尿病、阿尔茨海默病、帕金森氏病、癫痫症和肌萎缩等,因此对Zn2+的定量检测具有重要意义。在众多的分析方法中,荧光光谱法因其简便、快速、灵敏等优点,而受到科研工作者的关注,并显示出巨大的潜在应用价值[6 - 8]。考虑到Zn2+对人体健康的潜在影响,所以新型高选择性、高灵敏度的Zn2+荧光探针设计与合成仍具有重要的意义。
席夫碱类荧光探针由于其合成条件温和,具有良好的配位能力,现已被广泛应用于多种金属离子的分析检测中,如Mg2+、Hg2+、Al3+、Cu2+等[9 - 14]。本文以9-芴基甲基肼基甲酸酯和对甲基苯酚为原料,设计并合成了一种结构简单的席夫碱荧光探针DHS。该荧光探针DHS在乙醇体系中,可以实现对Zn2+的选择性识别。
1 实验部分
1.1 仪器与试剂
Thermo Scientific Q Exactive高分辨液/质联用仪(美国,赛默飞世尔科技公司);PTI QuantaMasterTM400稳态/瞬态荧光光谱仪(美国,PTI公司);Agilent Cary 8454紫外-可见分光光度计(美国,安捷伦科技有限公司);Hei-VAP旋转蒸发仪(德国,海道夫公司);Bruker Avance Ⅲ HD 600 MHz超导核磁共振波谱仪(瑞士,布鲁克科技有限公司)。
9-芴基甲基肼基甲酸酯(98.0%),氘代二甲基亚砜(99.8 atom% D),4-甲基苯酚(99.0%),三氟乙酸(99.0%)等均购买于北京伊诺凯科技有限公司;无水乙醇、二氯甲烷、石油醚、乙酸乙酯均为分析纯,购买于天津市富宇精细化工有限公司。实验用水为ELGA纯水机PURELAB Ultra制备的超纯水。
1.2 探针DHS的合成
将对甲基苯酚(1.06 mL,10.0 mmol)与六亚甲基四胺(2.80 g,20.0 mmol)溶于10.0 mL三氟乙酸(TFA)中,然后在氮气下加热回流12 h。反应结束后,冷却至室温,加入210 mL 4.00 mol/L HCl,冰浴条件下搅拌24 h,用二氯甲烷萃取,加入无水MgSO4干燥,减压蒸馏除去溶剂,残余物用硅胶柱快速分离纯化(乙酸乙酯∶石油醚=1∶19,V/V),得到白色固体,即为2,6-二甲酰基-4-甲基苯酚a(0.328 g,20.0%)。表征结果如下:1H NMR(600 MHz,CDCl3),δ(ppm):11.45(s,1H),10.22(s,2H),7.77(s,2H),2.39(s,3H)。13C NMR(151 MHz,DMSO-d6),δ(ppm):192.27,160.34,137.34,129.28,123.28,19.54。
将9-芴基甲基肼基甲酸酯(152 mg,0.600 mmol)与2,6-二甲酰基-4-甲基苯酚a(98.4 mg,0.600 mmol)溶于10.0 mL二氯甲烷中,回流30 min。冷却至室温,过滤得到白色固体,用甲醇冲洗,干燥,即为探针DHS(0.115 g,30.0%)。表征结果如下:1H NMR(600 MHz,DMSO)δ11.73(s,1H),11.48(s,2H),8.29(s,2H),7.92(d,J= 7.4 Hz,4H),7.74(s,4H),7.43(t,J= 7.4 Hz,6H),7.35(t,J= 7.4 Hz,4H),4.54(s,4H),4.32(s,2H),2.27(s,3H)。HRMS(ESI):C39H32O5N4for [DHS+H]+,计算值为637.2373,测定值为637.2157。
探针DHS的合成路线如图1所示。
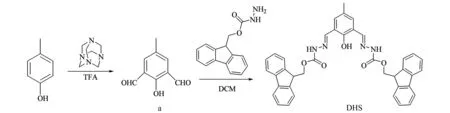
图1 DHS的合成路线Fig.1 Synthesis of probe DHS
2 结果与讨论
2.1 DHS和DHS-Zn2+体系的光谱特性
首先考察了DHS在无水乙醇体系中与Zn2+的络合性能。DHS在271 nm、392 nm处有2个吸收峰。加入Zn2+后,392 nm处的吸收峰红移至412 nm。随着溶液中加入的Zn2+浓度逐渐增大,412 nm处的吸收峰逐渐增强(图2a),说明DHS和Zn2+形成了新的配合物。并且在365 nm的紫外灯下,荧光颜色从红色变为黄色。
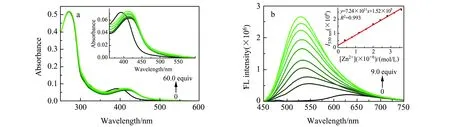
图2 DHS紫外吸收光谱(a)和荧光发射光谱(b)随Zn2+浓度的变化 Fig.2 UV absorption spectra(a) and fluorescence spectra(b) of DHS in absolute ethanol with the presence of Zn2+ at different concentrations
实验进一步研究了DHS和Zn2+配位后荧光光谱的变化(图2b)。以420 nm为激发波长,DHS在630 nm处有发射峰,加入Zn2+后,630 nm处的发射峰蓝移至530 nm处。随着溶液中加入的Zn2+浓度逐渐增大,530 nm处的荧光强度显著增强。加入Zn2+后,DHS溶液的吸收和发射光谱均发生明显的变化,为建立荧光分析法提供了基础。
荧光滴定实验表明,在一定范围内随着Zn2+浓度的增加,DHS -Zn2+体系荧光强度逐渐增强。体系在530 nm处的荧光强度I530nm与Zn2+的浓度在4.00×10-6~3.60 ×10-5mol/L范围内呈现良好的线性关系。由此可以实现探针DHS对Zn2+的定量检测,检测限(3S/N)为2.36×10-8mol/L。
2.2 DHS对Zn2+的选择性和抗干扰性能研究
在相同实验条件下,测定了DHS对不同金属离子(Ag+、Ba2+、Ca2+、Cd2+、Hg2+、K+、Li+、Mg2+、Mn2+、Na+、Fe3+、Cu2+、Al3+、Zn2+)的荧光响应。如图3a所示,只有加入Zn2+后,DHS在630 nm处的发射峰会蓝移至530 nm处,并且伴随着明显的荧光颜色变化,由红色变为黄色,表明DHS可以选择性的与Zn2+结合,导致荧光发射蓝移。此外,还考察了DHS作为荧光传感器检测Zn2+的抗干扰性,发现共存离子Cu2+对Zn2+具有干扰作用,通过加入掩蔽剂Na2S可以除去Cu2+的干扰,在干扰实验中,除在Cu2+的溶液中加入7.2×10-5mol/L的Na2S掩蔽剂外,其余金属离子的实验条件均相同,结果表明其它离子对DHS -Zn2+体系的荧光强度不产生影响。因此,DHS可以选择性的识别检测Zn2+,且在Zn2+的检测中有较好的抗干扰能力。 结果见图3b。

图3 (a)DHS对金属离子的选择性实验;(b)加入掩蔽剂Na2S后DHS对金属离子的干扰性实验 Fig.3 (a) Fluorescence spectra of DHS(4.0×10-6 mol/L) in the presence of various metal ions(3.6×10-5 mol/L) in anhydrous alcohol.Inset:Fluorescence color change of DHS in the presence of Zn2+ under UV light;(b) With masking reagent Na2S9H2O,the fluorescence intensity of DHS(4.0×10-6 mol/L) at 530 nm upon addition of Zn2+ in the presence of interfering metal ions in anhydrous alcohol
2.3 结合模式

图4 DHS-Zn2+在乙醇中的高分辨质谱(ESI-HRMS)图Fig.4 ESI-HRMS of DHS -Zn2+ complex recorded in EtOH
在乙醇溶液中固定探针和Zn2+的总浓度为4.00×10-5mol/L ,通过等摩尔连续变化法,利用荧光强度变化测定希夫碱探针DHS与Zn2+的络合比。当DHS与Zn2+的浓度比为1∶1时,体系DHS-Zn2+荧光强度达到最大值,由此可知DHS与Zn2+的络合比为1∶1。通过高分辨质谱(图4)测定配合物的分子离子峰,峰值m/z701.15168为DHS+Zn2++2H+[calculated,m/z:701.1586],进一步证明了DHS与Zn2+以化学计量比1∶1结合。此外,依据Benesi-Hildebrand方程计算可知探针DHS与Zn2+的结合常数为8.09×104L/mol,该数值表明在溶液中探针DHS与Zn2+有很强的键合能力。

图5 Zn2+对探针DHS核磁信号的影响Fig.5 1H NMR spectra of DHS and DHS with ZnCl2 in DMSO -d6:(a) DHS;(b) DHS+Zn2+(5 equiv.)
2.4 机理探讨
通过核磁滴定实验进一步确认配体DHS与Zn2+的配位情况,如图5a所示,从配体的氢核磁谱图上,可以看到在7.92、11.48、11.73处的峰,它们分别对应于-CH=N,-OH和-C=NH的氢核磁信号。当Zn2+加入后(图5b),化学位移在11.48处的苯羟基氢核磁信号逐渐降低,这可能是因为配体与Zn2+的相互作用导致去质子化;另外在7.92和11.73处的氢核磁信号相比于配体上对应信号有着不同程度的向低场移动,这表明碳氮双键的氮原子和羰基上的氧原子参与络合配位,而且当加入Zn2+后在6.28处出现新的峰。因此通过对比加入Zn2+前后的核磁谱图的变化,再结合ESI-MS和Job曲线分析,可以得出结论,Zn2+与配体通过苯羟基氧原子,碳氮双键的氮原子,还有羰基上氧原子配位形成了1∶1的配合物[15 - 17],其可能的结合模式如图6。

图6 探针DHS和锌离子可能的结合模式Fig.6 Proposed binding mode of probe DHS with Zn2+
3 结论
本文以对甲基苯酚为原料,利用Duff反应和缩合反应,设计合成了一种荧光增强型检测Zn2+的席夫碱类荧光探针DHS,并通过核磁和高分辨质谱对探针结构进行了表征。等摩尔连续变化法和高分辨质谱实验表明,DHS与Zn2+以1∶1络合,核磁滴定实验进一步证明了配体DHS与Zn2+的结合模式。荧光滴定实验表明该探针DHS对Zn2+的识别具有较高的灵敏度,检出限为2.36×10-8mol/L,有望发展分子探针DHS用于定量检测微量Zn2+。
