黑果枸杞中花色苷的高效液相色谱分析研究
2020-09-17王天琦马兆成吴军民王建国余琼卫冯钰锜
王天琦, 马兆成, 吴军民, 王建国, 余琼卫*, 冯钰锜
(1.生物医学分析化学教育部重点实验室,武汉大学化学与分子科学学院,湖北武汉 430072;2.华中农业大学园艺林学学院 园艺生物学教育部重点实验室,湖北武汉 430070;3.青海芝润农林开发有限公司,青海格尔木 816099;4.西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
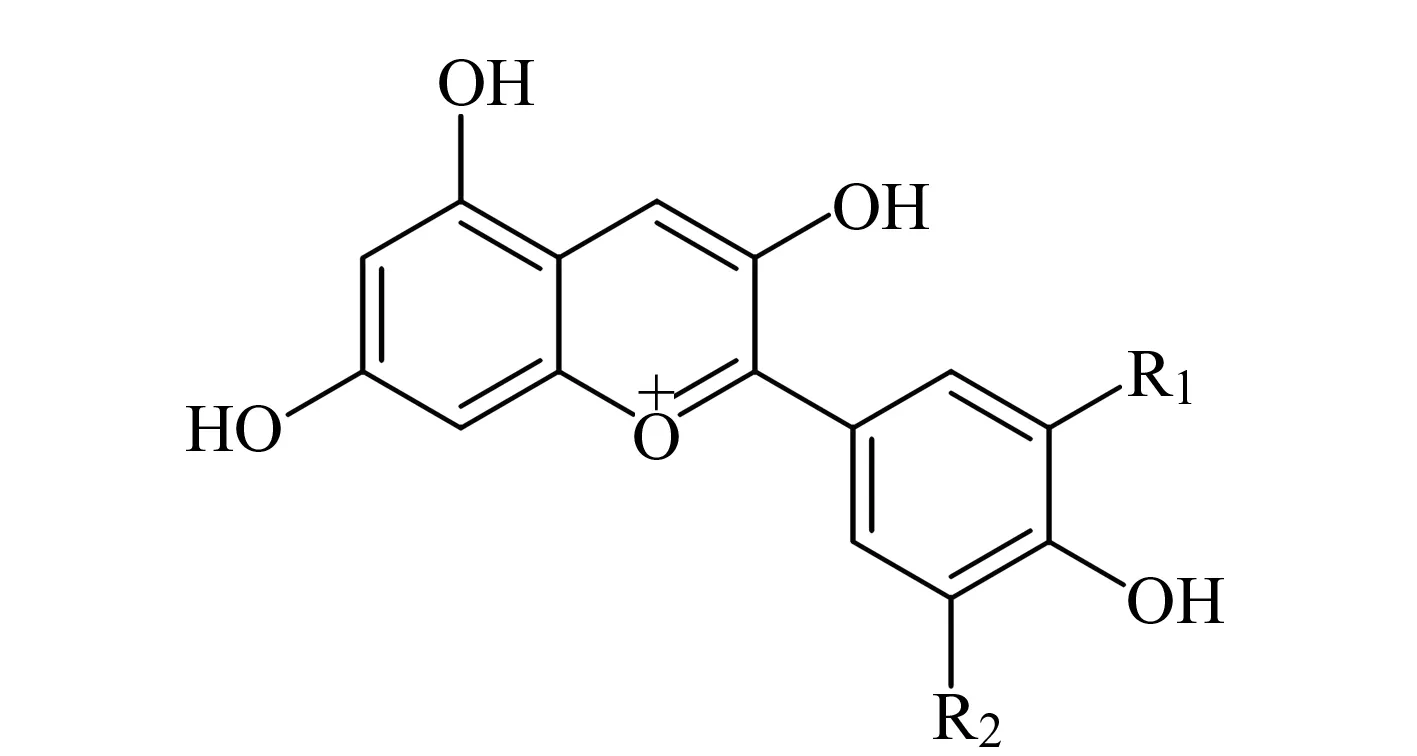
图1 花青素的化学结构Fig.1 Chemical structure of anthocyanins
黑果枸杞(LyciumruthenicumMurr.)为茄科(Solanceae)枸杞属(LyciumL.)多年生灌木,广泛分布于我国西北地区,其果实中富含花青素,具有抗氧化、抗癌、维持血管通透性的作用[1]。花青素属于类黄酮物质,具有2-苯基苯并吡喃阳离子的典型结构(图1),是植物的主要水溶性色素之一。目前已知有20多种花青素,而植物中的花青素主要有6种,分别为天竺葵色素、矢车菊色素、飞燕草色素、芍药色素、牵牛花色素和锦葵色素[2]。花青素在植物中通常不稳定,不会以游离态形式存在,而是与糖类物质结合形成糖苷,称为花色苷。糖环上剩余的羟基又会与酸发生酰基化反应,这大大增加了花色苷类物质的稳定性[3]。通过提取植物中花青素苷并对其进行分析,可以间接地了解植物中花青素的情况。
黑枸杞中花青素的提取多采用溶剂提取法,由于花青素在pH>3的环境中不稳定,用酸化的甲醇或乙醇与水的混合溶剂,辅以超声、微波、水浴等协助提取[4,5]。还有部分研究采用微生物法[6],即利用微生物或酶降解细胞壁,使细胞内的花青素释放出来,达到快速测定花青素的目的。关于溶剂提取法,目前已有多篇文献报道用以提取花青素,但这些报道中用到的溶剂、酸度、辅助方式均不相同,很难达到统一[3,7 - 12]。花青素的测定方法主要有分光光度法[7,12]、高效液相色谱法[13 - 15]、质谱法[16]。然而,由于这些花色苷是复杂的糖基化、酰基化的化合物,提纯和合成都较困难,无法得到标准品[17],因而多采用已有的花色苷标准品进行仪器分析做线性标准曲线,然后再将该线性曲线用于没有标准品结构相似的花青素苷的半定量分析。Zheng等[3]用高效液相色谱-电喷雾质谱(HPLC-ESI-MS)从黑枸杞提取液中鉴定出14种花色苷,并以锦葵色素-3,5-2-O -葡萄糖苷(Malvidin-3,5-di-O -glucoside)对这14种花色苷进行半定量分析。
本文首先通过高效液相色谱-电喷雾质谱分离鉴定,确证提取液色谱图中各个峰的结构,确定其中的花色苷,再以高效液相色谱-紫外检测法(HPLC-UV)对其进行提取条件的优化及分析。在优化后的提取条件下,以矢车菊素-3-O -葡萄糖苷(Cyanidin-3-O -glucoside)为对照品对黑枸杞中总花色苷进行了半定量分析。
1 实验部分
1.1 仪器及试剂
Shimadzu 20A高效液相色谱仪(日本,岛津公司);Shimadzu 8040 MS质谱仪(日本,岛津公司)。
标准品矢车菊素-3-O -葡萄糖苷(Cyanidin-3-O -glucoside)购自上海麦克林生化科技有限公司。色谱纯甲醇购自美国TEDIA试剂公司;甲醇、乙醇、甲酸(FA)、三氟乙酸(TFA)均为分析纯,购自国药集团化学试剂有限公司;实验用水由Milli-Q超纯水仪制备。
黑枸杞购自湖北省武汉市超市。
1.2 实验方法
1.2.1 标准溶液的制备称取5.0 mg标准品矢车菊素-3-O -葡萄糖苷(Cyanidin-3-O -glucoside),置于15.0 mL棕色安普瓶中,加入5.0 mL 1%HCl酸化的甲醇溶液超声溶解,得到1 mg/mL的标准品储备液,于-20 ℃避光冷藏。
1.2.2 黑枸杞中花色苷的提取称取黑枸杞样品7 g于小烧杯中,45 ℃下置于真空干燥箱中干燥72 h,将干燥后的黑枸杞置于研钵中,加入液氮磨碎成粉末,于-20 ℃避光保存。准确称取50 mg黑枸杞粉末于1.5 mL离心管中,以1∶15的液料比加入750 μL 2%甲酸甲醇(甲酸∶甲醇=2∶98),于室温下避光浸提24 h。8 000 r/min离心10 min,取上清液进入HPLC仪检测。
1.2.3 色谱及质谱条件色谱条件:上海谱宁科技公司Pntulips SBP-C18色谱柱(250 mm×4.6 mm i.d.,5 μm)。流动相A为甲醇,B为含0.5%甲酸水溶液。梯度淋洗程序:0~3 min,80%~70%B;3~13 min,70%~60%B;13~25 min,60%~50%B,25~35 min,50%B;35~40 min,50%~80%B;40~60 min,50%~80%B;流速为0.8 mL/min。柱温30 ℃;检测波长为525 nm;进样量为10 μL。质谱条件:采用电喷雾电离、正离子扫描,扫描范围为0~1 200 Da,脱溶剂(DL)管温度250 ℃,加热模块温度400 ℃,雾化气流速3 mL/min,干燥气流速15 mL/min。
2 结果与讨论
2.1 花色苷质谱鉴定
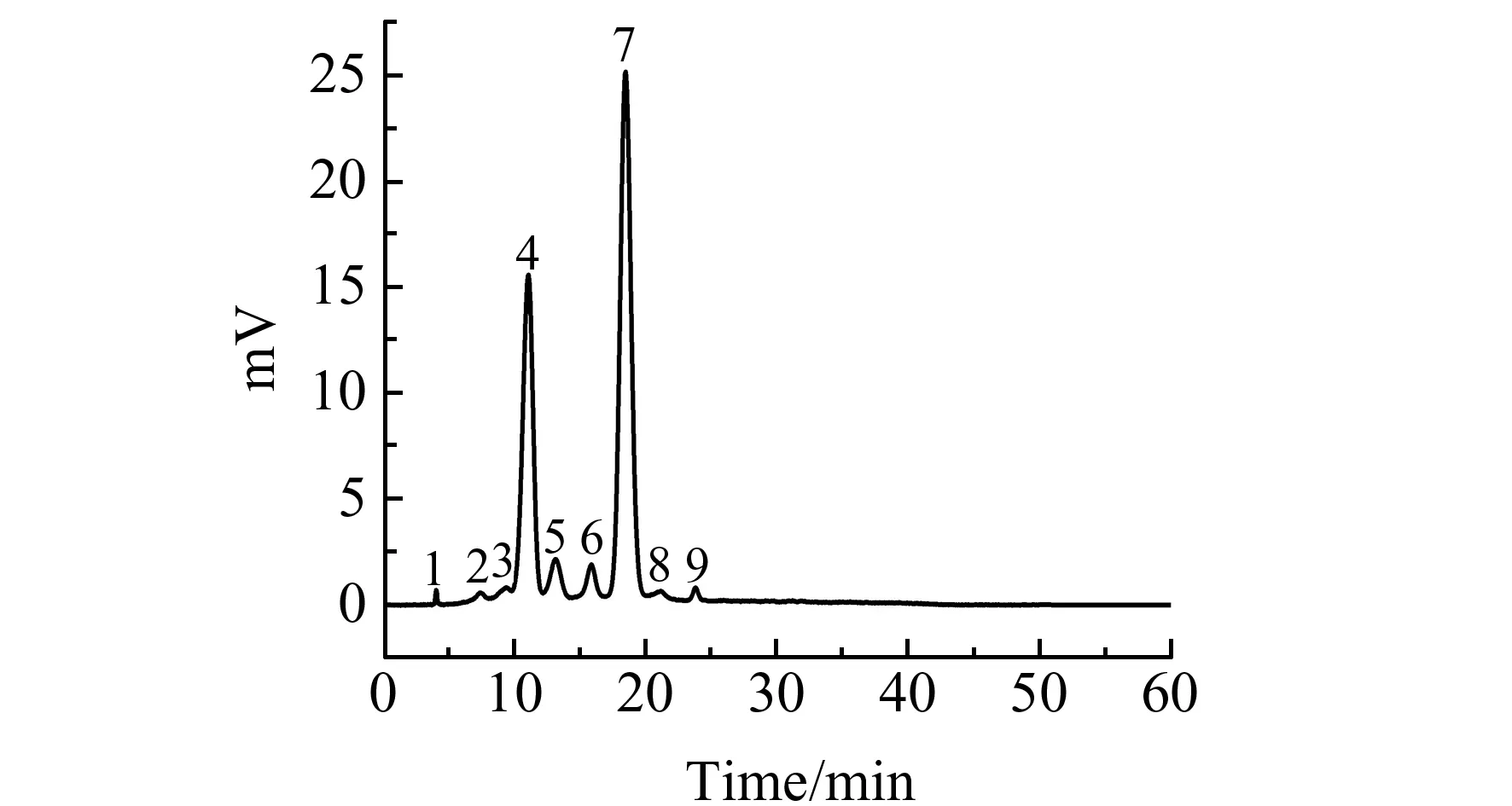
图2 黑枸杞提取液的HPLC图Fig.2 HPLC chromatogram of L.ruthenicum extractsflow rate:0.8 mL/min;column temperature:30 ℃;wavelength:525 nm;injection amount:10 μL.The mobile phase of the gradient elution was as shown in 1.2.3.
图2为黑枸杞中花色苷提取液的色谱分离图,图中主要有9个色谱峰,用岛津8040质谱仪进行质谱鉴定。对于图2中的9个色谱峰,根据其得到的全扫描质谱以及二级质谱图,可以得到相对应的结构信息。经过结构解析与文献报道[3,15,18,19]对比,4号峰(P4)与7号峰(P7)鉴定为花色苷,分别为矮牵牛基-3-O -芸香糖苷(葡糖基-P-香豆酰基)-5-O -葡萄糖苷(Petunidin-3-O -rutinoside(glucosyl-p-coumaroyl)-5-O -glucoside)和矮牵牛基-3-O -芸香苷-5-O -葡萄糖苷(Petunidin-3-O -rutinoside(p-coumaroyl)-5-O -glucoside),且其峰面积之和占总峰面积的90%左右。之后,依据P4和P7的峰面积之和对黑枸杞中花色苷总量进行半定量分析。
P4的二级质谱图见图3A,分子离子峰的质荷比为1094.8,丢失C5上连接的一个葡萄糖分子后得到的离子质荷比为932.9,丢失C3上连接的芸香糖、对香豆酸、葡萄糖得到的离子质荷比为478.8,最后得到的牵牛花色素为质荷比317.0的峰。P7的二级质谱图见图3B,分子离子峰的质荷比为933.0,丢失C5上连接的一个葡萄糖分子后得到的离子质荷比为771.0,丢失C3上连接的芸香糖、对香豆酸得到的离子质荷比为478.8,最后得到的牵牛花色素为质荷比317.0的峰。
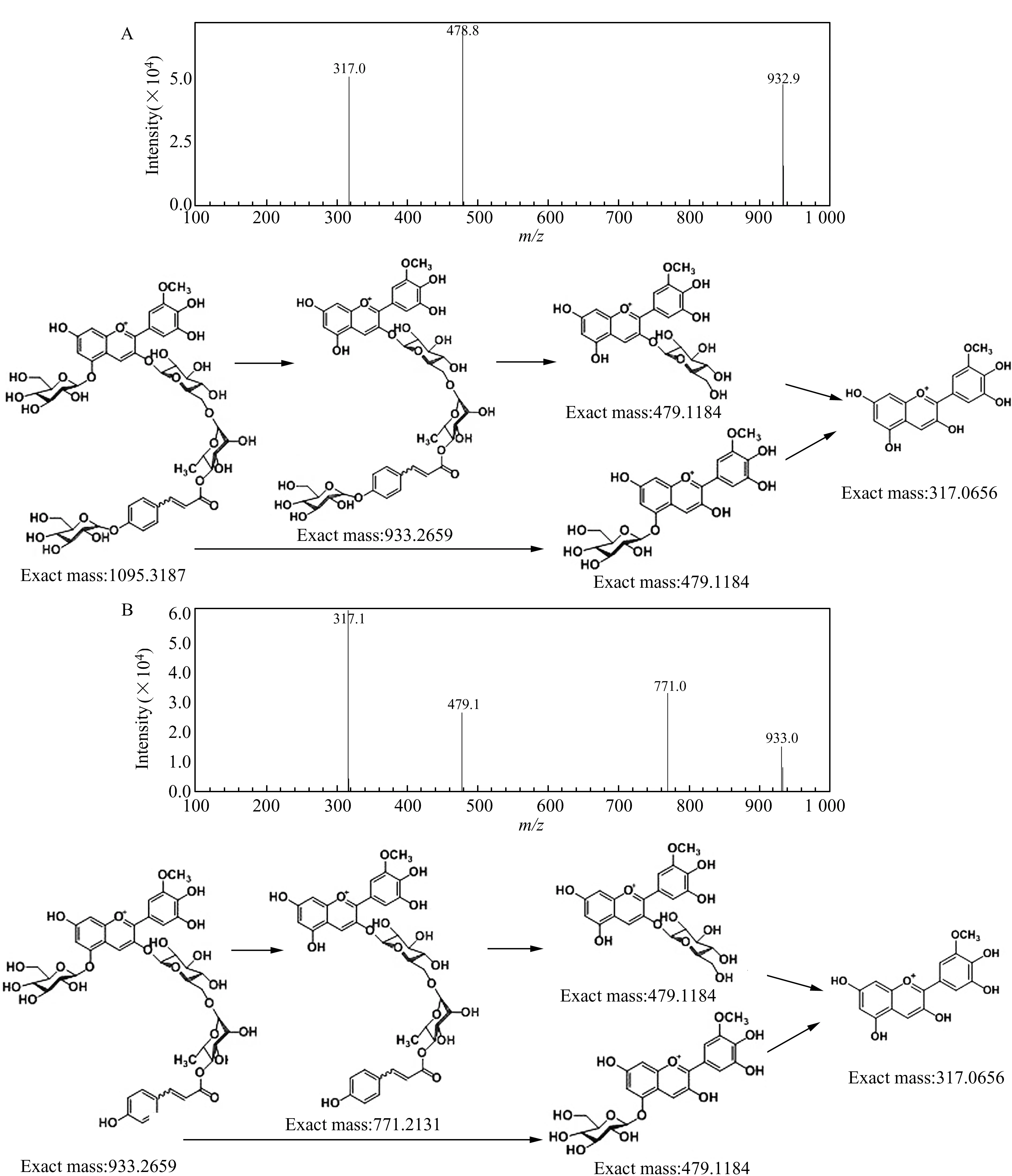
图3 花色苷的质谱图Fig.3 Mass spectra of anthocyaninsA:Petunidin-3-O -rutinoside(glucosyl-p-coumaroyl)-5-O -glucoside;B:Petunidin-3-O -rutinoside(p-coumaroyl)-5-O -glucoside.
2.2 花色苷提取的优化
从黑枸杞中提取花色苷的方法多种多样,涉及到多种提取溶剂如甲醇、乙醇、水,也有多种提取方法如浸提、超声、微波等被报道[3,7 - 12]。由于花色苷在中性及碱性条件下不稳定,易发生分解,多在提取液中加入酸。选取了如下7种方法对黑枸杞中花色苷的提取进行优化,具体参数见表1。按照表1进行提取操作后,得到的上清液进行HPLC-UV分离检测。检测结果见图4,横坐标为提取方法序号。1号、5号、6号方法的提取效果较好,3、7号方法的提取效果较差。综合考虑实验操作的安全性、实验效果等方面,在之后的实验中采取1号方法进行提取。
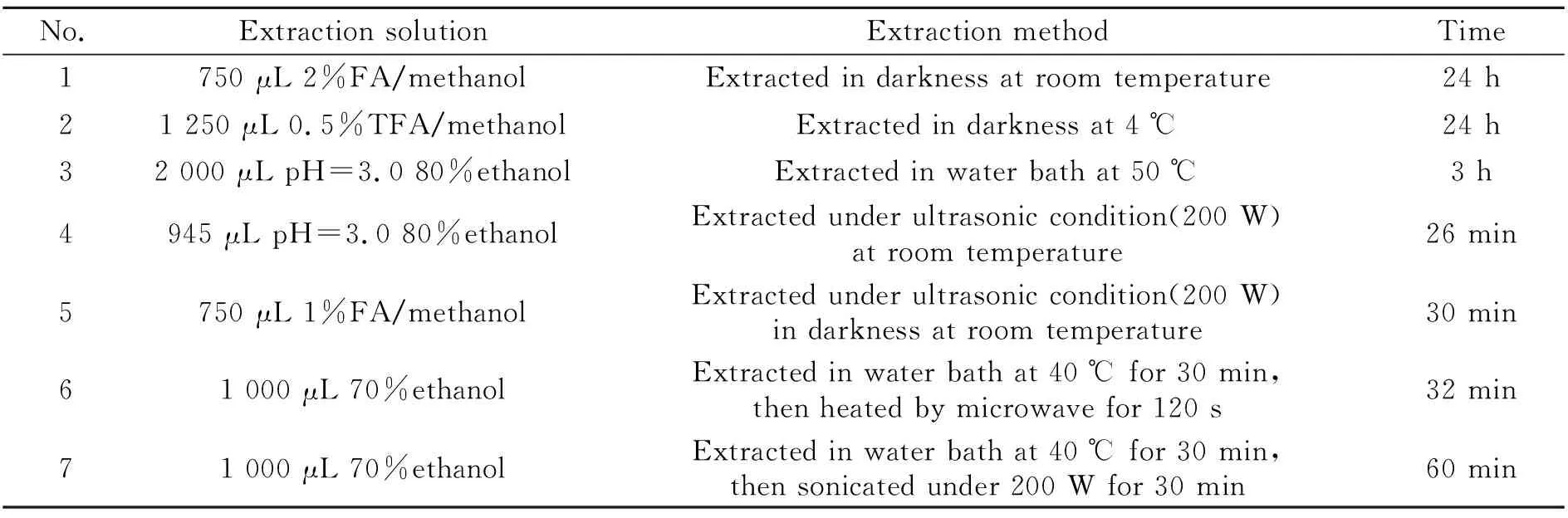
表1 黑枸杞中花色苷提取方法
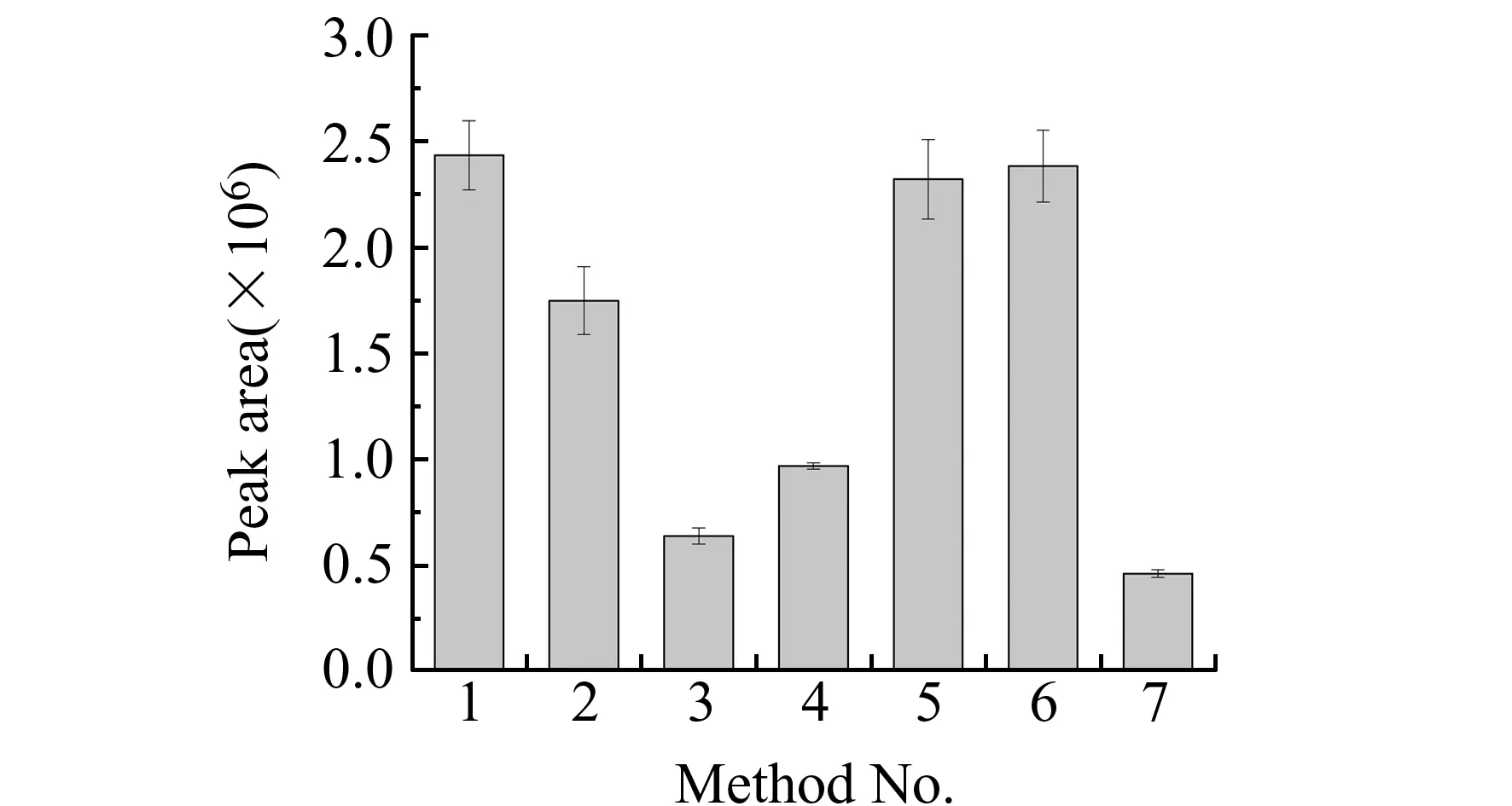
图4 花色苷的提取优化Fig.4 Optimization of anthocyanins extraction methods1-7 represented seven different extraction methods shown in Table 1,respectively.
2.3 标准工作曲线
分别以2%甲酸甲醇溶液为溶剂配制浓度为0.020、0.050、0.080、0、100、0.200、0.800 mg/mL的矢车菊素-3-O -葡萄糖苷标准溶液。按照优化条件进行HPLC-UV检测。以峰面积为纵坐标,质量浓度(mg/mL)为横坐标,得到线性回归方程为:y=2.00×107x-15 691,相关系数R2为0.9996。以3倍信噪比(S/N=3)计算得到仪器检出限为0.17 μg/mL,以S/N=10得到定量限为0.56 μg/mL。
在后续的计算中将P4与P7的峰面积之和代入线性回归方程,得到的花色苷总浓度单位为mg Cy/g黑枸杞(Cy指代矢车菊素-3-O -葡萄糖苷)。
2.4 方法学考察
2.4.1 稳定性实验取同一矢车菊素-3-O -葡萄糖苷标准品溶液,分别放置0、1、2、3、4、5、6、10、16、24 h后进行检测,计算样品中总花色苷峰面积的相对标准偏差(RSD)为1.76%,表明花色苷样品在24 h内保持稳定(表2)。
2.4.2 回收率实验向提取前的黑枸杞试样中加入浓度为1 mg/mL的标准溶液75 μL,与未加标的黑枸杞试样一样处理,得到上清液后,向未加标的试样中加入等量标品,进入HPLC检测。重复三次,回收率为89.18%,RSD为5.72%,见表2。均可满足检测要求。
2.4.3 精密度实验按照提取方法进行黑枸杞中花色苷的提取,重复三次,得到花色苷峰面积的日内精密度为1.96%;于3 d内连续进行此实验,得到日间精密度为7.37%(表2)。均符合检测要求。

表2 分析方法的精密度、稳定性以及加标回收率
2.5 实际样品分析
购买10种不同品牌黑枸杞产品,产地均为青海省,分别编号1~10,按拟定方法进行提取,优化方法进行检测,结果列于表3。这10种黑枸杞均产自青海省,但来自不同的市、区,主要为海西蒙古藏族自治州(格尔木市、诺木洪)和果洛藏族自治州,他们的价格差异巨大。一般来说,野生的黑枸杞价格贵于种植的,且颗粒越大价格越高。按照行业标准,颗粒直径3~4 mm的为小果,4~6 mm为中果,6~8 mm为大果。根据单因素方差分析结果,10种黑枸杞中花色苷含量存在显著性差异,说明不同品牌之间的黑枸杞花色苷含量差异巨大。将5、7、9号样品归于一组,为中果组,6、8、10号样品归于一组,为大果组,进行统计学分析,发现两组数据之间并不存在显著性差异,且同一品牌不同大小黑枸杞中也不存在显著性差异,即黑枸杞中总花色苷的含量与黑枸杞的颗粒大小并无明确关系。

表3 黑枸杞实际样品中花色苷检测结果
3 结论
本文对提取液中的花色苷进行质谱鉴定,鉴别出两种花色苷,分别为矮牵牛基-3-O -芸香糖苷(葡糖基-P-香豆酰基)-5-O -葡萄糖苷和矮牵牛基-3-O -芸香苷-5-O -葡萄糖苷,均含有牵牛花色素。实验在前人的基础上对比优化了黑枸杞中总花色苷的提取方法,最终采取以2%甲酸甲醇为溶剂,常温下避光浸提24 h的方法。随后建立了黑枸杞中总花色苷的半定量方法,以矢车菊素-3-O -葡萄糖苷标准品溶液建立工作曲线,方法学考察结果良好。检测了10种不同品牌的黑枸杞产品,发现总花色苷含量均在2.0 mg Cy/g黑枸杞以上,且不同品牌之间差异巨大。但是花色苷含量与黑枸杞颗粒大小、实际售卖价格均无明显关系。
