基于纳米多孔镍铂与石墨烯复合材料构建的电化学传感器对多巴胺的检测
2020-09-17杨小芳张书飞王庆飞崔荣静
周 行, 肖 雷, 杨小芳, 张书飞, 王庆飞*, 崔荣静*
(1.河北师范大学化学与材料科学学院,河北石家庄 050024;2.常熟理工学院江苏省新型功能材料重点实验室,化学与材料工程学院,江苏常熟 215500)
多巴胺(DA)是一种由脑内分泌的神经传导物质,其水平异常可能导致多种疾病,如精神分裂症、亨廷顿舞蹈症、帕金森病和痴呆等[1]。因此,多巴胺的测定已成为生物医学化学、神经化学以及诊断病理学研究等领域的重要课题[2]。目前用于多巴胺的测定包括高效液相色谱法[3]、质谱法[4]、分光光度法[5]及电化学法[6]等检测方法。与上述传统的分析方法相比,多巴胺的电化学测定因其灵敏度高、成本低和电流响应较快而备受科研工作者的关注[7]。在电化学分析中,修饰电极对多巴胺[8]的敏感和选择性检测起着重要作用。
纳米多孔金属材料因其制备方法相对简单、所制得的材料性能良好而备受关注,如:因纳米多孔金属材料的孔洞结构而具有较大的比表面积,可以为电化学中的氧化还原反应提供更多的催化活性位点;因纳米多孔金属材料的双联通结构而具有较广阔的电子运输通道,可以为反应中氧化还原反应中电子的得与失而提供有效的传递渠道。在纳米多孔金属材料体系中,Ni、Pt等金属元素因其具有独特的性能而被广泛应用。石墨烯(GR)是一种单原子层的二维碳材料,具有高的比表面积和电子转移速率[9],因其本身具有催化活性而被用作催化剂载体做电极修饰材料。本文主要是通过电弧熔炼、熔体快淬和脱合金技术制得纳米多孔镍(NP-Ni),然后将其置于0.8 mmol/L的H2PtCl6溶液中搅拌,致使Pt通过置换反应,从而制得纳米多孔镍铂(NP-NiPt)。最后将所制备的NP-NiPt与GR复合制得NP-NiPt/GR复合材料,用于修饰玻碳电极(GCE),从而成功构建NP-NiPt/GR/GCE电化学传感器用于多巴胺检测。
1 实验方法
1.1 仪器与试剂
CHI660E电化学工作站(上海辰华仪器有限公司);GDJ500C电弧熔炼及单旋系统(沈阳科友真空技术有限公司);EVO18扫描电镜(德国,ZEISS公司);Tecnai G220S -TWIN透射电镜(美国,FEI公司);SA-HF3 X射线粉末衍射仪(日本,Rigaku公司)。
Ni、Mn(99.99%,吉林东北有色金属有限公司);聚二烯丙基二甲基氯化铵(PDDA,20.0%)、Nafion(0.5%)(Sigma-Aldrich公司);石墨烯(GR,南京先丰纳米材料科技有限公司);多巴胺(DA)、尿酸(UA)和抗坏血酸(AA)(上海阿拉丁生化科技股份有限公司);(NH4)2SO4(分析纯,国药集团化学试剂有限公司);H2PtCl6(分析纯,上海强顺化学试剂有限公司);Na2HPO4、NaH2PO4(分析纯,上海凌峰化学试剂有限公司);N2(99.99%,常熟市琴湖工业气体厂)。实验用水为超纯水。
血清样品为常熟市第一人民医院提供。
1.2 NP-NiPt材料的制备
纳米多孔金属材料前驱体合金为Ni30Mn70。称取适量用电弧熔炼与熔体快淬方法制备Ni30Mn70合金条带,在管式炉中800 ℃下退火24 h,再将其置于1 mol/L (NH4)2SO4溶液中在50 ℃水浴锅下腐蚀48 h,用超纯水和乙醇洗涤4~5次,最后将材料置于真空干燥箱(45 ℃)中干燥24 h后研磨成粉,即可制得纳米多孔镍NP-Ni催化剂。
称取8 mg NP-Ni材料,再加入120 mL 0.8 mmol/L的H2PtCl6溶液,置于温度5 ℃和N2保护下持续搅拌1 h,使两个材料充分接触,以使Pt通过置换反应负载到NP-Ni材料的表面,制得NP-NiPt材料。最后用超纯水清洗材料数次并真空干燥24 h,备用。
1.3 修饰电极的制备
称取2 mg NP-NiPt与400 μL石墨烯(GR)溶液(用0.2%的PDDA分散处理)混合,然后超声1 h使溶液完全混合均匀,得到电极修饰材料NP-NiPt/GR的浓度为5 mg/mL。
将玻碳电极(GCE)在麂皮上用Al2O3粉末打磨抛光,用超纯水冲洗后,依次在乙醇和超纯水中超声清洗10 min。用超纯水充分冲洗,干燥后备用。首先取4 μL的NP-NiPt/GR涂滴于晾干的GCE上。待材料晾干后,取2 μL 0.5%Nafion溶液滴于材料之上,晾干即可得到NP-NiPt/GR/GCE。
1.4 电化学测试
电化学测试前往溶液里通入高纯N210 min除氧,所有测试过程均保持在25 ℃、N2气氛下进行测试。并在不同pH值的0.1 mol/L磷酸盐缓冲溶液(PBS)的电化学电解池中进行循环伏安实验。
2 结果与讨论
2.1 NP-NiPt的扫描电镜和透射电镜表征
从图1(A)的扫描电镜(SEM)图中可以看出,NP-Ni表面有星星点点的白色材料附着在上面,那就是通过简单的置换所负载上的Pt。图1(B)为高倍率下清楚的看到NP-NiPt材料表面的小孔洞,密密麻麻分布其中,为电化学反应提供更多的电子运输通道、比表面积和电催化活性位点。

图1 NP-NiPt低倍(A)和高倍(B)内部微观结构的扫描电镜(SEM)图像Fig.1 SEM images of low(A)and high(B)internal microstructure of the NP-NiPt
通过透射电镜(TEM)进一步观察NP-NiPt材料的内部晶格条纹结构。图2(A)中明暗相间的形貌说明所制备的NP-NiPt材料为多孔结构,与前面SEM图中所表达的形貌一致。而从2(B)图中可以清楚地看到均匀分布的晶格条纹,晶格间距分别为0.212 nm和0.219 nm,其分别对应于X射线衍射(XRD)图谱中的(111)晶面。说明所制备的NP-NiPt材料拥有较均匀的多孔形貌结构,为接下来的多巴胺检测提供了催化剂材料。

图2 NP-NiPt的透射电镜(TEM)(A)和高分辨透射电镜(HRTEM)(B)图像Fig.2 TEM image(A) and HRTEM image (B) of the NP-NiPt
2.2 NP-NiPt的X射线衍射和能谱分析

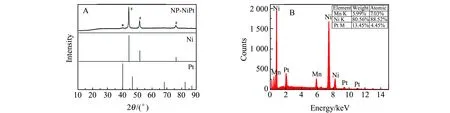
图3 NP-NiPt粉末的X射线衍射(XRD)(A)和能谱(EDS)(B)谱图(:Ni;*:Pt)Fig.3 XRD patterns (A)and EDS(B) of NP-NiPt powders(:Ni;*:Pt)
2.3 不同修饰电极的电化学行为
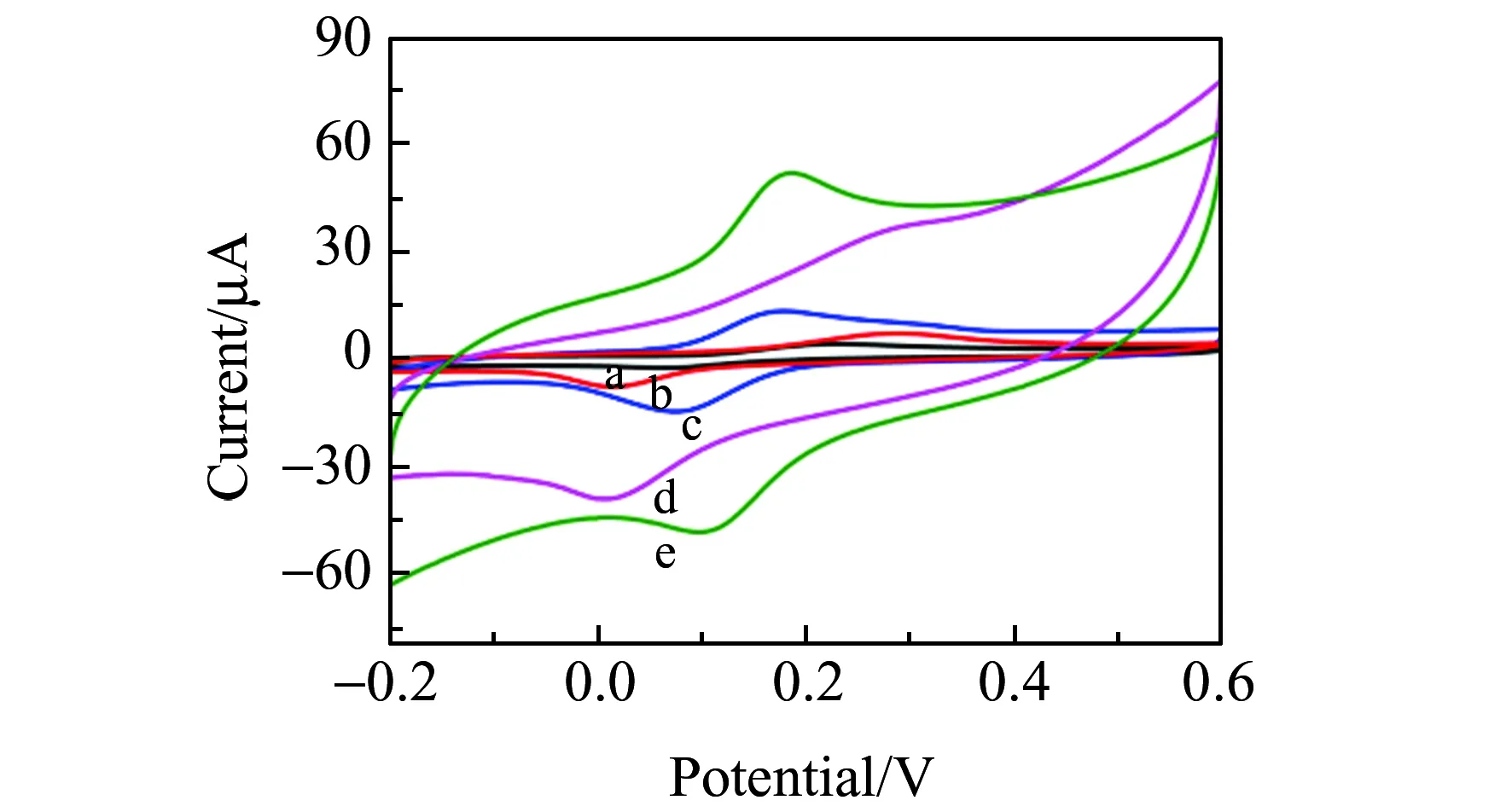
图4 裸GCE(a)、NP-Ni/GCE(b)、GR/GCE(c)、NP-NiPt/GCE(d)和NP-NiPt/GR/GCE(e)在含有0.1 mmol/L DA的PBS(pH=7.0)中的循环伏安(CV)图Fig.4 CVs of bare GCE(a),NP-Ni/GCE(b),GR/GCE(c),NP-NiPt/GCE(d),and NP-NiPt/GR/GCE(e)in phosphate buffer solution(pH=7.0)containing 0.1 mmol/L DA
通过循环伏安(CV)法探究了在0.1 mol/L的PBS(pH=7.0) 中检测多巴胺在不同修饰电极上的电流响应。图4分别显示了含有0.1 mmol/L多巴胺的裸GCE(a)、NP-Ni/GCE(b)、GR/GCE(c)、NP-NiPt/GCE(d)和NP-NiPt/GR/GCE(e)的电流响应,可以看出各修饰电极对多巴胺的催化作用不同。从图上可以看出多巴胺在NP-NiPt/GCE(d)上的电流响应与NP-Ni/GCE(b)相比有显著增强。第一是由于NP-NiPt材料表面的小孔洞,为反应提供更大的比表面积、更多的电子运输通道和电催化活性位点。第二是由于纳米Pt具有较高的电催化活性。与其他电极相比,多巴胺在NP-NiPt/GR/GCE(e)上的伏安响应值最大,显示了清晰的氧化还原过程,这主要归功于石墨烯和NP-NiPt材料具有较大的比表面积和导电性能,以及NP-NiPt和石墨烯的协同作用,提高了修饰电极的催化能力。因而,NP-NiPt/GR/GCE电化学生物传感器对多巴胺的检测具有良好的催化活性。
2.4 底液酸度的影响
利用CV法在NP-NiPt/GR/GCE修饰电极上,在不同pH(4.0~9.0)的PBS中对多巴胺进行CV分析。由图5(A)知,NP-NiPt/GR/GCE上多巴胺的氧化还原电流响应随pH的改变而改变,其氧化还原峰峰电位随着pH值增大均向负电位方向移动,说明质子参与了该化学反应。图5(B)则描述了该反应过程中pH值和氧化峰、还原峰值电流之间的关系,可以明显的看到多巴胺的氧化峰、还原峰电流值随着pH从4.0增加到7.0,在pH=7.0处氧化峰、还原峰电流强度都到达其最大值,然后显著降低。所以,选择pH=7.0的0.1 mol/L PBS作为以下实验过程中的最佳电解质溶液。图5(C)是溶液pH值与多巴胺的氧化峰电位(Epa)、还原峰电位(Epc)具有良好的线性关系,其线性回归方程分别为:Epa(V)=-0.031pH+0.406(R2=0.992),Epc(V)=-0.024pH+0.165(R2=0.994)。

图5 NP-NiPt/GR/GCE在不同pH的PBS(4.0~9.0)中对DA的CV图(A)。pH对氧化还原(Ipa、Ipc)电流(B)和氧化还原(Epa、Epc)电位(C)的影响Fig.5 CVs of NP-NiPt/GR/GCE in different pH PBS (4.0~9.0) of DA(A).Effect of pH on Ipa and Ipc current(B)and Epa and Epc potential(C)
2.5 扫描速率的影响
图6(A)是不同扫速下的CV图。由图可以看出多巴胺的氧化还原峰峰电流强度随着扫速的逐渐增加而增加,且其氧化还原电位(Epa和Epc)亦略有变化。图6(B)、6(C)为扫速与氧化还原峰值电流、电位的线性关系拟合图。由图可知,在50~500 mV/s的线性扫描范围内,NP-NiPt/GR/GCE上多巴胺的氧化峰电流(Ipa)、还原峰电流(Ipc)与扫速(v)成线性关系,其线性回归方程分别为:Ipa(μA)=0.081v(mV/s)+19.372(R2=0.991),Ipc(μA)=-0.142v(mV/s)-20.789(R2=0.990);NP-NiPt/GR/GCE上多巴胺的氧化(Epa)、还原(Ipc)峰值电位与扫速(v)成线性关系,其线性方程可分别表示为:Epa(μA)=1.7757×10-4v(mV/s)+0.086(R2=0.993),Epc(μA)=-2.0009×10-4v(mV/s)+0.165(R2=0.992)。由此可知,NP-NiPt/GR/GCE修饰电极催化多巴胺的氧化还原反应为吸附控制过程。
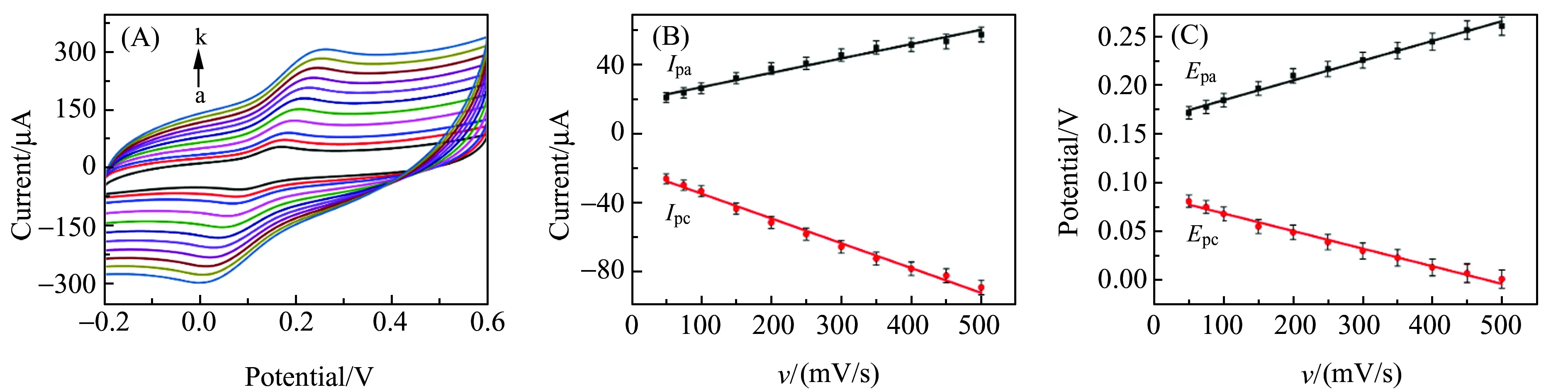
图6 NP-NiPt/GR/GCE在PBS(pH=7.0)中对DA检测中不同扫速(a~k:50~500 mV/s)的CV图(A)。扫速对氧化还原(Ipa、Ipc)电流(B)和氧化还原(Epa、Epc)电位(C)的影响Fig.6 CVs of DA in phosphate buffer solution(pH=7.0) at NP-NiPt/GR/GCE with different scan rates (a - k:50 - 500 mV/s)(A).Effect of sacn rate on Ipa and Ipc current(B)and Epa and Epc potential(C)
2.6 线性范围与检出限
构建的NP-NiPt/GR/GCE电化学传感器运用差分脉冲伏安(DPV)技术对多巴胺进行定量检测,图7(A)为多巴胺的DPV响应曲线。由图可见,随着多巴胺浓度的不断增加,多巴胺的峰值电流随之增加;其插图为浓度从0.5~25 μmol/L的DPV响应曲线,可以很清晰的看到当多巴胺浓度仅为0.5 μmol/L时,就已出现氧化峰,说明该传感器的检出限较低。图7(B)显示其回归曲线在低浓度范围内表现出较宽的线性浓度范围:0.5~300 μmol/L,其线性回归方程表示为:Ipa(μA)=0.106c(μmol/L)+0.541(R2=0.993),检出限(S/N=3)为0.41 μmol/L。NP-NiPt/GR/GCE电化学传感器与其他检测多巴胺的方法的比较如表1所示。通过对比,可以表明实验中的NP-NiPt/GR/GCE电化学生物传感器相对于其他方法具有较宽的线性浓度检测范围和较低的检出限。

图7 (A)NP-NiPt/GR/GCE在PBS(pH=7.0)中对不同浓度(a~q:0.5~300 μmol/L)DA的DPV响应(插图:浓度从0.5~25 μmol/L的DPV响应);(B)DA的校正曲线Fig.7 (A)DPVs response for the different concentration(a - q:0.5 - 300 μmol/L)of DA at NP-NiPt/GR/GCE in PBS(pH=7.0)(Inset:DPVs response concentration ranging from 0.5 - 25 μmol/L);(B) Calibration curve for DA

表1 各种修饰电极对多巴胺检测的比较
2.7 重现性、稳定性及选择性研究
为了研究构建的NP-NiPt/GR/GCE传感器的重现性,在最优的实验条件下,用同一支修饰电极连续测定0.1 mmol/L多巴胺9次,其相对标准偏差(RSD)≤2.75%。用不同批次的9根修饰电极测定0.1 mmol/L多巴胺,其RSD≤3.05%。当NP-NiPt/GR/GCE修饰电极在4 ℃冰箱中保存超过15 d,多巴胺的电流响应信号相对于初始信号的下降幅度小于3.30%。结果表明NP-NiPt/GR/GCE对多巴胺的检测具有良好的重现性和稳定性。
实验中同时对100倍的KCl、NaCl、葡萄糖、抗坏血酸和尿酸等共存物质的干扰进行了检测,多巴胺的峰值电流略有变化(小于2.0%)。抗坏血酸、尿酸的电化学氧化对DA的电流响应影响也不大(小于7.0%)。这些表明所构建的NP-NiPt/GR/GCE电化学生物传感器具有良好的选择性和稳定性。我们推测,一是因为传感器使用了较高催化性能的电极材料,二是因为在修饰电极过程中,Nafion膜的使用可以对电极上的修饰材料起到保护作用,使得电极不受污染,同时防止材料脱落;另外Nafion膜使电极与溶液分开,某些离子可以透过膜到达电极表面进行反应,而有些离子就被隔在膜外,从而使测定的选择性得到提高。
2.8 实际样品分析
用DPV法对人体血清样品中的多巴胺进行了直接分析,探讨了NP-NiPt/GR/GCE电化学传感器在实际样品分析中的应用。血清样本在测量前用PBS(pH=7.0)稀释100倍,未进行其他预处理。经计算,该方法的回收率范围为99%~102%,RSD小于4.0%。说明在实验条件下,构建的电化学生物传感器可用于实际样品中多巴胺的测定。
3 结论
本文构建了具有高催化性能的NP-NiPt/GR/GCE电化学生物传感器,用于检测生物小分子多巴胺。该电化学生物传感器对多巴胺具有优异的电催化活性,对多巴胺检测的线性浓度检测范围为0.5~300 μmol/L(R2=0.993),检出限为0.41 μmol/L。
