响应面法优化-高分辨质谱鉴定玛卡中蛋白
2020-09-17熊雅茹
熊雅茹, 傅 红, 杨 方
(1.福州大学生物科学与工程学院,福建福州 350108;2.福州海关技术中心,福建福州 350001;3.福建省检验检疫技术研究重点实验室,福建福州 350001 4.福州大学福建省海洋酶工程重点实验室,福建福州 350108)
玛卡(EpidiummeyeniiWalp)原产自秘鲁,被称为“秘鲁人参”。2011年起成为我国的新资源食品[1]。有文献报道,玛卡具有抗疲劳和改善内分泌等作用[2 - 4],玛卡中蛋白含量约为20%[5],而蛋白质是衡量食品营养价值的重要指标。玛卡多肽是由玛卡蛋白酶解后形成的片段,含有较大比例的寡肽和氨基酸,具有一定的营养价值和生理功能[6],目前国内外少有对玛卡多肽活性与功能的研究。
目前,蛋白质提取主要有溶液提取、酶法提取、超声波辅助提取、双水相萃取、反微团萃取等方法[7]。水溶液提取法是目前提取蛋白质使用最广的一种方法[8],而响应面分析法是一种非常有效的数学与统计方法相结合的数据分析手段。本文用碱提酸沉法提取玛卡蛋白,先经单因素实验,以蛋白提取率为指标初步确定各因素的适宜水平,然后通过响应面试验对碱法提取工艺进行优化,再通过多点测定蛋白等电点,最大程度提取玛卡蛋白。胰蛋白酶、胃蛋白酶模拟消化酶解玛卡蛋白,高分辨质谱分析玛卡多肽,Uniprot匹配其多肽序列与对应生物来源、分子功能等,对进一步了解玛卡多肽与功能的对应关系具有积极意义。
1 实验部分
1.1 仪器与试剂
DIONEX UltiMate 3000超高效液相色谱:美国Dionex公司产品;四极杆静电场轨道阱高分辨质谱仪(Q-Exactive):美国Thermo Fisher Scientific公司产品;全自动定氮仪:Kjeltec 8400 Analyzer Unit;CR21N台式冷冻离心机:日立公司产品;FreeZone®TriadTM2.5L冷冻干燥机:美国LABCONCO公司产品;UV-2700紫外-可见分光度计:日本岛津仪器有限公司产品。
玛卡:湖南省医药公司;Tris:生工生物工程股份有限公司产品;胰蛋白酶:2.5×105U/g,厦门泰京生物技术有限公司;胃蛋白酶:美国Sigma-Aldrich公司产品;乙腈、甲酸、甲醇均为色谱纯,Thermo Fisher公司产品;三氯乙酸:分析纯,国药集团产品;C18固相萃取柱(500 mg/3mL):美国Supelco公司产品。
1.2 实验方法
1.2.1 玛卡蛋白含量及提取率的测定玛卡原料的蛋白质含量参照国家标准(GB/T 5009.5-2010)中的凯氏定氮法测定,考马斯亮蓝法测定碱液提取法上清液中蛋白质含量。碱法提取蛋白得率为碱提上清液中蛋白质含量与原料中蛋白质含量的比值。
1.2.2 玛卡中多肽的提取玛卡原料粉粹过80目筛,按料液比1∶45(g∶mL)加入pH=10的Tris-HCl缓冲液,40 ℃水浴70 min,取出于4 ℃、18 000 r/min离心10 min,取上清液用0.5 mol/L HCl调节至有絮状沉淀,再于4 ℃、18 000 r/min离心10 min,弃上清液取沉淀,-70 ℃预冻12 h后,-80 ℃真空冷冻干燥2 d,得玛卡冻干蛋白[9]。分别取玛卡冻干蛋白0.2 g溶于10 mL超纯水中,以0.5 mol/L NaOH溶液调节pH为7.0~8.5,分别加入1.6×104U胰蛋白酶、胃蛋白酶于37 ℃、40 ℃水浴酶解4 h后,沸水浴10 min灭酶活[10],4 ℃、18 000 r/min离心10 min,取上清液备用。C18固相萃取柱依次用3 mL甲醇、3 mL水活化。取上清液3 mL过柱,用10 mL甲醇洗脱,收集洗脱液,45 ℃氮吹至近干,用1 mL 0.1%甲酸水溶液溶解,过0.45 μm滤膜,待测[11]。
1.2.3 仪器条件色谱条件:Hypersil GOLD UPLC C18柱(100 mm×2.1 mm,1.9 μm);柱温:30 ℃;流动相:A为0.1%甲酸水,B为乙腈。洗脱梯度:0~50 min,10%~90%B;50~55 min,90%B;55~56 min,90%~10%B;56~60 min,10%B;流速:0.3 mL/min;进样量:10 μL。质谱条件:电喷雾离子源(ESI):载气为高纯氮气(纯度>99.5%),鞘气流速40个单位(arb),辅气流速15个单位(arb),吹扫气流速0个单位;喷雾电压3.2 kV;碰撞池采用梯度碰撞能量:25%、35%、55%;毛细管温度320 ℃,离子透镜电压频率(S-lens RF level)为60,辅气热源温度350 ℃[12]。扫描模式:Full MS/dd-MS2,分析时长60 min,检测方式:正离子,母离子扫描范围:m/z100~1 500,一级质谱分辨率:70 000 atm/z,AGG target:le6,一级Maximum IT:100 ms,扫描范围数:1,动态排除(Dynamic exclusion):40.0 s一次,MS2解离模式:HCD,隔离窗口:0.4m/z;二级质谱分辨率:17 500 atm/z200,微扫描:1,二级Maximum IT:50 ms,碰撞能量:30 eV,欠填比:0.1%。
1.2.4 数据分析采用MaxQuant(版1.6.1.0)进行数据分析。搜索针对包含来自Uniprot的玛卡(uniprot-Brassicaceae.fasta)的661726种蛋白质序列(https://www.uniprot.org,2018年10月28日下载)数据库。蛋白FDR设置为0.01;最小氨基酸长度设置为3;可变修饰设为N-Acetyl和Oxidation(M);固定化修饰设置为Carbamidomethyl(C);酶的设置分别选择非专一性和专一性,其中专一性酶分别设置为胰蛋白酶、胃蛋白酶;最大裂解丢失设置为2,所有常见的污染物和相反的命中被删除[18]。
2 结果与讨论
2.1 提取条件探讨
实验选取对蛋白提取率影响较为显著的提取缓冲液浓度、提取时间、提取液的pH值、提取料液比、提取温度5种因素进行了探讨。其中,提取缓冲液浓度分别为0.02、0.04、0.06、0.08和0.1 mol/L;提取时间分别为30、40、50、60和70 min;提取液pH值分别7.5、8.0、8.5、9.0、9.5和10;提取料液比分别为1∶20、1∶25、1∶30、1∶35、1∶40和1∶45(g∶mL);提取温度分别为30、40、50、60和70 ℃。结果表明:一定范围内盐溶液增加,蛋白质分子表面电荷随之增加,蛋白质-水相互作用增强,促进蛋白溶解度增加,超出该范围会破坏蛋白胶体性质使其溶解度降低,故最佳提取缓冲液浓度为0.06 mol/L。随着提取时间的增长,提取率先缓慢增加后降低,可能是蛋白质的沉淀或分解导致的,70 min时有最大值35.96%。提取率随时间变化的幅度非常平缓,影响不显著,综合考虑最优提取时间40 min。pH=7.5~10.0内,随着pH增高,提取率以渐慢增长幅度随之增大,pH=10.0时提取率达最大值35.26%,约为pH=7.5时的1.7倍,在pH=8.0后总体变化趋势较平缓,考虑选取最佳提取pH=10.0。蛋白质在特定溶液中溶解度一定,达到该提取料液比时,能溶解的蛋白全部溶出且刚好达到或仍未达饱和,此时增大提取液体积,提取率不再升高,反而给后续废水处理造成麻烦[13],故1∶40(g∶mL)为最佳提取料液比。30~40 ℃时,提取率随温度的升高显著增大,之后增势较缓,60 ℃时提取率达最大值36.64%,温度升至70 ℃时,部分蛋白质变性沉淀导致提取率降低,故最佳提取温度为60 ℃。
2.2 响应面优化结果与分析
2.2.1 响应面优化实验上述单因素实验结果显示出5个因素中对玛卡蛋白提取率影响较为显著的水平范围,响应面优化试验将结果突出的实验水平重新组合,探究各因素间交互作用对结果的影响。选取对玛卡蛋白提取影响较大的3个因素,提取液Tris-HCl浓度(A)、提取温度(B)和提取料液比(C)3个因素建立3因素3水平的试验,并得出玛卡蛋白提取最佳工艺条件,响应面试验因素水平见表1。

表1 响应面试验因素水平
2.2.2 响应面分析综合单因素试验结果,以蛋白提取率Y为响应值,提取缓冲液浓度A,提取温度B,提取料液比C三因素进行响应面试验,所得结果见表2。玛卡蛋白提取率范围在24.08%~45.63%,缓冲液浓度0.06 mol/L、提取温度70 ℃、提取料液比为1∶45时所得玛卡蛋白最多。利用Design-Expert 10数据处理软件对表2所列玛卡蛋白提取响应面试验结果进行二次效应面回归分析,所得拟合方程如下:
Y=34.61-0.69A+3.44B+4.66C-0.22AB+0.23AC-0.40BC+3.33A2+2.87B2-2.22C2

表2 响应面试验设计与结果


表3 回归模型方差及可信度分析表
图1反映了Tris-HCl浓度(A)、提取温度(B)、提取料液比(C)3个因素之间的交互作用对玛卡蛋白提取率的影响。响应面能较直观地体现其他条件固定时各交互项对提取率的影响,图中曲线走势越陡,该因素对提取率影响越大;走势平滑,则影响较小。等高线的形状反映两因素交互作用的程度,椭圆形说明交互作用显著,若为圆形则反之[16]。由图1(A)可知,因素A及因素B的等高线形状近似为圆形,表明其对蛋白提率无显著交互作用,这与方差分析结果相一致。图1(B)中可知因素C在相应曲面上的坡度比因素A对应的曲面更陡,说明对应范围内的料液比对提取率的影响比Tris浓度更为显著。而图1(C)中在温度高于60 ℃后,等高线越趋密集,说明随着温度升高,因素B对提取率的影响渐为显著,因素B及C值增加对提率影响愈显著。
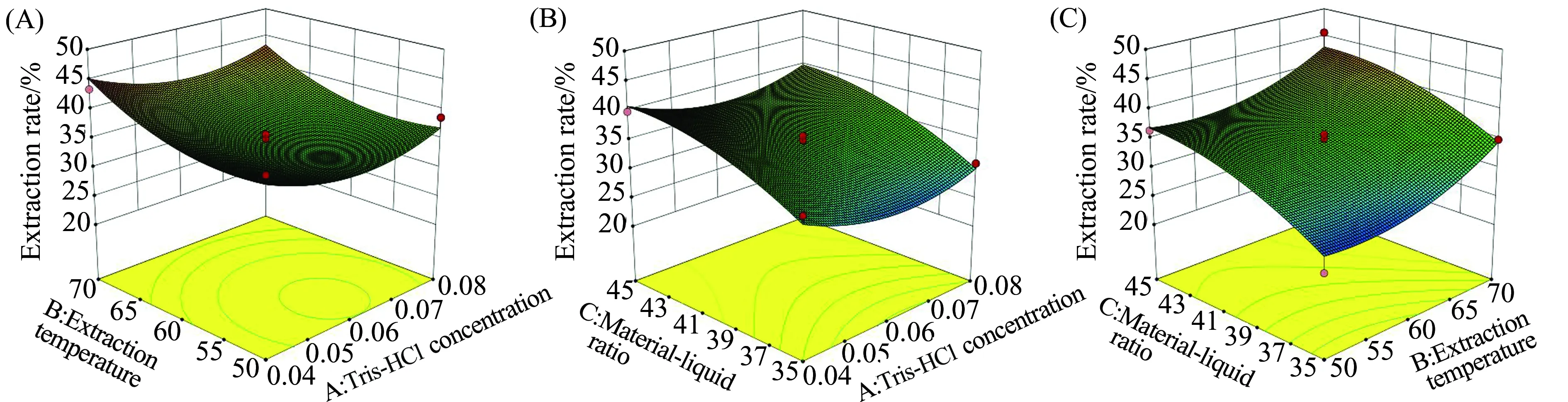
图1 Tris浓度(A)、提取温度(B)和料液比(C)对玛卡蛋白提取率的交互作用Fig.1 Interaction of Tris concentration(A),extraction temperature(B) and material-liquid ratio(C) on Maca protein extraction
2.2.3 响应面验证由Design-Expert根据建立的模型得到的优化组合及单因素实验结果可知,玛卡蛋白最佳提取工艺条件为:Tris-HCl浓度0.04 mol/L,提取温度70 ℃,pH=10.0,提取时间40 min,料液比1∶44.03(g∶mL)。根据实际情况调整为Tris-HCl浓度0.04 mol/L,提取温度70 ℃,pH=10,提取时间40 min,料液比1∶45(g∶mL),做3次平行试验,蛋白提率为45.69%,与模型预测理论值46.49%接近。表明该回归模型能较好的预测玛卡蛋白提取率,得到的提取工艺参数科学可靠。
2.3 等电点测定结果
蛋白质处于等电点状态时会被凝集沉淀下来,此时蛋白沉淀量最高,因此多点测定碱法提取后上清液中蛋白等电点。分别取等量碱提后上清液,以0.5 mol/L HCl调节pH,沉淀后再次离心,考马斯亮蓝法测沉淀前后上清液中蛋白质含量,上清液中蛋白质残留率最低时的pH值即为玛卡蛋白等电点[17]。从表4可知,pH=2.0~3.0时,蛋白质沉淀效果较佳。综合数据,pH=2.5为玛卡蛋白质等电点。

表4 玛卡蛋白等电点试验设计及结果
2.4 酶解条件优化
常规的酶解反应往往需要12 h以上,工作效率低,且易引发副反应。从生理学上看,人体正常消化时间为4~6 h,且主要经胰蛋白酶、胃蛋白酶作用[19]。鉴于此,本文分别考察了胰蛋白酶、胃蛋白酶的酶解条件,结果表明酶解时间为4 h时的效果较好。
2.5 肽段鉴定结果
玛卡蛋白经胰蛋白酶、胃蛋白酶分别酶解,经液相色谱-质谱3次重复检测分析,Maxquant软件处理液相色谱-质谱数据,胰蛋白酶、胃蛋白酶三次酶解后的共有肽段所得结果见表5、表6。
以胰蛋白酶酶解进行3次重复检测获得共鉴定14条共有肽段,其中找到生物来源的有4条。其中来源于BnaAnng34060D蛋白的LSANIDGLSR,具有脂肪酶活性,参与脂质代谢过程;SAPIVSGVKKPHR来源于组蛋白H3,可与DNA结合,具有蛋白质异二聚化活性。以胃蛋白酶酶解进行3次重复检测获得共鉴定19条共有肽段,能找到生物来源的有5条,多属于酶类。ITLFDYYR来自于tRNA合成酶II类(D,K和N)家族蛋白,具有氨酰-tRNA连接酶活性,参与用于蛋白质翻译的tRNA氨酰化过程;LFVSNGELK来自于谷胱甘肽水解酶2,具有催化活性,参与谷胱甘肽代谢途径,是硫代谢的一部分;来自醛脱氢酶的VFGAVEASDLVK具有氧化还原酶活性,作用于供体的醛或氧代基团,NAD或NADP作为受体,参与细胞醛代谢过程;VGITKAAHQQR来自于生长素响应因子,参与生长素激活信号通路、转录调节等生物过程。
综合数据,玛卡多肽经胰蛋白酶、胃蛋白酶分别酶解得到的序列不尽相同,但多肽均主要来源于油菜、甘蓝等植物。所检测的玛卡多肽主要集中在6~13个氨基酸之间,最长的是来自Noccaeacaerulescens(高山扁豆)的SAPIVSGVKKPHR,但检测的玛卡多肽数量仍较少,且生物功能不显著,后续可再进行研究探讨。
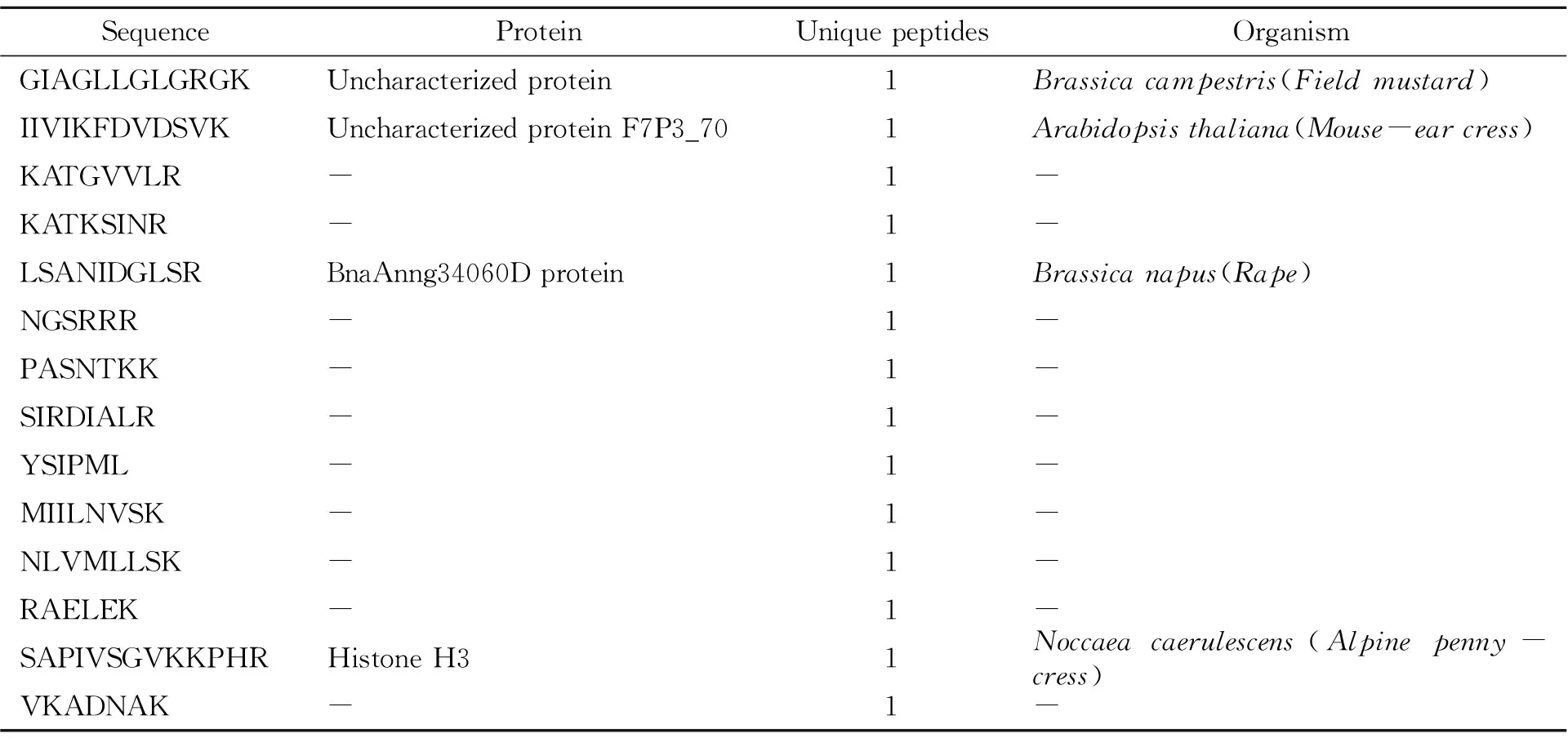
表5 玛卡胰蛋白酶3次酶解共有肽段

表6 玛卡胃蛋白酶3次酶解共有肽段
3 结论
本文用响应面法优化得到了玛卡蛋白提取的最优方案。进一步模拟消化过程,胰蛋白酶、胃蛋白酶分别单独酶解玛卡蛋白,UPLC-Q-Exactive四极杆-静电场轨道阱高分辨质谱联用仪分析,所得结果经Uniprot搜库匹配分析,共检测出6条有明确生物来源以及分子功能的多肽,这些多肽多存在于同种属的甘蓝、拟南芥等植物中,分子功能与生物活性不一,但总体而言检测到的多肽数量仍然较少,呈现的功能活性有限,推测是因为酶解玛卡蛋白的最适酶是碱性蛋白酶而非模拟消化过程中的胰蛋白酶、胃蛋白酶。虽然玛卡多肽曾被认为有较强的功效,但目前为止尚未有明确证据支持,而这也与我们的检测结果相一致。目前采用高效液相色谱-质谱联用技术研究玛卡多肽的报道较少,本文可为玛卡多肽的研究提供新的思路和实验基础。
